骨髓增生异常综合征患者中TET2基因突变的检测与临床意义
2012-01-06吴芬陈苏宁蒋慧王谦潘金兰吴亚芳丁家华陈宝安余正平程坚王俊赵刚
吴芬,陈苏宁,蒋慧,王谦,潘金兰,吴亚芳,丁家华,陈宝安,余正平,程坚,王俊,赵刚
(1.东南大学医学院,江苏 南京 210009;2.东南大学附属中大医院 血液科,江苏南京 210009;3.江苏省血液病研究所,江苏 苏州 215006)
骨髓增生异常综合征(MDS)是一组造血干细胞恶性克隆性疾病,其特征为髓系细胞(粒系、红系、巨核系)一系或多系发育异常和无效造血,外周血细胞一系或多系减少及急性髓细胞白血病(acute myelogenous leukemia,AML)转化的高风险性[1]。DNA甲基化在MDS发病中起重要作用。近年来,去甲基药物地西他滨已被证实对MDS患者有肯定疗效,已成为一线治疗药物[1-4]。2008 年,Delhommeau 等[5]首次在髓系肿瘤中发现一种新的TET2基因。该基因是TET家族的一个成员,位于4q24,大小约150 kb,有11个外显子,可能是一种抑癌基因,参与5-甲基胞嘧啶与5-羟甲基胞嘧啶之间的转化,调节甲基化[6]。有报道称其与恶性血液系统疾病有关[7-8]。目前多项研究[5,9]显示,在髓系肿瘤中发现有 TET2 基因突变,以MDS多见,且突变发生于96%的骨髓原始细胞,提示其与该病的发生密切相关。MDS患者预后不良,约30%的转化为AML,但多数死于骨髓衰竭引起的并发症[10]。本研究通过检测MDS患者中TET2基因突变的发生率来初步探讨该基因突变对患者预后的影响。
1 对象与方法
1. 1 研究对象
随机选取2002年至2010年于东南大学医学院附属中大医院血液科与苏州大学附属第一医院血液科95例初诊MDS患者。男56例,女39例,男女之比为1.44∶1;中位年龄为55岁(15~79岁)。根据2008年WHO分类和分型标准进行诊断与分型[11],参照MDS标准方案进行治疗与疗效评价[12]。
1. 2 方法
1.2.1 抽提基因组DNA及PCR 取患者骨髓单个核细胞5×106个或染色体悬液,PBS洗涤1次。选用Invitrogen公司(美国)提供的PureLinkTMGenomic DNA Kits试剂盒抽提基因组DNA,使用DNA测定仪检测产物的浓度和纯度后储存于-20℃冰箱备用。PCR总体系为 25 μl:MIX(TIAN GEN)12.5 μl,基因组 DNA模板 1 μl,上游、下游引物各 1 μl,ddH2O 9.5 μl,反应条件及引物序列见表1。PCR产物经1.2%的琼脂糖凝胶电泳(电压110 V,电流400 mA,时间40 min),紫外光透视仪分析图像并照相。PCR产物于4℃冰箱保存,1周内测序。

表1 TET2基因引物序列
1.2.2 染色体核型分析 骨髓细胞经过24 h短期培养后,按常规制备染色体悬液,热变性R显带,平均每例分析20个中期分裂相,根据《人类细胞遗传学国际命名制(ISCN2005)》进行核型描述。
1.2.3 基因突变检测 PCR扩增产物送至上海裕晶生物科技公司完成测序,结果与NCBI人类TET2基因序列进行比对,检出突变。
1. 3 统计学处理
采用统计学软件SPSS 17.0。定量资料采用秩合检验或精确t检验,数据以¯x±s或中位数表示;定性资料采用χ2检验,生存情况描述运用Kaplan-Meier曲线,双侧P<0.05为差异有统计学意义。
2 结 果
2. 1 临床特征
据2008年WHO分类和分型标准对95例初诊MDS患者进行诊断和分型,MDS-RCUD 18例,占18.9%,RA 7例,RT 1例,RN 1例;MDS-RARS 3例,占3.1%;MDS-RCMD 21例,占22.1%;MDS-RAEB1 15例,占15.8%;MDS-RAEB2 19例,占20.0%;MDSU 19例,占20.0%。中位白细胞数值为2.9×109L-1[(0.8~34.4)×109L-1],中位中性粒细胞数值为1.22×109L-1[(0 ~10.54)×109L-1];中位血小板数值为72×109L-1[(10 ~615)×109L-1];中位血红蛋白值为 74 g·L-1(30 ~142 g·L-1);外周血 3 系正常2例,单系减少19例,2系减少40例,3系减少34例;IPSS危险分级为:低危组6例,中危1组65例,中危2组18例,高危组6例。
2. 2 TET2 突变检测
95例初诊MDS患者中有11例发生TET2基因突变,突变率为11.6%(95%CI为5.2% ~18.0%),包括点突变、插入突变和缺失突变,其中6例发生错义突变,1例出现2次错义突变,2例同义突变,2例无义突变;5例突变出现于3号外显子,2例于6号外显子,1例于7号外显子,3例于11号外显子。TET2基因突变集中于3号外显子并且以错义突变多见。该11例TET2基因突变患者的临床特征及突变相关信息见表2与图1。
2. 3 TET2基因突变临床意义
对95例初诊MDS患者进行随访,随访截止日期至2011年06月30日,随访有效率为63.2%。60例患者中位随访时间为13个月(2~73个月),随访中死亡的患者均死于MDS。发生TET2基因突变的初诊MDS患者有11例,中位生存期9个月(5~28个月);未发生该基因突变者有51例,中位生存期为15个月(3~73个月)。将随访到的60例初诊MDS患者分为两组(突变组与野生组)进行统计学分析,结果显示两组患者在性别、年龄、血红蛋白计数、白细胞计数、中性粒细胞计数及骨髓原始细胞所占比例上均无统计学差异(P>0.05);再根据IPSS国际预后评分系统,两组患者在外周血血象减少种类和细胞遗传学方面亦无统计学差异(P>0.05)。数据分析显示,突变组MDS患者6年累积存活率为11.1%(1/9),野生组患者6年累积存活率为55.74%(34/61),两组患者总生存率有明显的统计学差异(P<0.05),伴有TET2基因突变的MDS患者中位生存期较未发生突变者短(9个月vs 15个月,P=0.000)(见图2),两组MDS患者的一般临床资料见表3。

表2 TET2基因突变的11例MDS患者的临床特征与突变相关信息
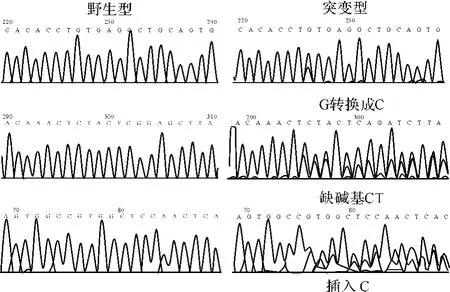
图1 TET2基因突变类型
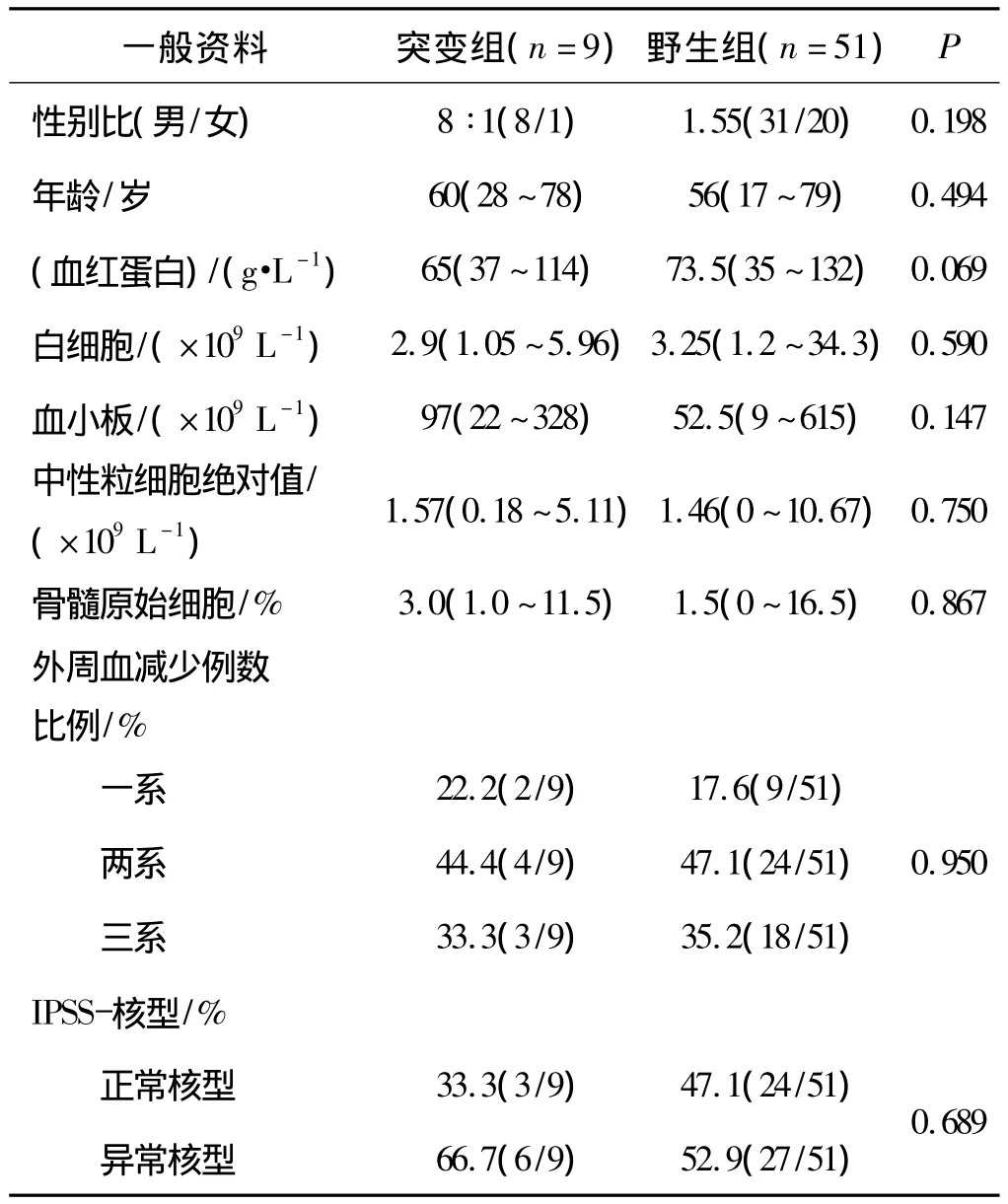
表3 TET2基因突变组与野生组MDS患者一般临床资料
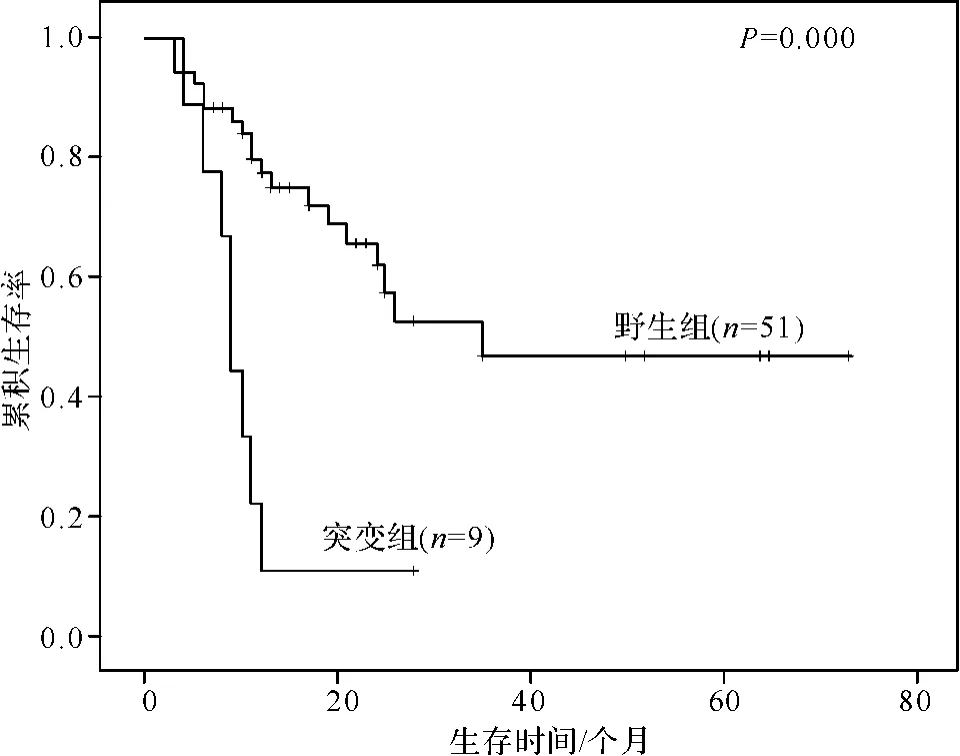
图2 TET2基因突变与未突变的MDS患者生存曲线
3 讨 论
在髓系肿瘤中,MDS是一组源于造血干细胞的恶性克隆性疾病。形态学(外周血和骨髓)、免疫学、细胞遗传学及IPSS预后积分系统,是MDS诊断分型与预后评价的主要方法和标准。染色体核型分析与荧光原位杂交(fluorescence in situ hybridization,FISH)作为细胞遗传学分析的重要手段[10,13],约50%的 MDS患者可检测到细胞遗传学异常[10]。根据IPSS预后评分标准,仅几种再现性染色体异常,如-5/5q-、-7/7q-、20q-、-Y等与MDS的预后有关。近年来,在髓系肿瘤中发现多种基因突变如 TET2、RUNX1、CBL 等[6,14],可能与疾病的发生发展有关[5,7,14],这些微小分子异常采用常规检测方法较难发现。2009年,Langemeijer等[9]在MDS患者中通过基因芯片和基因测序法检测出TET2基因突变(26%),且96%骨髓原始细胞包括CD34+祖细胞在内的各系分化细胞中均有该基因突变,提示其与MDS发病有关。此外,突变也见于骨髓增殖性肿瘤(MPN)、慢性粒单核细胞白血病(CMML)和AML,表明该基因可能是髓系肿瘤高度相关的新型分子[5,15]。
本研究采用基因直接测序法检测国内初诊MDS患者TET2基因的突变率。结果显示,95例初诊MDS患者中TET2基因突变率为11.6%,包括错义突变、同义突变和无义突变,且突变多集中于3号外显子。TET2在MDS中是迄今为止发现最常见的突变基因,可能与细胞的恶性克隆有关[16]。该基因突变发生在MDS早期,可出现多次突变,其mRNA在所有粒系细胞中均低表达,表明该基因可抑制细胞增殖[9]。由于所有MDS患者均存在成熟粒细胞形态学的缺陷,TET2基因表达下降可能是由MDS中粒细胞异常分化引起的,这些现象提示该基因与髓系细胞分化有关。TET2基因的功能尚不清楚,但有文章指出其同源TET1基因能够将5-甲基胞嘧啶转化为5-羟甲基胞嘧啶,参与甲基化调控,TET2基因也具有相同的酶活性,其突变后可增强DNA甲基化,促进细胞恶性克隆增殖[5,16-17]。
目前,分子水平上TET2基因突变对MDS患者预后影响尚不明确[18]。本研究随访了60例初诊MDS病例,发现9例TET2基因突变,男性多于女性,至随访截止时间仅有1例存活且依赖成分输血。本组从性别、年龄、血液学(血红蛋白、白细胞及血小板)、骨髓原始细胞比例、外周血细胞减少种类及核型异常检出率上进行分析,两组间均无统计学差异,与国外文献报道的结论[19]相同。尽管本研究中TET2基因突变组与野生组在性别与年龄上无差异,但亦有文献[20]报道MDS患者预后与年龄、性别、是否依赖输血有关,年龄越大,预后越差,男性比女性患者预后差,依赖输血者的生存期短于不依赖输血者。此外,通过分析发现,伴有TET2基因突变患者的中位生存期仅有9个月,且生存率仅有11.1%,较未发生该基因突变者显著减低。本组TET2基因突变的MDS患者中位生存期与生存率均低于国外相关研究报道[5,9]。分析可能原因为:(1)MDS病例少,且随访困难;(2)MDS患者多为65~75岁老年人,其中部分需要依赖成分输血[20-21];(3)MDS病情复杂,衍变迅速,患者的医从性差。
综上所述,骨髓增生异常综合征是一组克隆性造血干细胞疾病,其发生与进展是一个极其复杂的多阶段过程,导致临床患者有很强的异质性。TET2基因突变是一种新型分子学异常,参与MDS异常甲基化和髓系细胞的异常分化,其突变对疾病预后评价有重要的临床指导意义,去甲基化药物对于MDS中TET2基因突变患者的治疗意义尚待明确。
[1]NIMER S D.Myelodysplastic syndromes[J].Blood,2008,111(10):4841-4851.
[2]宋慧慧,陈宝安,刘苒,等.地西他滨3d方案治疗骨髓增生异常综合征疗效讨论附两例病例报道[J].东南大学学报:医学版,2011,30(3):474-477.
[3]宋慧慧,陈宝安,刘苒,等.骨髓增生异常综合征进展为急性白血病行自体造血干细胞移植1例[J].东南大学学报:医学版,2010,29(6):608-610.
[4]高冲,陈宝安,刘苒,等.地西他滨治疗骨髓增生异常综合征1 例报告[J].现代医学,2010,38(2):189-190.
[5]DELHOMMEAU F,DUPONT S,DELLA VALLE V,et al.Mutation in TET2 in myeloid cancers[J].N Engl J Med,2009,360(22):2289-2301.
[6]TEFFERI A.Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms:JAK2,MPL,TET2,ASXL1,CBL,IDH and IKZF1[J].Leukemia,2010,24(6):1128-1138.
[7]MOHR F,DOHNER K,BUSKE C,et al.TET Genes:new players in DNA demethylation and important determinants for stemness[J].Exp Hematol,2011,39(3):272-281.
[8]ADEL-WAHAB O.Genetics of the myeloproliferative neoplasms[J].Curr Opin Hematol,2011,18(2):117-123.
[9]LANGEMEIJERS M,KUIPER R P,BEREN M,et al.Acquired mutations in TET2 are common in myelodysplastic syndromes[J].Nat Genet,2009,41(7):838-842.
[10]HAASE D,GERMING U,SCHANZ J,et al.New insights into the prognostic impact of the karyotype in MDS and correlation with subtypes:evidence from a core dataset of 2124[J].Blood,2007,110(13):4385-4395.
[11]BRUNNING R D,ORAZI A,GERMING U,et al.Myelodysplastic syndromes/neoplasms,overview//SWERDLOW S H,Campo E,HARRIS N L.WHO classification of tumours of hamatopoietic and lymphoid tissues[m].Lyon(France):IARC,2008:88.
[12]陈灏珠,林果为.实用内科学[M].13版.北京:人民卫生出版社,2009:2516-2521.
[13]KILAUS N,PSARAKI A,MASTRODEMOU S,et al.Evaluation of TET2 deletions in myeloid disorders:a fluorescence in situ hybridization analysis of 109 cases[J].leuk Res,2011,35(3):413-415.
[14]ROCQUAIN J,CARBUCCIA N,TROUPLIN V,et al.Combined mutations of ASXL1,CBL,FLT3,IDH1,IDH2,JAK2,KRAS,NPM1,NRAS,RUNX1,TET2 and WT1 genes in myelodysplastic syndromes and acute myeloid leukemias[J].BMC Cancer,2010,10:401.
[15]ABDEL-WAHAB O,MULLALLY A,HEDVAT C,et al.Genetic characterization of TET1,TET2,and TET3 alterations in myeloid malignancies[J].Blood,2009,114(1):144-147.
[16]HELLSTROM-LINDBERG E.Signicance of JAK2 and TET2 mutations in myelodysplastic syndromes[J].Blood Rev,2010,24(2):83-90.
[17]TAHILIANI M,KOH K P,SHEN Y,et al.Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1[J].Science,2009,324(5929):930-935.
[18]JANKOWSKA AM,SZPURKA H,TIU R V,et al.Loss of heterozygosity 4q24 and TET2 mutations associated with myelodysplastic/myeloproliferative neoplasms[J].Blood,2009,113(25):6403-6410.
[19]SMITH A E,MOHAMEDALI A M,KULASEKARARAJ A,et al.Next-generation sequencing of the TET2 gene in 355 MDS and CMML patients reveals low-abundance mutant clones with early origins,but indicates no definite prognostic value[J].Blood,2010,116(19):3923-3932.
[20]MALCOVATI L,PORTA M G,PASCUTTO D,et al.Prognostic factors and life expectancy in myelodysplastic syndromes classied according to WHO criteria:a basis for clinical decision making[J].J Clin oncol,2005,23(30):7594-7603.
[21]TEFFERI A,VARDIMAN J W.Myelodysplastic syndromes[J].N Engl J Med,2009,361(19):1872-1885.
