木犀草素抑制人肺腺癌A549细胞株的运动及其机制研究
2012-01-06张文静黄启来华子春
张文静,黄启来,华子春,2
(1.澳门科技大学中医药学院澳门药物与健康应用研究所中药质量研究国家重点实验室,澳门;2.南京大学 医药生物技术国家重点实验室,江苏南京 210093)
癌症细胞的浸润和转移是恶性肿瘤的显著特征。癌细胞脱离原发灶侵入周围组织随后在远处形成继发性肿瘤,是目前临床癌症治疗失败和患者死亡的主要原因[1]。30%的患者在诊断为肺癌时就已经有远处的转移,50% ~60%在治疗过程中发生远处转移,超过80%的肺癌患者死亡是由转移性疾病引起的[2]。从天然植物中寻找抑制肿瘤转移的有效成分已成为目前研究的热点[3]。木犀草素(luteolin;3',4',5,7-三羟基黄酮)是广泛存在于自然界中的天然黄酮类化合物。因其具有广泛的药理学活性,长期以来在民间被人们用来治疗多种疾病,如高血压、炎症和肿瘤[4]。目前越来越多的研究发现,木犀草素能有效抑制癌细胞的转移。在卵巢癌细胞中木犀草素能抑制ERK信号通路的活化,减少 MMP9的分泌,抑制肿瘤的侵袭[5]。木犀草素(50 μmol·L-1)可抑制人非小细胞肺癌细胞的转移,促进细胞的凋亡,但具体机制不清[6]。
本实验以人肺腺癌A549细胞株为研究对象,考察木犀草素作用于A549细胞后细胞运动能力的改变,最后对其相关机制进行探讨。
1 材料和方法
1. 1 药品和试剂
木犀草素购自美国Sigma公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)购自美国Amersco公司;胎牛血清(fetal bivine serum,FBS)、F-12K培养基、0.05%Trypsine-EDTA,链青霉素混合液(100×)购自美国 Gibco公司。实验前,木犀草素溶于DMSO,母 液 浓 度 为 50 mmol·L-1,DMSO 终 浓度<0.1%,对细胞生长无影响。
1. 2 实验材料
人肺腺癌细胞株A549购自美国模式培养物集存库(American type culture collection,ATCC)。细胞在10% 的胎牛血清、100 U·ml-1青霉素和 100 μg·ml-1的F-12K培养基,37℃、5%的CO2培养箱内培养。
1. 3 细胞活力检测
取对数生长期的 A549细胞,以3×104ml-1细胞密度每孔100 μl接种于96孔板内,37℃、5%的CO2培养箱培养过夜。次日,加入不同浓度的木犀草素(0、15、30、45、60 μmol·L-1,每个浓度设立 3 个平行孔),继续培养24 h。孵育结束后,每孔先用PBS洗涤除去血清及残存药物,随后加入100 μl含MTT(50 μg)无血清培养基 F-12K,继续于37℃、5%的CO2培养箱内孵育4 h。孵育结束后,小心吸弃上清液,加入 100 μl的 DMSO,在水平振荡器上振荡10 min,充分溶解甲臢。酶标仪测570 nm,参考波长630 nm处吸光度值,用下列公式计算药物对细胞的抑制率:
抑制率%=(1-处理组吸光度值)/对照组吸光度值×100%
1. 4 伤口愈合实验
取对数生长期的A549细胞,以1×105ml-1细胞密度接种于12孔板内,37℃、5%的CO2培养箱内培养。待细胞密度达到90%,撤去含血清培养基,改用无血清的F-12K饥饿细胞12 h。采用200 μl移液枪头在培养孔中央处造成损伤,形成宽度均一的伤口,随后用PBS洗去脱落的细胞。给予15 μmol·L-1木犀草素,同时设立不含药物对照组,分别于损伤后0、24、48 h于倒置显微镜(IX71,Olympus,日本)10倍下进行拍照记录细胞向损伤区域的运动情况。
1. 5 Western blotting检测蛋白表达
取对数生长期的A549细胞,接种于6孔板内,待细胞贴壁后,给予不同浓度木犀草素的培养液,处理细胞24 h。药物孵育结束后,用预冷的PBS洗涤细胞2次,每孔加入200 μl细胞裂解液,用细胞刮刮下细胞后,收集于1.5 ml的Eppendorf管内,冰上静置30 min。后采用12 000×g 4℃离心30 min。转移上清液至新的Eppendorf管内。取少许用于Bradford法测定蛋白质含量。加入4×上样缓冲液于蛋白溶液内,100℃金属浴加热10 min使蛋白变性。采用8%的SDS-PAGE电泳分离蛋白随后转移至硝酸纤维素膜。5%的脱脂牛奶封闭 2 h,兔抗 p-FAK(focal adhesion kinase,FAK)、兔抗FAK、鼠抗GAPDH分别与膜进行孵育,4℃过夜。PBST缓冲液洗涤膜3次,每次10 min。采用IRDye 800CW anti-mouse与anti-rabbit secondary IgG二抗室温避光孵育1 h。孵育结束后,继续于避光条件下,用PBST洗涤膜3次,每次10 min。Odyssey Infrared Imaging System(LI-COR Biosciences,Lincoln,NE,USA),分辨率为 84 μm,800 nm 远红外通道进行蛋白信号的检测。信号强度运用Odyssey system application软件(version 2.1)进行分析。
1. 6 统计学处理
各实验均重复3次,数据采用Graphpad prism 5.0软件进行单因素方差分析,后采用Dunnett multiple comparison检验对不同药物浓度处理组与对照组进行比较,P<0.05为差异具有统计学意义。
2 结 果
2. 1 木犀草素对A549细胞增殖的抑制作用
采用MTT法考察木犀草素对A549细胞增殖的抑制作用,木犀草素剂量依赖性地抑制A549细胞的增殖,IC50为 54.4 μmol·L-1(图1)。与对照组相比,木犀草素在15、30、45 和60 μmol·L-1剂量下对细胞的抑制率分别为(10.62±6.7)%、(36.28±4.22)%、(46.39±3.86)%和(48.04±2.16)%,差异有统计学意义(P<0.05)。
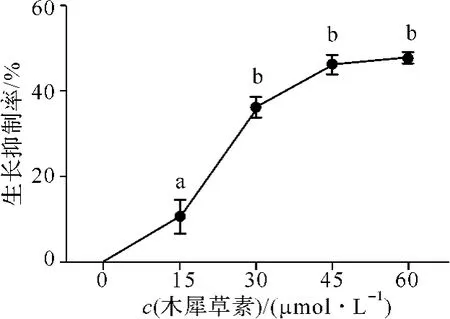
图1 木犀草素对细胞活力的影响A549 cells were treated with different concentration of luteolin for 24 h. The cell viability was evaluated by MTT assay. The experiment was carried out three times,each experiment was done in triplicate,a P <0.05,b P <0.001Fig 1 The effect of luteolin on cell viability in A549 cells
2. 2 木犀草素抑制A549细胞的运动
伤口愈合实验显示,15 μmol·L-1的木犀草素作用于A549细胞24 h后,其损伤区域宽度大于空白对照组。如图2,木犀草素 15 μmol·L-1即能抑制 A549 细胞向损伤区域的运动。
2. 3 木犀草素抑制FAK磷酸化
蛋白水平检测发现,与对照组相比,木犀草素15、30、45 和 60 μmol·L-1作用于 A549 细胞 24 h 后,FAK酪氨酸Tyr397磷酸化水平下降。此外,木犀草素剂量依赖性减少FAK总蛋白的水平,见图3。
3 讨 论
肿瘤的转移是恶性肿瘤的重要生物学特征之一。FAK是一种非受体型酪氨酸蛋白激酶,作为细胞内的骨架蛋白参与了多种信号的传递。FAK的高表达与肿瘤的恶性程度紧密相关[7-8]。在非小细胞肺癌中,FAK及其397位酪氨酸的磷酸化升高预示着肿瘤有较高的侵袭性和不良预后[9]。Huang等[10]用木犀草素、槲皮素以及FAK-siRNA干扰的手段处理胰腺癌细胞株,发现木犀草素能抑制FAK的表达和活性,并且能抑制胰腺癌细胞的侵袭能力。在肺癌细胞A549的研究中也发现,木犀草素(50 μmol·L-1)具有抑制A549细胞体外运动的能力,改变细胞骨架,诱导细胞的凋亡,但具体机制不清[6]。故本研究首先考察木犀草素对A549细胞的细胞活力的影响,随后观察木犀草素对细胞运动的影响并进一步揭示了其相关的机制。

图2 伤口愈合实验考察木犀草素作用A549细胞24 h和48 h后对细胞运动的影响(白色区域代表损伤区域的宽度)Fig 2 The effect of luteolin in A549 cells at 24 h and 48 h by wound healing assay(The white lines represent the distance of wound healing area)
我们发现,木犀草素(15 μmol·L-1)在对细胞生长抑制仅为(10.62±6.7)%的条件下,却能显著抑制人肺腺癌A549细胞株的运动,且呈时间依赖性。文献报道,木犀草素在 A549细胞中 IC50为(32.6±2.6)μmol·L-1,高于 IC50浓度的木犀草素 50 μmol·L-1抑制肺癌细胞迁移,且该浓度诱导细胞凋亡的发生。目前,临床抗肿瘤药物和筛选得到的活性化合物中,抗肿瘤活性的发挥主要通过细胞毒作用,一定程度上对机体的正常细胞也产生毒副作用。因此,探索对正常细胞生物学影响较小,而对肿瘤细胞恶性生物学行为有抑制作用的治疗靶点和治疗窗口,对肿瘤的治疗具有重要意义。我们认为,细胞运动能力的减弱在前文提及的研究中很难与药物所选浓度的细胞毒作用分开,无法反映药物真实的抗肿瘤转移药效。在我们的研究中,采用低于IC50的药物浓度作用于A549细胞,发现能显著抑制细胞的运动能力。进一步蛋白水平检测发现,木犀草素抑制FAK磷酸化水平;同时,降低FAK总蛋白的表达水平。
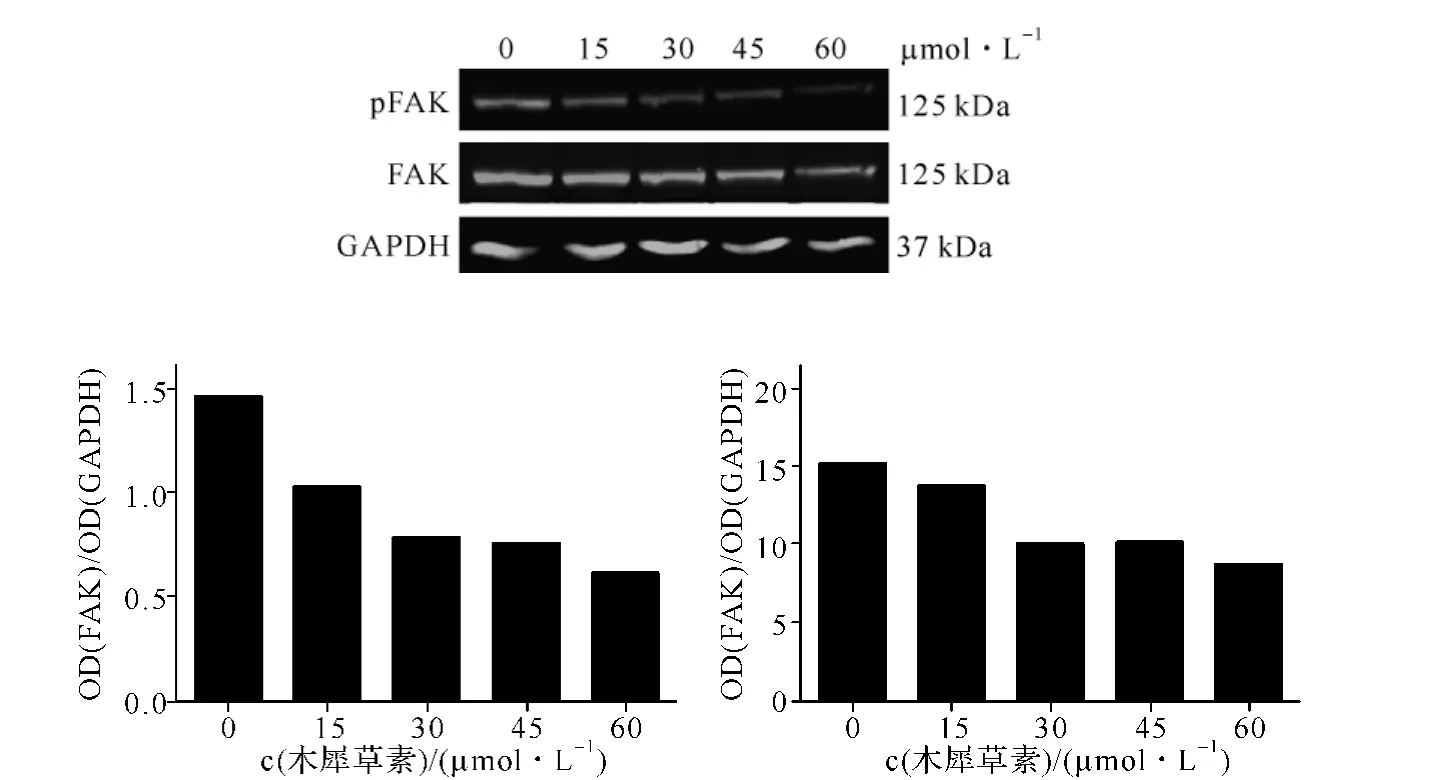
图3 Western blotting检测不同浓度木犀草素对FAK及磷酸化FAK的影响Fig 3 Western blotting demonstrated the protein level of total FAK and phosphorylation of FAK
肿瘤的转移是多步骤、许多信号分子参与并发生相互作用的过程。我们的研究揭示了木犀草素抗A549细胞迁移的分子生物学基础与FAK紧密相关。新近文献报道木犀草素抑制肿瘤细胞的转移与增加E-cadherin表达有关,后者的增加使细胞间黏附能力增强,侵袭能力减弱[11];肝细胞生长因子受体参与细胞的迁移,木犀草素也能抑制该信号通路的活化从而发挥抗HepG2细胞侵袭的能力[12];此外,木犀草素可抑制NF-κB信号通路,从而阻断其下游调控细胞侵袭性行为的关键分子Twist和MMPs的表达[13]。综上,木犀草素抑制肿瘤细胞的转移可能是多种信号通路参与的共同结果。肺癌是严重威胁人类生命健康的恶性肿瘤,高居我国恶性肿瘤致死的首位[14]。我们的结果为肺癌的抗转移研究提供了新的靶点。
[1]张凤,樊红.MTSS1-候选的肿瘤转移抑制基因?[J].东南大学学报:医学版,2009,28(3):239-243.
[2]SCHROEDER A,HELLER D A,WINSLOW M M,et al.Treating metastatic cancer with nanotechnology[J].Nat Rev Cancer,2012,12(1):39-50.
[3] PFISTERER P H,WOLBER G,EFFERTH T,et al.Natural products in structure-assisted design of molecular cancer therapeutics[J].Curr Pharm Des,2010,16(15):1718-1741.
[4]LIN Y,SHI R,WANG X,et al.Luteolin,a flavonoid with potential for cancer prevention and therapy[J].Curr Cancer Drug Targets,2008,8(7):634-646.
[5]肖大凯,覃燕梅,莫丽儿,等.木犀草素对卵巢癌细胞株转移能力的影响[J].中国病理生理杂志,2006,22(6):1199-1202.
[6]ZHAO Y,YANG G,REN D,et al.Luteolin suppresses growth and migration of human lung cancer cells[J].Mol Biol Rep,2011,38(2):1115-1119.
[7]GOLUBOVSKAYA V M.Focal adhesion kinase as a cancer therapy target[J].Anticancer Agents Med Chem,2010,10(10):735-741.
[8]LI S,HUA Z C.FAK expression regulation and therapeutic potential[J].Adv Cancer Res,2008,101:45-61.
[9]聂蓉,朱润庆,柯尊富,等.非小细胞肺癌组织中FAK和pY397FAK 的表达[J].肿瘤防治杂志,2005,12(1):10-13.
[10]HUANG Y T,LEE L T,LEE P P,et al.Targeting of focal adhesion kinase by flavonoids and small-interfering RNAsreduces tumor cell migration ability[J].Anticancer Res,2005,25(3B):2017-2025.
[11]ZHOU Q,YAN B,HU X,et al.Luteolin inhibits invasion of prostate cancer PC3 cells through E-cadherin[J].Mol Cancer Ther,2009,8(6):1684-1691.
[12]LEE W J,WU LF,CHEN W K,et al.Inhibitory effect of luteolin on hepatocyte growth factor/scatter factor-induced HepG2 cell invasion involving both MAPK/ERKs and PI3K-Akt pathways[J].Chem Biol Interact,2006,160(2):123-133.
[13] LIN C W,SHEN S C,CHIEN C C,et al.12-O-tetradecanoylphorbol-13-acetate-induced invasion/migration of glioblastomacells through activating PKCalpha/ERK/NF-kappaB-dependent MMP-9 expression[J].J Cell Physiol,2010,225(2):472-481.
[14]张欣贺,施雪峰,王志铭,等.CT检查联合VEGF-C表达检测在非小细胞肺癌淋巴结转移诊断中的价值[J].东南大学学报:医学版,2011,30(3):460-463.
