TDG变体的构建、表达、纯化及其DNA修复功能研究
2012-01-06林小伟华子春
林小伟,华子春
(南京大学医药生物技术国家重点实验室,江苏南京 210093)
DNA存储着生命体赖以生存和繁衍的遗传信息, 维持DNA的完整性对于生命体来说至关重要[1]。然而,外界环境和生命体内在因素经常会造成DNA的损伤或改变,例如水解作用和化学因素等,尤其水解反应发生的概率很高,包括碱基(如C、5-meC、A和G)的脱氨基作用。C和5-meC脱氨基分别生成U和T,从而与G配对形成G:U和G:T错配。除非错配被修复,否则将增加G:C向T:A的突变转移从而导致DNA变异[2-5]。因此,DNA错配是一种常见的DNA变异形式,DNA的这种变异主要是通过碱基切除修复(BER)系统来修复的,而其中DNA糖苷酶就是用来修复DNA错配的蛋白家族之一[6]。
胸腺嘧啶糖苷酶(TDG)是尿嘧啶糖苷酶(UDG)超家族的重要一员,它既具有修复5-甲基胞嘧啶自发水解脱氨基产生的G:T错配的能力,也具有像其他尿嘧啶糖苷酶家族一样具有修复G:U错配的能力[7-8]。此外,有不少研究发现TDG不仅仅具有DNA错配修复功能,还与基因表达调控、CPG岛甲基化调控、胚胎发育以及肿瘤的发生与治疗等都有密切关系。此前就有不少文献报道,TDG能通过多种方式抑制肿瘤的发生。其中,TDG作为UDG家族的一员就介导了5-FU、FdUrd等化疗药物治疗肿瘤的代谢过程[9]。此外,也有文献报道TDG的G:T错配修复功能也可能与化疗相关[10-11]。本实验室近年来围绕TDG的结构与功能关系开展了系列研究[12-14],而本研究主要着眼于TDG修复G:U错配的结构与功能关系研究,以期为以后的生物学功能研究奠定基础。
1 材料与方法
1. 1 实验材料与试剂
原核表达载体pET28a(+)购自Novagen公司,大肠杆菌E coli克隆菌株Top10及表达菌株BL21(DE3)由本实验室保存。PCR试剂、限制性内切酶XhoⅠ和NdeⅠ、Taq DNA Polymerase、T4DNA Ligase、Pyrobest DNA聚合酶均购自TaKaRa公司。柱离心式质粒小提试剂盒和柱离心式胶回收小提试剂盒购自上海申能博彩公司。
1. 2 实验方法
1.2.1 PCR扩增mTDG的C-端截短基因片段mTDG
(1-279) 以载体pCI-HA-TDG为模板,用高保真酶
Pyrobest DNA聚合酶PCR扩增只含有编码1-279位氨基酸残基的基因片段,即mTDG(1-279)(图1)。所用的上下游引物分别为:
在上游引物中有NdeⅠ酶切位点(斜黑体下划线),下游引物中有XhoⅠ的酶切位点(斜黑体下划线)。PCR反应条件为:94℃热变性30 s,60℃退火30 s,72℃延伸1 min,共进行26个循环。对PCR产物行DNA琼脂糖凝胶电泳分离,切胶回收。

图1 mTDG蛋白及mTDG(1-279)蛋白的结构Fig 1 Schematic overview of the domain structure of mTDG and mTDG(1-279)
1.2.2 构建重组质粒pET28a-mTDG(1-279) 将回收得到的基因片段mTDG(1-279)经NdeⅠ和XhoⅠ双酶切3 h后,并经琼脂糖凝胶电泳分离且回收后插入到同样经NdeⅠ和XhoⅠ双酶切回收的pET28a(+)载体中。用T4DNA Ligase连接,16℃过夜反应,连接产物转化Top10感受态细胞,热击、活化,涂布于含有Kan+抗生素的LB平板上,37℃倒置培养12 h。挑取单菌落进行菌落PCR筛选阳性克隆,并经NdeⅠ和XhoⅠ双酶切鉴定以及DNA测序,分析其阅读框和编码序列的正确性。
1.2.3 His-mTDG(1-279)蛋白的表达与纯化 构建好的重组质粒pET28a-mTDG(1-279)转化表达菌株BL21(DE3),挑取单克隆到含 60 μg·ml-1卡那霉素的3 ml LB液体培养基过夜活化培养,然后按1∶100的比例转接入 300 ml含60 μg·ml-1卡那霉素的 LB 液体培养基中,先37℃培养3 h左右至菌液浓度OD600nm=0.7~0.9时,再将培养瓶冷却至20℃,然后加入IPTG到终浓度为0.2 mmol·L-1诱导表达,16 h后收集菌体,超声裂解 20 min(脉冲 3 s,间隔 3 s),12 000 r·min-1离心 10 min。将收集的上清以 0.5 ml·min-1的速率加载到已经用Tris-HCl缓冲液预平衡过的Ni+亲和柱上,上完样后用Tris-HCl缓冲液充分洗涤至基线,再用含有50 mmol·L-1咪唑的缓冲液洗涤杂蛋白,最后用含250 mmol·L-1咪唑的缓冲液洗脱目的蛋白。再将通过 Ni+亲和柱纯化的洗脱蛋白立即使用Sephadex G15凝胶柱层析去除咪唑。纯化后的蛋白加入10%的甘油后,保存在-80℃备用。
1.2.4 mTDG(1-279)蛋白对G/U错配修复的体外活性分析 mTDG(1-279)蛋白的活性分析参照文献[12]进行,首先在U-44(5'-AATTGGGCTCCTCGAGGAATTU GCCTTCTGCAGGCATGCCCCGG-3')的5'端带上 ROX荧光标记(由Invitrogen公司合成),然后与G-44(5'-C CGGGGCATGCCTGCAGAAGGCGAATTCCTCGAGGAGC CCAATT-3')配对退火形成含有U:G错配的异源双链,即用于测活的底物。测活反应体系为:50 mmol·L-1Tris-HCl(pH 8.0),1 mmol·L-1DTT,50 μg·ml-1BSA,1 mmol·L-1EDTA,3%甘油,含有 U:G 错配的双链底物0.3 mmol·L-1和适量的 mTDG(1-279)蛋白,10 μl反应体系。先在37℃水浴反应30 min,再加入1.1 μl 1 mol·L-1NaOH,90 ℃反应 30 min 后,迅速置冰上5 min,短暂离心后,加入5 μl测活loading(90%formamide,10 mmol·L-1EDTA,0.1%xylene cyanol,0.1%bromophenol blue)。最后取10 μl混合物上样,在14%聚丙烯酰胺测序胶进行电泳分离,电泳完毕后用Typhoon 9410 workstation(Amersham公司)进行扫描与分析。
2 结 果
2. 1PCR 扩增mTDG(1-279)基因片段
按标准反应体系及以上条件PCR扩增得到mTDG(1-279)基因片段,PCR产物用DNA琼脂糖凝胶电泳进行分离,结果显示大小正确(837 bp,图2),之后切胶并回收。
图2 mTDG(1-279)的PCR扩增产物Fig 2 The PCR product of gene encoding mTDG(1-279)
2. 2 重组质粒pET28a-mTDG(1-279)的构建
mTDG(1-279)片段经PCR扩增、酶切,然后与酶切过的pET28a(+)表达载体连接,转化Top10感受态细胞,挑取克隆经菌落PCR鉴定、双酶切鉴定(图3),最后通过DNA测序分析证明mTDG(1-279)片段已成功插入载体中,其阅读框序列保持一致。
2. 3His-mTDG(1-279)的表达及纯化
[14]中TDG表达纯化的条件,我们确定了表达His-mTDG(1-279)条件,就是在低温20℃和低IPTG浓度0.2 mmol·L-1时,能够很好地表达且大部分在可溶上清里。我们通过Ni+柱亲和纯化及使用Sephadex G15凝胶柱层析去除咪唑后,用12%SDSPAGE胶电泳检测蛋白表达情况(图4),可知获得了比较单一条带的His-mTDG(1-279)融合蛋白。此外,用Bradford法测纯化得到的蛋白浓度,可以有37 mg·L-1的得率,可用于体外测活。
图3 重组质粒pET28a-mTDG(1-279)的酶切鉴定分析Fig 3 Identification of pET28a-mTDG(1-279)by restriction endonuclease digestion
图4 mTDG(1-279)蛋白表达纯化的SDS-PAGE分析Fig 4 SDS-PAGE analysis of the expression and purification of mTDG(1-279)protein
2. 4 G:U错配修复的体外活性分析
参考经典的TDG体外测活实验以及经我们改进过的测活方法,将纯化的mTDG(1-279)蛋白与含有G:U错配的异源双链混合反应,并进行分析,结果显示mTDG(1-279)蛋白能使异源双链断裂产生产物,即表明mTDG(1-279)蛋白具有良好的U:G错配修复活性(图5)。
3 讨 论
胸腺嘧啶糖苷酶是一个重要的DNA糖苷酶,它主要修复5-甲基胞嘧啶自发水解脱氨基产生的G:T错配,但同时它又具有修复G:U错配的能力。从以前的研究得知,它的错配修复功能与肿瘤治疗有密切关系。近年来,国际上对TDG其他功能的研究也取得了长足的发展。例如TDG缺陷型或TDG失活的胚胎无法发育成功会坏死,表明TDG在维持表观遗传稳定方面起着重要的作用[15-16]。近年来,本研究室围绕TDG的结构与功能关系展开了深入研究。在之前的研究中,我们已经就TDG抗体的制备、活性测定的改进、G:T错配的体外、体内测活及其功能等方面展开了深入的研究。
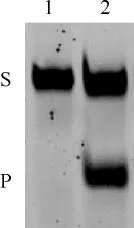
图5 mTDG(1-279)蛋白修复G:U错配的活性分析Fig 5 The activity assay of mTDG(1-279)protein
mTDG由421个氨基酸残基组成,此前文献报道其维持G:T错配修复的活性结构域为67-374位氨基酸,维持G:U错配修复的活性结构域为123-374位氨基酸[7,17-19](如图1 所示),但是这只是粗略地界定而没有被具体精确地界定。在本研究中,我们通过构建mTDG的C-端截短变体mTDG(1-279),经表达、纯化,获得了mTDG(1-279)变体蛋白,并进行了G:U错配修复活性分析。实验结果表明mTDG(1-279)仍然具有良好的G:U错配修复活性。因此,我们发现其维持G:U错配修复的活性结构域应该在1-279位氨基酸的更小范围,此外我们可以借助该方法精确地定位出TDG修复G:U错配的活性结构域,为后期的生物学功能研究打好基础。
[参考文献]
[1]LINDAHL T.Instability and decay of the primary structure of DNA[J].Nature,1993,362:709-715.
[2]CORTAZAR D,KUNZ C,SAITO Y,et al.The enigmatic thymine DNA glycosylase[J].DNA Repair,2007,6:489-504.
[3] BROWN T C,JIRICNY J.Different base/base mispairs are corrected with different efficiencies and specificities in monkey kidney cells[J].Cell,1988,54:705-711.
[4]WIEBAUER K,JIRICNY J.In vitro correction of G/T mispairs to G/C pairs in nuclear extracts from human cells[J].Nature,1989,339:234-236.
[5]NEDDERMANN P,JIRICNY J.Efficient removal of uracil from G:U mispairs by the mismatch-specific thymine DNA glycosylase from HeLa cells[J].Proc Natl Acad Sci USA,1994,91:1642-1646.
[6]HANS E,KROKA N,RUNE S,et al.DNA glycosylases in the base excision repair of DNA[J].Biochem J,1997,325:1-16.
[7]GALLINARI P,JIRICNY J.A new class of uracil-DNA glycosylases related to human thymine-DNA glycosylase[J].Nature,1996,383:735-738.
[8]GUAN X,MADABUSHI A,CHANG D Y,et al.The human checkpoint sensor Rad9-Rad1-Hus1 interacts with and stimulates DNA repair enzyme TDG glycosylase[J].Nucl Acids Res,2007,35:6207-6218.
[9]PETTERSEN H S,VISNES K,KROKAN H E,et al.UNG-initiated base excision repair is the major repair route for 5-fluorouracil in DNA,but 5-fluorouracil cytotoxicity depends mainly on RNA incorporation[J].Nucl Acids Res,2011,39:8430-8444.
[10]SIBGHAT U,GALLINARI P,JIRICNY J,et al.R.Day III,Base analog and neighboring base effects on substrate specificity of recombinant human G:T mismatch-specific thymine DNA-glycosylase[J].Biochem,1996,35:12926-12932.
[11]LARI S U,KHODAIRY F A,PATERSON M C,Substrate specificity and sequence preference of G:T mismatch repair:incision at G:T,O6-methylguanine:T,and G:U mispairs in DNA by human cell extracts[J].Biochem,2002,41:9248-9255.
[12]LI S Y,ZHANG X Y,HUA Z C.A convenient fluorescent-labeled assay for in vitro measurement of DNA mismatch repair activity[J].Biomed Environ Sci,2010,23:496-501.
[13]LI S Y,HUANG Q L,HUA Z C.A convenient spectrometric assay system for intracellular quantitative measurement of DNA glycosylase activity[J].Acta Biochim Biophys Sin,2010,42:381-387.
[14]李石营,兰燕,华子春.TDG蛋白的表达纯化及多克隆抗体的制备[J].东南大学学报:医学版,2010,29:485-489.
[15]CORTELLINO S,XU J F,SANNAI M,et al.Thymine DNA glycosylase is essential for active DNA demethylation by linked deamination-base excision repair[J].Cell,2011,146:67-79.
[16]CORTAZAR D,KUNZ C,SELFRIDGE J,et al.Embryonic lethal phenotype reveals a function of TDG in maintaining epigenetic stability[J].Nature,2011,470:419-423.
[17]NOCCA C S,WIERUSZESKI J M,CHAAR V,et al.The thymine-DNA glycosylase regulatory domain:residual structure and DNA binding[J].Biochem,2008,47:6519-6530.
[18]LUCEY M J,CHEN D,LOPEZ G J,et al.T:G mismatch-specific thymine-DNA glycosylase(TDG)as a coregulator of transcription interacts with SRC1 family members through a novel tyrosine repeat motif[J].Nucl Acids Res,2005,33:6393-6404.
[19]UM S,HARBERS M,BENECKE A,et al.Retinoic acid receptors interact physically and functionally with the T:G mismatch-specific thymine-DNA glycosylase[J].J Biol Chem,1998,273:20728-20736.
