胃肠道间质瘤免疫组织化学特征
2012-01-06马庆锋长春市朝阳区人民医院外科吉林长春130021
马庆锋 (长春市朝阳区人民医院外科,吉林 长春 130021)
胃肠道间质瘤(GISTs)是消化系统最常见的间叶性肿瘤,在所有消化系统肿瘤中约占2%,美国每年新增病例4 500~6 000例〔1〕。在GISTs诊断上,病理学诊断仍然是金标准。免疫组化染色在病理学诊断中具有重要应用。在免疫组织化学研究上,文献中报道最多的研究是CD117和CD34,近些年对血小板源性生长因子受体(PDGFRA)的研究进一步深入。上述研究多数针对GISTs靶向药物以及肿瘤发生机制,而应用免疫组化染色进行病理学诊断的研究常常针对个别抗体。在我国,GISTs的多抗体联合研究报道很少,本文GISTs进行CD117,血小板衍生生长因子受体A(PDGFRA),CD34,DOG-1,肌源性标记结蛋白(Desmin)和S-100免疫组化染色进行全面研究,进一步分析我国GISTs分子病理学特点,为常规病理学诊断GISTs提供重要理论依据。
1 材料与方法
1.1 材料 收集来自吉林大学第一医院和陕西省肿瘤医院病理科2009年3月至2011年6月GISTs存档标本共74例。所有肿瘤标本均经4%中性甲醛固定,常规切片苏木素-伊红(HE)染色。免疫组化染色标记采用EvVision法,一抗CD117,PDGFRA,CD34,DOG-1,Desmin 和 S-100 等购自中杉金桥生物技术公司,二氨基联苯胺(DAB)显色,采用磷酸盐缓冲液(PBS),防脱片处理,采用微波修复抗原。
74例GISTs患者平均年龄(61.77±15.07)岁;<30岁,30~40岁,41~50岁,51~60岁,61~70岁,71~80岁以及 >80岁组别所占百分比分别为5.4%,5.4%,8.1%,21.7%,18.9%,33.8%和6.8%,各年龄组所占百分比存在显著差异(P<0.05)。其中35例(47.3%)为男性,39例(52.7%)为女性。69例(93.2%)为肿瘤单发,5例(6.8%)为多发肿瘤。肿瘤累及部位:食管6例(8.1%),胃35例(47.2%),小肠23例(31.1%),结直肠3例(4.1%),肠系膜3例(4.1%),网膜1例(1.3%),腹膜后3例(4.1%),统计学分析有显著差异(P<0.05)。在单发性肿瘤中最大直径<2 cm,2~5 cm,5~10 cm以及>10 cm所占比例分别为10.1%(7/69),50.7%(35/69),29.0%(20/69)和10.1%(7/69),其中2~5 cm肿瘤所占比例显著高于其他组别(P<0.05)。
1.2 病理学诊断 由2位病理科医师复习切片,诊断标准依据世界卫生组织(WHO)消化系统肿瘤病理学和遗传学分类〔2〕,74例GISTs按照不同性别、年龄、部位、肿瘤大小、核分裂象以及肿瘤危险程度进行分组。核分裂象计数选取肿瘤细胞最为丰富的50个高倍视野。根据肿瘤大小及核分裂象计数进行肿瘤危险程度分类:即肿瘤直径<2 cm和核分裂象<5/50 HPF为极低度侵袭危险性;肿瘤直径2~5 cm和核分裂象<5/50 HPF为低度侵袭危险性;肿瘤直径5~10 cm和核分裂象<5/50 HPF或肿瘤直径<5 cm和核分裂象6~10/50 HPF为中度侵袭危险性;肿瘤直径>5 cm和核分裂象>5/50 HPF或肿瘤直径>10 cm或核分裂象 >10/50 HPF为高度侵袭危险性。
1.3 免疫组化染色分析 使用抗体包括CD117,PDGFRA,CD34,DOG-1,Desmin和 S-100。CD117,CD34,S-100 等阳性表达以肥大细胞、血管内皮细胞及神经为内对照。低于5%的肿
1.4 统计学方法 用SPSS17.0统计软件进行分析,实验数据以±s表示,各组间差异采用t检验,样本率的比较采用Fisher精确概率法。
2结果
74例GISTs患者核分裂象计数(7.55±9.61)/50 HPF(范围1~60/50 HPF)。按照<5/50 HPF,(5~10)/50 HPF以及>10/50 HPF分成三组,所占百分比分别为62.2%(46/74)、14.9%(11/74)和23.0%(17/74),<5/50 HPF组别所占百分比显著高于其他两组(P<0.05)。按肿瘤危险程度极低度、低度、中度和高度分类,所占比例分别为14.9%(11/74)、31.1%(23/74)、20.3%(15/74)和 33.8%(25/74),各组别间有显著差异(P<0.05)。4例伴发其他类型恶性肿瘤,1例出现淋巴结转移,1例出现骨转移。
2.1 不同抗体表达阳性率 在74例GISTs中CD117、PDGFRA、CD34、DOG-1、S100以及 Desmin阳性表达率分别为97.3%(72/74),55.4%(41/74),89.2%(66/74),85.1%(63/74),5.4%(4/74),12.2%(9/74)统计学差异显著 (P <0.05)。在阳性表达病例中3+、2+以及1+所占比例CD117为25.0%(18/72)、23.6(17/72)和 51.4(37/72);PDGFRA 为4.9%(2/41)、4.9%(2/41)和 90.2%(37/42);CD34 为 9.1%(6/66),22.7%(15/66),68.2%(45/66);DOG1 为 17.5%(11/63),22.2%(14/63)和60.3%(38/63);Desmin 为 0%(0/4),25%(1/4)和 75%(3/4);S100 为 0%(0/9),0%(0/9)和100%(9/9);上述存在显著差异(P<0.05)。
2.2 不同组别GISTs各抗体表达阳性率比较 在性别和年龄分组中各个抗体表达没有显著差异。不同部位肿瘤分组中,CD117在胃、小肠以及结肠阳性表达率均为100%,在食管和胃肠道外阳性表达率为83.3%和85.7%;在胃S-100阳性率为17.1%,其阳性率显著高于其他部位;Desmin在小肠阳性表达率最高(13%),明显高于其他部位;上述组间比较具有统计学意义(P<0.05)。在单发性肿瘤和多发性肿瘤之间抗体阳性率没有显著差异。肿瘤大小分组中,单发性肿瘤直径<2 cm,2~5 cm,5~10 cm 以及 >10 cm 四组中,CD117、PDGFRA、CD34、DOG-1具有显著差异(P<0.05)。在核分裂象分组中,核分裂象<5/50HPF,(5~10)/50 HPF以及 >10/50 HPF三组中CD117、S100表达阳性率具有显著差异(P<0.05)。在肿瘤危险程度分组中,极低度、低度、中度以及高度风险肿瘤中DOG-1、S100阳性率具有显著差异(P<0.05)。见表1。
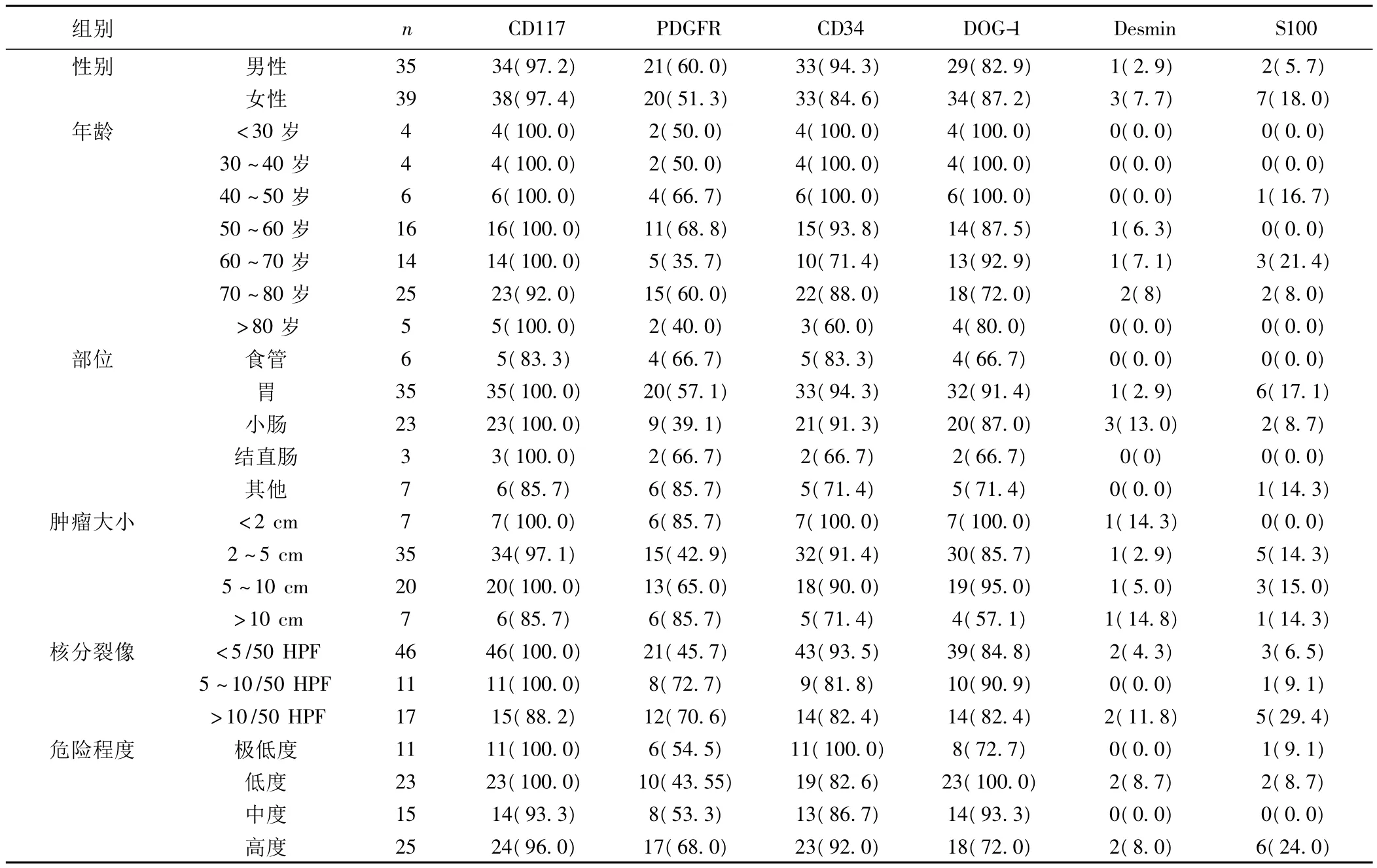
表1 不同组别GISTs中不同抗体阳性表达情况〔n(%)〕
3讨论
Desmin是一种肌源性标记物。在GISTs中Desmin阳性率为4%〔4〕。本研究中Desmin在GISTs中总体阳性率为12.2%,其阳性率略高于文献报告。发生在小肠GISTs的阳性率最高。Desmin阳性也见于肌源性肿瘤,如平滑肌瘤和平滑肌肉瘤等。除了组织学特征之外,平滑肌肿瘤具有的特征性免疫表型是desmin、SMA以及caldesmon阳性,而CD117和CD34阴性。
S100蛋白是一种神经分化的标记物,在GISTs中阳性率为5.7% ~33%〔4,5〕,尤其是位于小肠的肿瘤其阳性率较其他部位高。本研究结果与文献报告不同,发生在胃的GISTs S100蛋白表达阳性率高于其他部位,这一结果还有待于大宗病例进一步证实。S100蛋白表达在胃、高度风险以及>10/50 HPF GISTs中S100表达率高于其他组别肿瘤。在胃肠道S100阳性应与神经鞘瘤鉴别。实际上胃肠道神经鞘瘤非常少见,S100细胞核和细胞质强阳性以及CD117阴性有助于神经鞘瘤与GISTs进行鉴别。
随后研究发现CD34在间质瘤诊断中有一定应用,其敏感性虽然较CD117低,但其阳性率可达60% ~70%〔5〕,在食管和直肠部位GISTs阳性率可高达90%〔6〕,在小肠阳性表达率较低。本研究阳性率明显偏低,与文献报告不符合。另外本研究提示,CD34阳性表达率随年龄增加而呈现下降趋势。除此之外,一些平滑肌源性和神经鞘分化的肿瘤也可以表现为CD34阳性。其他良性病变如炎性纤维性息肉多数CD34阳性,而CD117阴性。
随着研究的深入,学者们在超微结构或免疫组织化学水平上认识到 GISTs向 Cajal间质细胞分化,尤其是 c-kit蛋白(CD117)的发现,学者们不再对GIST是平滑肌源性还是神经源性进行争论。CD117为c-kit原癌基因的蛋白产物,是干细胞因子的跨膜受体,具有内在的酪氨酸激酶成分,表达于造血干细胞亚群、肥大细胞、黑色素细胞及胃肠道起搏细胞等。在日常病理学诊断中,CD117是GISTs最有实际应用价值的抗体。几乎所有不同部位的良、恶性GIST均可阳性表达CD117,目前大部分报道CD117的阳性率在80% ~100%之间,表达部位为细胞质、细胞膜及细胞核旁,呈弥漫强阳性表达〔1〕。本研究CD117在GISTs中总体阳性表达率为97.3%,与文献报告〔4〕接近。尽管这种染色方式对治疗和预后的意义还不清楚,它可能是假阳性的结果,尤其是在活检小标本中。即使拥有完美的免疫组化技术,仍让有5%的GISTs患者CD117阴性,文献报告多数是发生在胃和网膜的病例〔7〕。在本研究中1例食管和1例网膜GIST呈阴性反应,与文献报告有不同之处,而发生在胃的肿瘤该抗体表达全部为阳性。CD117是一种敏感性和特异性较高的抗体,但是不意味只有在GISTs中呈阳性表达。其他肿瘤如精原细胞瘤、恶性黑色素瘤、滤泡性甲状腺癌、肺细胞癌、嗜酸性腺瘤、嫌色细胞癌、胸腺癌和胸腺瘤、血管肉瘤、慢性髓性白血病、肥大细胞肿瘤、生殖细胞肿瘤等也呈阳性反应。CD117阴性的肿瘤诊断有一定困难,单独CD117免疫组化染色不足以诊断GISTs,因此,必要的抗体组合在日常病理学诊断中是必要的。
研究证明在基因水平上,GISTs是一组异源性肿瘤,这组肿瘤中有些表现c-kit突变,而其他肿瘤含有野生型c-kit基因。后一组肿瘤PDGFRA突变,对激酶的功能产生影响,导致肿瘤的发生。PDGFRA和CD117同属于Ⅲ型受体酪氨酸激酶家族。c-kit突变肿瘤对伊马替尼治疗反应敏感,而PDGFRA突变肿瘤对该治疗呈抵抗反应。2003年Heinrich等〔8〕首先报道在40例GIST中有14例(35%)存在PDGFRA突变。在本研究中PDGFRA总体阳性率为55.4%,高于文献报告。出现这种情况,可能的主要原因是切片制作过程中非特异性着色所造成的。研究认为,PDGFRA免疫组化抗体的敏感性较差,尚未作为病理学诊断GISTs的常规抗体。但是本研究显示,单独应用CD117 GISTs诊断率可达97.3%,如果联合应用CD117和PDGFRA诊断率可以提高到100%,而CD117联合CD34或DOG1没能提高GISTs的诊断率,这种情况的原因还有待于进一步讨论。由此可见,PDGFRA是CD117的必要补充,在日常工作中应该使用该抗体进行病理学诊断。
最近,学者发现了的一个新的GISTs肿瘤标记物,即DOG1。DOG1是由基因FLJ0261编码的一种未知功能的蛋白,强烈表达于GIST细胞表面,很少表达于其他软组织肿瘤。因此,DOG1可提高GISTs的诊断率,包括c-kit突变阳性而PDGFRA突变阴性的GISTs。DOG1在GISTs病理学诊断中,尤其是CD117阴性病例中有重要应用价值。在大宗病例研究中,阳性率可以高达94.4%〔9〕,学者发现87%的GISTs患者DOG-1阳性,而在这些病例中仅有74%CD117阳性。Espinosa等〔10〕的研究发现DOG-1在GISTs中的表达与基因突变类型、突变位置、肿瘤大小、肿瘤级别和患者年龄均没有相关性。本研究该蛋白的表达与患者的年龄、性别、部位、核分裂象没有显著相关性。DOG-1是一种敏感和特异的GISTs标记物,其在胃肠道间叶来源肿瘤的鉴别诊断中可发挥重要作用,并且免疫组化方法简单易行,对DOG-1蛋白的检测值得在GIST的诊断和鉴别诊断中推广应用。
综上所述,在日常病理学诊断中CD117是最有应用价值的抗体,在胃、小肠以及结直肠中阳性表达率较高,在肿瘤直径>10 cm和核分裂象<5/50 HPF组别中阳性表达率较低。PDGFRA是CD117抗体的必要补充,两者组合可以显著提高GSITs诊断率。DOG-1在GISTs阳性表达率较高,尤其在低度和中度风险肿瘤中阳性表达率较高,在肿瘤>10 cm组别中阳性表达率偏低,应该在临床病理学诊断中推广使用。CD34、desmin及S100在GISTs中可以呈阳性反应,对于诊断和鉴别诊断具有重要的辅助作用。由此,作者推荐在疑难病例中应用CD117、PDGFRA、DOG-1、CD34、Desmin以及S100抗体组合进行病理学诊断。
1 Laurini JA,Carter JE.Gastrointestinal stromal tumors:a review of the literature〔J〕.Arch Pathol Lab Med,2010;134(1):134-41.
2 Miettinen M,Blay JY,Sobin LH.Pathology and genetics of tumours of the digestive system〔M〕.Lyon:IARC Press,2000:62-5.
3 Mazur MT,Clark HB.Gastric stromal tumors:reappraisal of histogenesis〔J〕.Am J Surg Pathol,1983;7(6):507-19.
4 Vij M,Agrawal V,Kumar A,et al.Gastrointestinal stromal tumors:a clinicopathological and immunohistochemical study of 121 cases〔J〕.Indian J Gastroenterol,2010;29(6):231-6.
5 Orosz Z,Tornóczky T,Sápi Z.Gastrointestinal stromal tumors:a clinicopathologic and immunohistochemical study of 136 cases〔J〕.Pathol Oncol Res,2005;11(1):11-21.
6 Fulop E,Marcu S,Milutin D,et al.Gastrointestinal stromal tumors:review on morphology,diagnosis and management〔J〕.Rom J Morphol Embryol,2009;50(3):319-26.
7 Hornick JL,Fletcher CD.The role of KIT in the management of patients with gastrointestinal stromal tumors〔J〕.Hum Pathol,2007;38(5):679-87.
8 Heinrich MC,Corless CL,Duensing A,et al.PDGFRA activating mutations in gastrointestinal stromal tumors〔J〕.Science,2003;299(5607):708-10.
9 Miettinen M,Wang ZF,Lasota J,et al.DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors〔J〕.Am J Surg Pathol,2009;33(9):1401-8.
10 Espinosa I,Lee CH,Kim MK,et al.A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors〔J〕.Am J Surg Pathol,2008;32(2):210-21.
