酸碱处理对酪蛋白源ACE抑制肽稳定性影响的研究
2012-01-05邬威姜瞻梅
邬威,姜瞻梅
(东北农业大学 食品学院,哈尔滨 150030)
酸碱处理对酪蛋白源ACE抑制肽稳定性影响的研究
邬威,姜瞻梅
(东北农业大学 食品学院,哈尔滨 150030)
在不同pH值条件下,处理酪蛋白源ACE(血管紧张素转换酶)抑制肽,以ACE抑制活性、游离氨基质量浓度以及色差值为检测指标,研究了酸碱处理对ACE抑制肽稳定性的影响。结果表明,ACE抑制肽受酸碱度影响较大,pH值为1~8的ACE抑制肽的抑制活性维持在一个较高水平,平均抑制活性达到58.33%,pH值为9~13的样品抑制活性明显降低;游离氨基质量浓度在中性条件下较高,随着酸性和碱性条件的增强,其含量逐渐降低;另外,ACE抑制肽在pH<3和pH>11条件下,随酸性和碱性条件的增强,b*值变大,颜色变深。因此,在食品加工贮藏过程中,为使酪蛋白源ACE抑制肽保持活性稳定,应避免其处于过酸或过碱的加工条件。
血管紧张素转换酶;抑制肽;稳定性;酸碱处理
0 引 言
自从1965年Ferreira[1]首次在蝮蛇毒液中发现ACE(血管紧张素转换酶)抑制肽以来,现已从不同食物蛋白质中获得了各种ACE抑制肽[2-4]。其中,酪蛋白源ACE抑制肽因其安全性高,无毒副作用等优点,在高血压的治疗研究中具有重要的实践价值和研究意义[5-6]。目前,蛋白源ACE抑制肽的制备方法、分离纯化鉴定,体内功效活性方面的研究日趋成熟,如利用生物酶解技术[7],发酵技术[8]和基因工程技术[9]均获得了不同活性的ACE抑制肽,但在加工贮藏过程中,酪蛋白源ACE抑制肽是否能保持强的抑制活性,未见研究报道。
本研究通过改变不同酸碱条件处理酪蛋白源ACE抑制肽,研究对其抑制活性的影响。这可为制定科学的生产工艺,生产制备出有高稳定性的ACE抑制肽,提供基本的技术支撑。
1 材料与方法
1.1 材料与试剂
酪蛋白 (乳品科学教育部重点实验室自制),β-巯基乙醇、十二烷基磺酸钠 (SDS)、邻苯二甲醛(OPA)、L-亮氨酸,血管紧张素转换酶(ACE),马尿酰组胺酰亮氨酸(HHL),乙腈(色谱纯),三氟乙酸(色谱纯),其他试剂均为国产分析纯。
1.2 仪器与设备
pH计,AL-104精密电子天平,HH-QS超级恒温油浴锅,不锈钢电热恒温水浴锅,SE-2000型色差计,TU-1800型紫外可见分光光度计,全自动高效液相色谱仪,Pall filtron超滤系统,LGJ-25冷冻干燥机。
1.3 方法
1.3.1 酪蛋白源ACE抑制肽的制备
精确称取一定量的酪蛋白,用pH值为7.4的磷酸盐缓冲液将其溶解,置于恒温水浴锅中,待反应体系温度达到水解温度时,加酸(HCl)或碱(NaOH)达到预定pH值为7,然后加入As.1398中性蛋白酶进行水解,在整个水解过程中用电动搅拌机不断搅拌,并不断加入适当浓度的NaOH以维持pH值在规定范围的±0.05内。当反应6 h后,将反应体系在沸水浴中保温20 min中止反应。将水解物在4 000 g离心30 min,取上清液,采用3 ku的超滤膜过滤取透过液,然后将其进行冷冻干燥,即得酪蛋白源ACE抑制肽。
1.3.2 ACE抑制活性的测定
取120 μL马尿酰组胺酰亮氨酸(HHL)底物液,加入20 μL抑制剂,混合均匀后加入10 μL的ACE酶液充分混合。在37℃条件下保温60 min后,再加入150 μL浓度为1 mol/L的HCl中止反应,并加0.5 mL去离子水,得到反应液。该反应液用0.45 μm滤膜过滤后在HPLC系统自动进样分析。同时用20 μL,pH值为8.3的硼酸盐缓冲液替代抑制剂溶液作为空白对照组。ACE抑制活性计算公式为

式中:M为空白对照样组中马尿酸的峰面积;N为添加抑制剂组中马尿酸的峰面积。
1.3.3 游离氨基的测定
采用邻苯二甲醛(OPA)方法,参照Guan[10]等人的方法,并略作修改。100 mL OPA试剂含:50 mL浓度为0.1 mol/L硼酸盐缓冲液,5mL质量分数为20%的SDS溶液,2 mL含80 mg OPA的甲醇溶液,200 μL β-巯基乙醇。质量浓度为20 g/L的ACE抑制肽样品50 μL,用去离子水稀释至600 μL。 取稀释液100 μL与3 mL配制好的OPA试剂均匀混合,置于室温黑暗处反应,准确计时5 min,340 nm处测定吸光值。且以L-亮氨酸为标准物,按上述方法绘制出亮氨酸浓度与吸光值之间的标准曲线方程,根据标准曲线计算出各样品中游离氨基的含量。
1.3.4 颜色的测定
称取制备好的ACE抑制肽样品,用去离子水配成质量浓度为20 g/L的溶液,使用色差计进行测定,记录色差计显示的L*,a*,b*,ΔE*的值; 每个样品记录6个读数。因样品的颜色呈黄色,主要用到的即是测定后的b*值(黄度值)。
1.3.5 不同pH值条件下ACE抑制肽样品的制备
称取ACE抑制肽样品,用去离子水配制成质量浓度为80 g/L溶液,利用浓度为1 mol/mL的HCl和浓度为1 mol/mL的NaOH调节pH值,将其pH值依次调至1~13。pH值调节后,将不同pH值的ACE抑制肽转至具塞试管中,在100℃条件下油浴1 h。油浴反应完成后,在真空冷冻干燥条件下,制备出不同pH值条件的ACE抑制肽粉,待检测分析。
1.3.6 数据处理
每个样品每项指标均重复测定至少3次,数据采用SPSS13.0软件进行方差分析,并用Origin75软件绘图。
2 结果与讨论
2.1.1 酸碱处理对ACE抑制肽抑制活性的影响
在100℃的加热条件下,不同pH值处理酪蛋白源ACE抑制肽1h后,利用高效液相法检测ACE抑制活性结果如图1所示。
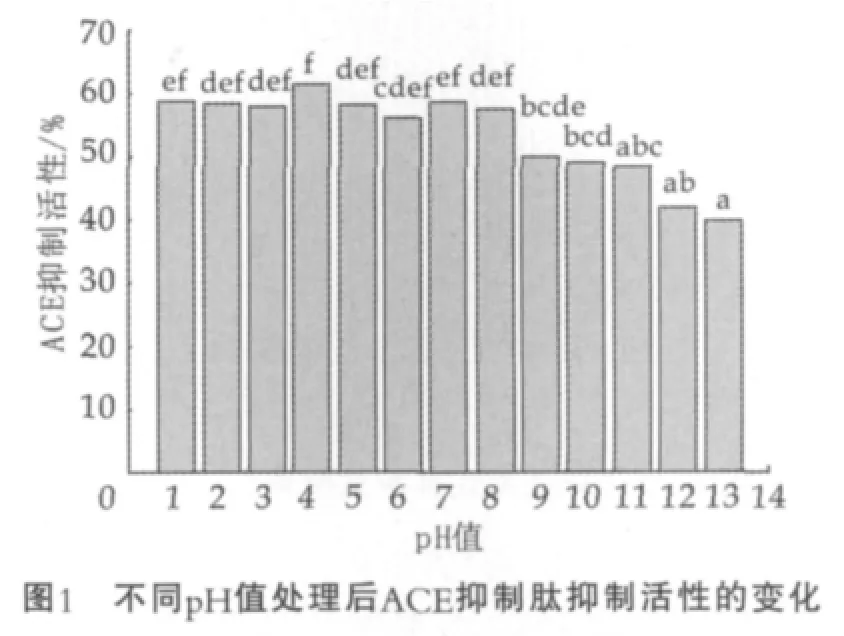
图1中,a,b,c等字母相同则表示差异不显著,不同则表示差异显著。Duncan分析,其中P<0.05表示差异显著,P>0.05表示差异不显著。下同。
由图1可以看出,pH值为1~8的酸碱加热条件处理后的ACE抑制肽样品,其ACE抑制活性差异不显著(P>0.05),pH值为9~12的酸碱加热条件的样品,其ACE抑制活性差异也不显著(P>0.05)。 pH值为1~8的ACE抑制肽抑制活性维持在一个较高的水平,平均抑制率达到58.33%。且pH值为4条件处理后的样品抑制活性最高,经碱性条件处理后,pH值为9~13的样品抑制活性明显降低,并在pH值为13条件下ACE抑制活性下降到最低值。因此想要保持ACE抑制肽抑制活性的稳定,应控制好pH值条件,避免处于碱性(pH>9)条件,造成ACE抑制肽抑制活性的损失。
2.1.2 酸碱处理对ACE抑制肽游离氨基质量浓度的影响
按照OPA方法检测游离氨基质量浓度,以L-亮氨酸质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线如图2所示。
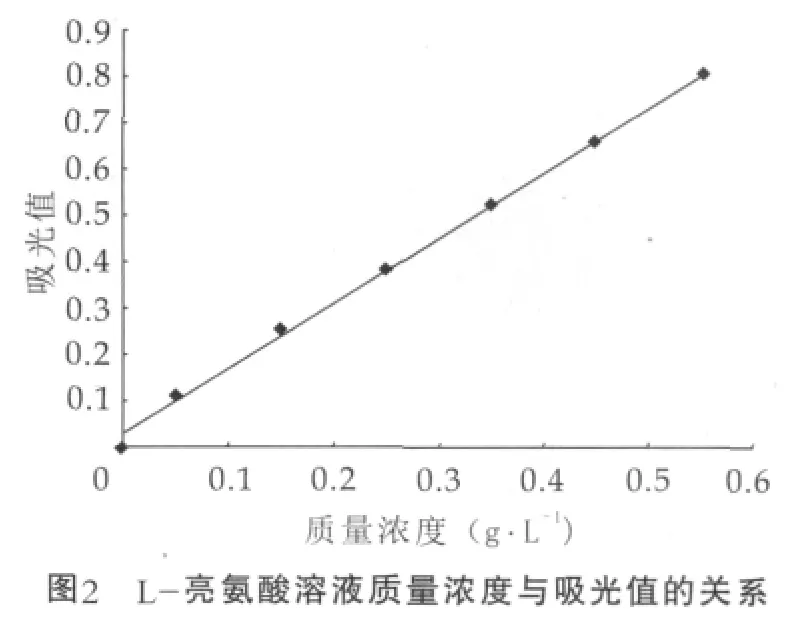
L-亮氨酸的质量浓度与吸光值的关系之间的回归方程为

根据绘制出的亮氨酸标准曲线,计算出质量浓度为0.13 g/L的酪蛋白源ACE抑制肽在100℃的加热条件下,不同pH值处理1 h后游离氨基的质量浓度,结果如图3所示。
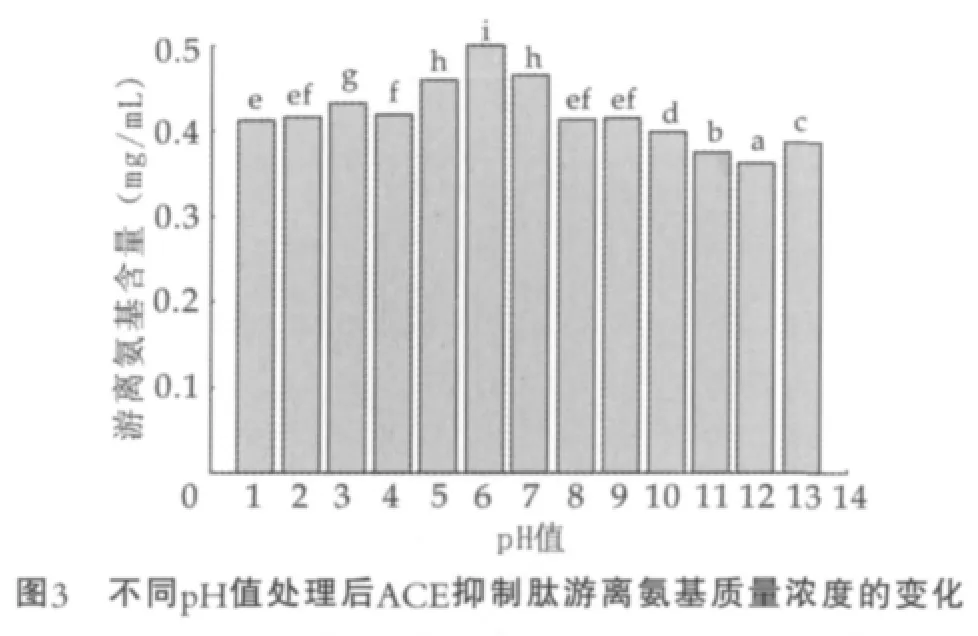
由图3可以看出,pH值为1~2,pH值为4,pH值为8~9酸碱加热处理后的ACE抑制肽样品;游离氨基质量浓度差异不显著 (P>0.05),pH值为5和7处理后的ACE抑制肽样品的游离氨基质量浓度差异也不显著 (P>0.05)。 酸性(pH<6)条件下,ACE抑制肽样品的游离氨基质量浓度呈现较小波动,pH值为3时,质量浓度有所升高,pH值为6时分解程度达到最大,形成的游离氨基质量浓度最高。碱性(pH>9)条件下,随pH值的增大,样品中游离氨基质量浓度降低,pH值为12时达到最低值。由此可知,ACE抑制肽的分解易受pH值影响,pH<9条件下处理的ACE抑制肽样品,分解断裂产生的游离氨基质量浓度较高,ACE抑制肽的保留较强活性,pH>9时分解产生游离氨基的质量浓度降低,ACE抑制肽活性受到抑制。
2.1.3 酸碱处理对ACE抑制肽颜色的影响
在100℃的加热条件下,不同pH值处理酪蛋白源ACE抑制肽1 h后,使用色差计测定其黄度值b*,结果如图4所示。
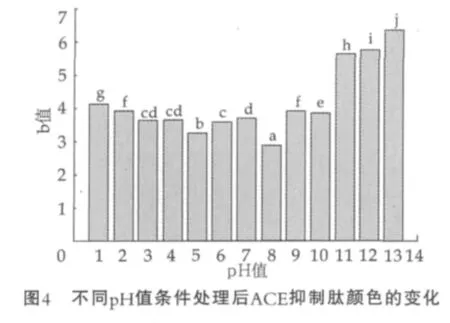
由图4可以看出,pH值为3,4,6,7酸碱加热处理后的ACE抑制肽样品, 黄度值b*差异不显著 (P>0.05),pH2、pH9处理后的ACE抑制肽样品,黄度值b*差异也不显著(P>0.05),其余pH值条件处理的样品均差异显著(P<0.05)。 pH值为8时,样品b*值达到最低,颜色最浅,说明在此条件,肽样品分解程度低,生成的有色物质最少;pH值为5次之,pH值为13时b*值最大,颜色最深,说明ACE抑制肽在此条件下分解最剧烈。从整体趋势来看,样品在pH<3和pH>11的条件下,随酸碱度增大,b*值变大,颜色变深。由此可知,ACE抑制肽的酸碱加热处理后的颜色易受pH值影响,且受碱性条件影响较大。
3 结 论
酪蛋白源ACE抑制肽的抑制活性,在中性和酸性条件下未发生改变,但当pH>9时,ACE抑制肽的抑制活性随pH值增大而下降;在中性条件下,ACE抑制肽的游离氨基质量浓度较高,但随着酸性和碱性条件增强,其游离氨基降低;在中性条件下,ACE抑制肽的颜色较浅,在酸性和碱性条件下颜色较深,经pH>11条件处理后,颜色变化剧烈,并随pH值增大,颜色加深。
[1]FERREIRA S H.A Bradykinin-Potentiating Factor Present in the Venom of Bothrops Jararaca[J].Brit J Pharmacol,1965,24:163–169.
[2]MEGUMI K,KUMI T,MASAYASU S,et al.Angiotensin I-converting EnzymeInhibitoryPeptidesin Red-MoldRiceMadeby Monascus Purpureus[J].Process Biochemistry,2009,44:1139–1143.
[3]ZHANG J H,EIZO T,DING C H,et al.Angiotensin I-converting Enzyme Inhibitory Peptides in Douchi,a Chinese Traditional Fermented Soybean Product[J].Food Chemistry,2006,98:551–557.
[4]WON K J,MENDIS E,JAE Y J,et al.Angiotensin I-converting Enzyme Inhibitory Peptide from Yellowfin Sole (Limanda Aspera)Frame Protein and Its Antihypertensive Effect in Spontaneously Hypertensive rats[J].Food Chemistry,2006,94:26–32.
[5]WALDMANN A.Monoelonal Antibodies to Progesterone.Characterization and Selection for Enzyme Immunoassay in Bovine Milk[J].Hybridoma,1999,18(3):289–296.
[6]ELS H G,JAMES P G,JOSEPH M S,et al.Development and Validation of a Biosensor-Based Immunoassay for Progesterone in Bovine Milk[J].Journal of Immunological Methods,2002,267:131–138.
[7]姜瞻梅,田波,吴刚,等.酶解牛乳酪蛋白制备ACE抑制肽的研究[J].中国食品学报,2007,7(6):39–42.
[8]JAE Y J,PYO J P,HEE G B,et al.Angiotensin I Converting Enzyme(ACE)Inhibitory Peptide Derived from the Sauce of Fermented Blue Mussel,Mytilus Edulis[J].Bioresource Technology 2005,96:1624–1629.
[9]吴亚丽,邓毛程,梁世中.利用重组基因工程菌制备降血压肽的工艺研究[J].现代食品科技,2008,24(1):55–58.
[10]GUAN J J,QIU A Y,HUA Y F,et al.Microwave Improvement of Soy Protein Isolate-Saccharide Graft Reactions[J].Food chemistry,2006,7:577-585.
Study on effects of treatment of heating combined with acid and alkali on the stabilities of angiotensin converting enzyme inhibitory peptide derived from bovine casein
WU Wei,JIANG Zhan-mei
(Food Science&Technology of Northeast Agricultural University,Harbin 150030,China)
Effects of different processing and storage conditions on stabilities of angiotensin converting enzyme inhibitory peptide were studied by determining ACE inhibitory activity,free amino group content and color.It was shown that stabilities of ACE inhibitory peptide were easily influenced by pH value.Under the conditions of pH1~pH8,ACE inhibitory activity maintained in a higher level and average inhibition activity reached 58.33%.Meanwhile,there was decrease of ACE inhibitory activity at pH9~pH13.Under the conditions of pH<3 and pH>9,free amino group content of ACE inhibitory peptides decreased and their colors turned dark.Consequently,in order to keep the stabilities of ACE inhibitory peptide stable,food processing and storage conditions of pH<3 or pH>9 should be avoided.
angiotensin converting enzyme;inhibitory peptide;stability;acid and alkali treatment
Q93-33
A
1001-2230(2012)04-0018-03
2011-11-25
国家自然科学基金项目(31000801)。
邬威(1988-),女,硕士研究生,研究方向为乳品加工与畜产品。
姜瞻梅
