运动结合补充亮氨酸通过抑制炎性反应促进C26荷瘤小鼠骨骼肌蛋白质沉积研究
2019-10-18尚画雨孙君志丁海丽柯志飞赵静夏志
尚画雨 孙君志 丁海丽 柯志飞 赵静 夏志

摘 要:探討运动结合膳食补充亮氨酸对癌性恶病质骨骼肌蛋白质沉积的影响及机制。方法:4周龄雄性BALB/c小鼠24只,根据体重随机分为正常对照组(C组)、荷瘤组(T组)及运动结合补充亮氨酸干预组(TEL组),其中T组与TEL组小鼠进行荷瘤处理。C组与T组小鼠进食添加3.4%比例丙氨酸饲料,TEL组饲料中则添加5%比例亮氨酸,实验期每日称量计算采食量。TEL组小鼠每周一、三、五进行无负重游泳运动30 min,二、四、六进行10组抗阻运动(每组30 s,组间间歇1 min),末次运动间隔24 h后(含禁食8 h)称重并处死全部小鼠,分离腓肠肌称重并制备血清。计算小鼠累积采食量与体重变化;酶联免疫吸附(ELISA)法检测血清与腓肠肌肿瘤坏死因子(TNF)-α与白介素(IL)-6含量;Bradford法进行蛋白定量;抓握力计测量小鼠肌力。结果:与C组小鼠相比,荷瘤导致小鼠累积采食量呈下降趋势,体重、腓肠肌湿重、腓肠肌蛋白总量、肌原纤维蛋白含量、肌浆蛋白含量与肌力均显著下降(P<0.01),而血清与腓肠肌TNF-α、IL-6含量则显著增加(P<0.01)。TEL组小鼠与C组相比也表现出了相同的变化趋势,但较T组小鼠具有显著改善(P<0.05或P<0.01)。结论:运动联合5%膳食亮氨酸干预可显著增加C26荷瘤小鼠骨骼肌蛋白质沉积,其机制可能与其对炎性反应的抑制有关。
关键词:运动;亮氨酸;恶病质;骨骼肌;蛋白质沉积
中图分类号:G 804.2 学科代码:040302 文献标识码:A
Abstract:Objective: To investigate the effect of concurrent exercise training in combination with leucine supplementation on skeletal muscular protein deposition and preliminarily analyzes the possible mechanism. Methods: 24 four-week-old male BALB/c mice were randomly divided into normal control (C), tumor bearing (T) and tumor bearing received exercise and leucine supplementation group (TEL) by body weight, mice in T and TEL group will then suffered tumor inoculation. Mice in normal control (C) and tumor bearing (T) group were treated with normal chow diet supplemented with 3.4% alanine, while mice received exercise and leucine supplementation (TEL) were fed with formulated diet contained 5% leucine. And, food intake was calculated daily. TEL mice received 30 minutes swimming training 3 days per week (Monday, Wednesday and Friday) without external load, and 3 days (Tuesday, Thursday and Saturday) resistance exercise training (10 sets per day, 30 seconds per set with 1 minute interval between sets). All mice were weighed and sacrificed 24 hours post the final training bout with 8 hours fasting period, after which the gastrocnemius muscle were separated and weighed, and the serum were also prepared. Both cumulative food intake and body weight change were calculated. The content of TNF-α and IL-6 in gastrocnemius muscle and serum were determined by ELISA. The protein content was analyzed using commercial bradford kit. The maximal grip strength was measured with a commercial grip strength meter. Results: Compared with mice in Group C, the results showed that tumor bearing induced downward trend in cumulative food intake, body weight, wet gastrocnemius muscle weight, total protein content, sarcoplasmic protein content, myofibrillar protein content and muscle strength decreased significantly (P<0.01), while both TNF-α and IL-6 content in serum and gastrocnemius were obviously increased (P<0.01). Mice in TEL group showed the same pattern of change when comparing with C group, but were also were found be ameliorated by treatment of exercise in combination with leucine supplementation when comparing with mice in T group (P<0.05 or P<0.01). Conclusion: Exercise training combined with 5% leucine supplementation significantly ameliorates skeletal muscular protein deposition in C26 tumor bearing mice, which may be correlated with inhibiting the inflammatory response.
Keywords:exercise; leucine; cancer cachexia; skeletal muscle; protein deposition
癌性恶病质(cancer cachexia)是恶性肿瘤患者普遍存在的多因素综合征,不能被常规营养支持治疗所逆转,且会诱发渐进性功能障碍,主要表现为骨骼肌质量与体质量的进行性丢失[1-2]。作为人体运动系统的动力来源,骨骼肌的丢失一方面将直接导致癌症患者活动能力下降、疲劳及身体机能减退,严重影响其生活质量,另一方面还会阻碍治疗方案的实施,降低化疗敏感性,增加并发症发生率,缩短生存期,是导致患者死亡的主要原因。与之相反,良好的机能状态则与患者对放疗、化疗的耐受力和应答水平及生存率呈正相关[3]。
蛋白质代谢平衡紊乱是诱发骨骼肌萎缩的直接原因。就癌性恶病质而言,其骨骼肌萎缩机理较衰老性肌萎缩等萎缩状态有所差异,主要由蛋白质降解的异常增多而致使蛋白质沉积减少,但“合成抵抗”的影响则相对较小[1]。全身慢性低水平炎症在恶病质肌萎缩的发展过程中具有重要影响,可改变骨骼肌系统蛋白质的代谢平衡,使平衡趋向于降解从而加速骨骼肌量丢失[4]。运动与亮氨酸在促进骨骼肌蛋白质合成与抑制降解方面均有作用,可以显著改善骨骼肌蛋白质代谢平衡,具有削弱癌性恶病质骨骼肌萎缩的重要潜力。其中,有氧运动可发挥显著的抗炎效应[5],抗阻运动可以抑制蛋白质分解代谢并降低肿瘤坏死因子(tumor necrosis factor, TNF)-α水平[3,6],而亮氨酸则可同时削弱炎性反应继发的厌食并促进骨骼蛋白质合成[7]。笔者此前的研究表明,规律性运动训练尤其是有氧与抗阻运动在同一干预周期内的同期训练结合5%剂量膳食亮氨酸补充可以刺激衰老骨骼肌蛋白质合成,削弱蛋白质降解,抑制萎缩性病变并诱导适应性骨骼肌肥大[8]。已有的研究结果[9]也显示,采用运动与补充亮氨酸进行联合干预可以有效促进蛋白质周转并提升机体氮含量,但其对机体炎性反应的影响则仍未阐明。基于此,本研究拟以C26结肠癌荷瘤小鼠为研究对象,采用运动结合亮氨酸干预的方式,观察对机体炎症与蛋白质沉积水平的影响,探讨运动结合亮氨酸干预对癌性恶病质肌萎缩的保护作用及可能的作用机制。
1 材料与方法
1.1 实验动物与分组
本研究以4周龄雄性BALB/c小鼠为实验对象,适应性饲养1周后选择体质量20 g左右的小鼠纳入正式研究,采用区间分组法,依据体质量将小鼠随机纳入正常对照组(C组;(22.7±0.8)g)、荷瘤组(T组;(22.5±0.8)g)和荷瘤运动亮氨酸组(TEL组;(22.8±0.6)g),每组8只,共计24只。TEL组小鼠给予运动结合亮氨酸干预2周,C组与T组小鼠常规饲养。全部小鼠均单笼饲养,自由摄水、进食,从肿瘤接种前1日起每日称量计算采食量。室内控制为12 h/12 h光暗周期,室温(21±2)℃,湿度52%~60%。
1.2 癌性恶病质造模
C26结肠癌实体肿瘤组织复温,将小鼠右侧腋下消毒后,将肿瘤组织移植于腋窝中部外侧皮下并缝合消毒。待肿瘤生长12~15 d后直接断髓处死小鼠,酒精浸泡消毒后剥离新鲜肿瘤组织,选择无坏死、呈鱼肉状的瘤组织剪成小块。每50 mg肿瘤实体组织加入0.9%生理盐水0.1 mL,匀浆后制成肿瘤细胞悬液,浓度约1×107/mL。取0.1 mL接种T组与TEL组小鼠右腋中部外侧皮下,C组小鼠注射等量生理盐水。
1.3 运动方案
TEL组小鼠自接种当日开始运动,每周一、三、五进行30 min无负重持续游泳训练。抗阻运动同样采用水中运动方式,每周二、四、六晚进行。抗阻运动时将泳池隔为8个独立泳区,水深40 cm。每次训练含10组运动,每组30 s,组间休息1 min,负荷为自重的40%~50%。30 s内,小鼠将完成8~10次跳跃。这一方案为典型的无氧、力量运动。
1.4 饲料配置
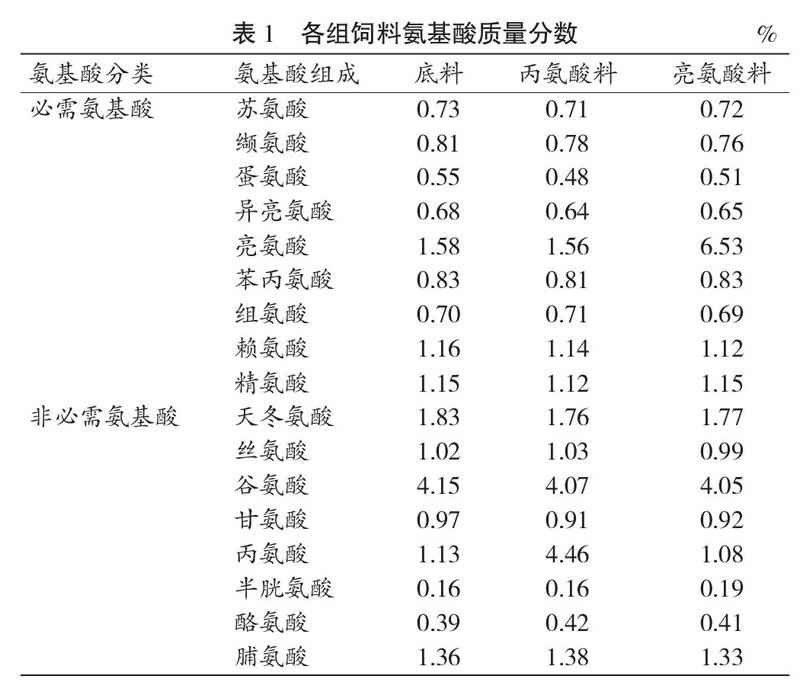
按照笔者前期研究使用的方法,在TEL组小鼠饲料中添加5%剂量亮氨酸,C组与T组小鼠饲料中添加3.4%等氮剂量不影响骨骼肌蛋白质代谢的非必需氨基酸丙氨酸。添加时采用替换等量玉米粉的方式,以使各组小鼠所摄入粗蛋白大致相当[7-81,0-11]。亮氨酸料的粗蛋白的质量分数为21.1%,丙氨酸料的粗蛋白的质量分数为21.8%。饲料的氨基酸含量见表1。

1.5 取樣
种瘤14 d且TEL组小鼠末次训练后24 h(过夜禁食8 h),摘眼球取血并处死小鼠(不麻醉),制备血清。迅速分离腓肠肌称重,-80 ℃冻存待测。
1.6 主要仪器与试剂
L8800全自动氨基酸分析仪购自日本日立公司,Multi Skan3酶标仪购自美国热电公司, YLS-13A大、小鼠抓握力计购自济南益延科技公司。亮氨酸与丙氨酸均购自上海生工公司;Bradford蛋白定量试剂盒购自北京碧云天公司;TNF-α与IL-6定量试剂盒购自美国R&D公司;常规试剂均购自国家标准物质中心、国药或金山试剂公司,为优级纯或分析纯。
1.7 指标检测
1.7.1 肌原纤维与肌浆蛋白定量
肌原与肌浆蛋白定量方法参考本研究前期的成果[11],取待测腓肠肌样本在5%预冷缓冲液(含蔗糖0.25 mol/L、EDTA 2 mmol/L及Tris-HCl 10 mmol/L)内匀浆后以600 g转速离心20 min,分离富含肌原纤维蛋白的沉降物。上清继续以100 000 g转速在4 ℃离心60 min,分离肌浆蛋白。Bradford法蛋白定量[12]。
1.7.2 炎性细胞因子定量
采用ELISA法对血清与腓肠肌TNF-α与IL-6进行定量。严格按照试剂盒说明书进行操作,检测波长450 nm,参比波长570 nm。制备腓肠肌匀浆时,将冻存肌样在缓冲液中(含10 mmol/L HEPES、10 mmol/L KCl、2 mmol/L MgCl2、0.1 mmol/L EDTA、1.0 mmol/L DTT、10% NP-40和0.5 mmol/L PMSF)制成悬液并于冰浴中匀浆,匀浆后4 ℃条件下以16 000 g转速离心10 min,收集上清进行定量分析。
1.7.3 最大肌肉力量评价
采用小鼠后肢抓握力评价骨骼肌功能。在正式干预前测定基础值后每周日进行重复测量。测试时用输液软管套住小鼠前爪使其不能抓握,提起鼠尾待其后肢抓緊测力板抓握杆后缓慢、持续地水平向后拉动,当双侧后肢同时松开抓握杆时记录显示数值。每只小鼠视测试表现重复6~10次,以最大值为准。
1.8 数据处理
应用SPSS 20.0软件包进行数据分析。累积采食量采用描述性统计进行分析,其他指标均采用双因素方差分析进行统计学处理,组间多重比较采用Bonferroni或Games-Howell事后检验,据方差齐性选择相应P值判断。P≤0.05时,认为差异具有统计学意义。
2 结果
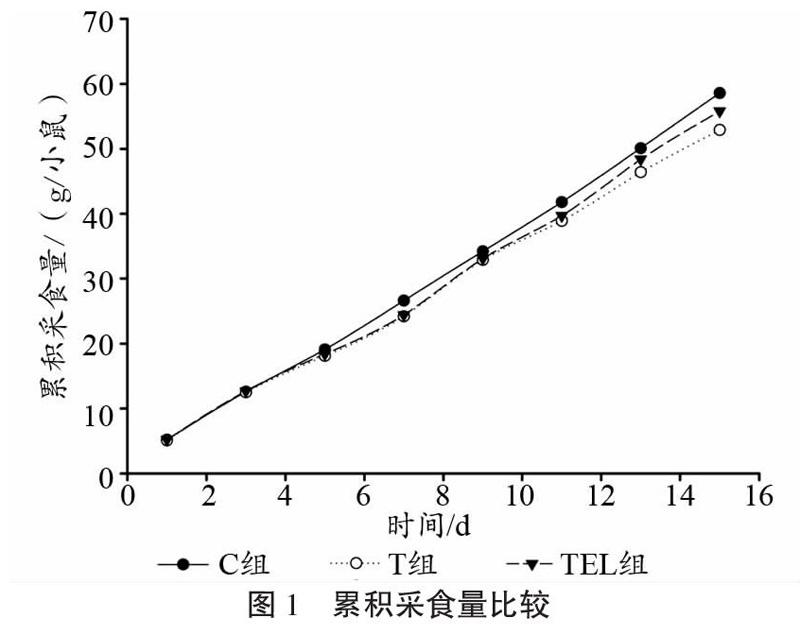
2.1 累积采食量
实验期内各组小鼠累积采食量变化如图1所示。T组荷瘤小鼠累积采食量较C组小鼠降低9.7%,运动结合亮氨酸削弱了荷瘤对采食量的影响,但TEL组小鼠较C组采食量仍有4.8%下降。

2.2 体质量与腓肠肌重
如图2A所示,方差分析结果显示各组小鼠处死前体质量组间差异具有统计学意义(F=75.052,P<0.001),组间多重比较结果表明,C组(26.1±1.2)小鼠体质量显著高于T组(20.7±0.9,P<0.001)与TEL组(21.8±0.6,P<0.001),且TEL组小鼠高于T组(P =0.021)。如图2B所示,体质量变化组间差异具有统计学意义(F=357.623,P<0.001),组间多重比较结果表明C组小鼠体质量呈增长趋势(3.4±0.6),T组与TEL组小鼠体质量则较初始体质量下降(T:-1.9±0.3;TEL:-1.0±0.3),但TEL组小鼠体质量下降幅度显著低于T组(P<0.001)。腓肠肌湿重值组间比较结果如图2C所示,方差分析结果表明组间差异具有统计学意义(F=65.629,P<0.001),多重比较结果也显示,C组(128.9±6.2)显著高于T组(97.3±6.4)与TEL组(111.1±3. 6),P值均小于0.001。

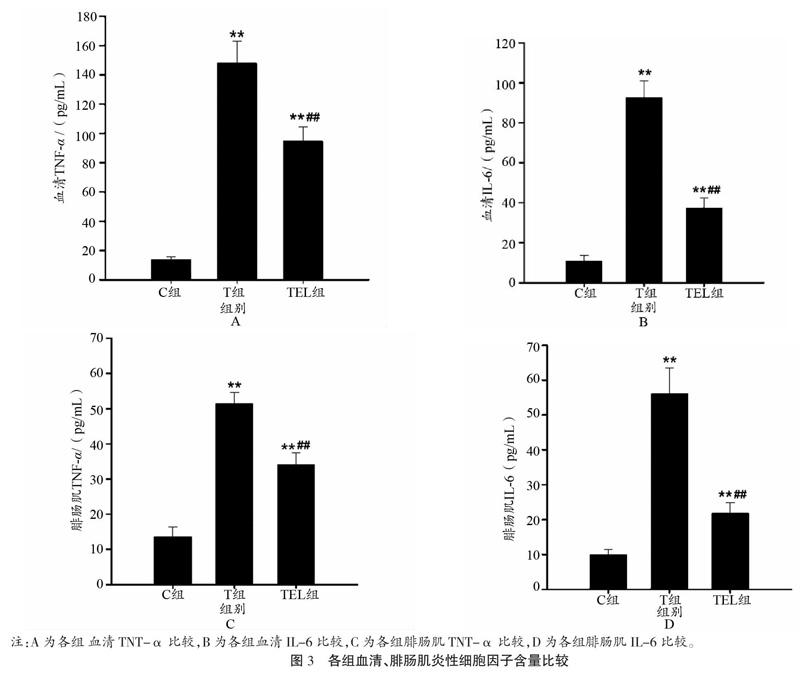
2.3 炎性细胞因子
如图3A和3B所示,T组小鼠血清TNF-α含量较C组增长9.6倍(P<0.001),IL-6增长7.5倍(P<0.001)。尽管TEL组TNF-α与IL-6含量也显著高于C组小鼠(P<0.001),但较T组而言则分别显著下降36.0%和59.6%(P<0.001)。如图3C和3D所示,腓肠肌TNF-α与IL-6含量也表现出了同样的组间趋势:T组腓肠肌TNF-α含量较C组小鼠显著增长2.8倍(P<0.001),IL-6显著增长4.7倍(P<0.001),TEL组也分别有1.5倍与1.2倍的显著增加(P<0.001)。但就TEL与T组比较而言,TEL组小鼠腓肠肌TNF-α与IL-6分别显著下降33.7%和61.1%(P<0.001)。
2.4 蛋白含量
如图4A所示,腓肠肌蛋白总量组间差异具有统计学意义(F=60.370,P =0.000),组间多重比较结果显示C组(51.2±3.6)小鼠腓肠肌蛋白总量显著高于T(35.7±2.7,P<0.001)组与TEL组(40.3±2.2,P<0.001),且TEL组较T组为高(P=0.005)。如图4B所示,腓肠肌肌原纤维蛋白含量比较也具有统计学意义的组间差异(F=56.757,P =0.000),且C组(43.3±2.5)小鼠蛋白总量显著高于T(28.6±3.0,P<0.001)组与TEL组(34.0±2.8,P<0.001),TEL组也较T组显著增加(P=0.001)。如图4C所示,腓肠肌肌浆蛋白含量组间比较,C组(38.3±2.1)含量显著高于T组(26.5±2.9,P<0.001)与TEL组(30.7±2.1,P<0.001),且T与TEL组间差异也有统计学意义(P=0.002)。

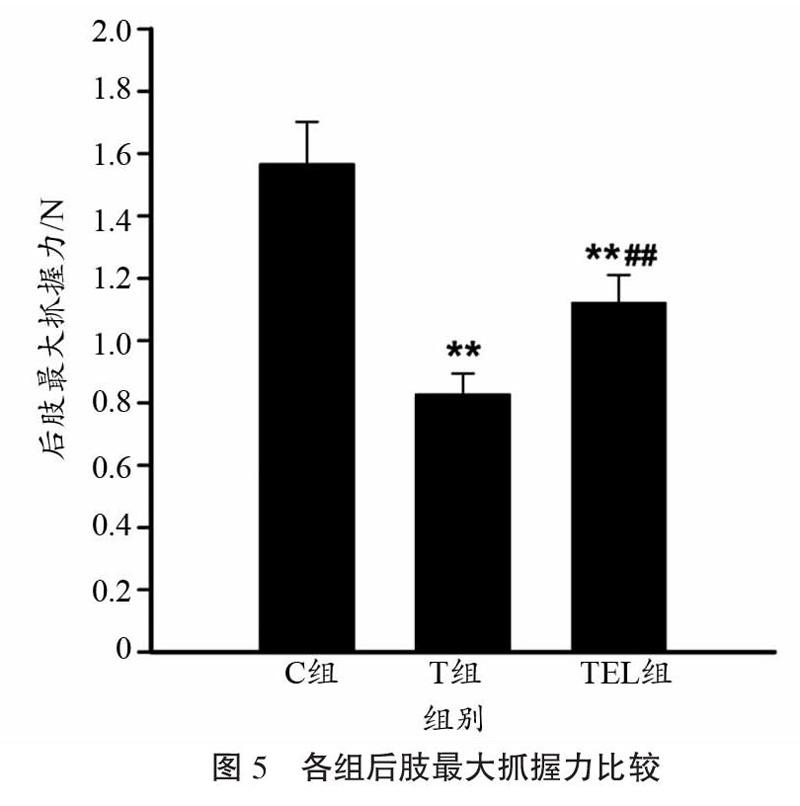
2.5 肌肉力量
小鼠最大抓握力组间比较结果如图5所示。方差分析结果表明,各组小鼠后肢最大抓握力差异具有统计学意义(F=105.573,P<0.001);组间多重比较结果则显示,T组与TEL组小鼠后肢抓握力较C组均有显著下降(P<0.001),但TEL组小鼠肌力显著高于T组(112.2±8.9 vs 82.7±6.8,P<0.001)。
3 讨论
癌性恶病质发病机制复杂,是肿瘤—宿主交互作用所產生的结果,其特点在于宿主对肿瘤的存在所产生的炎性反应及蛋白质平衡紊乱。恶性肿瘤可激活促炎与急性期反应,而慢性的全身性炎症则是癌性恶病质发生与发展最为重要的中间环节,直接受到炎性细胞因子的调节(例如TNF-α和IL-6),炎性细胞因子可能通过协同促进的方式发挥效应,通过细胞、器官之间的cross-talk形成恶性循环,导致蛋白质合成减少及蛋白质降解增多,患者则迅速出现瘦体重减轻、骨骼肌质量丢失等表征[13]。前期研究表明,蛋白质代谢紊乱是癌性恶病质所致骨骼肌萎缩的直接原因,可能是蛋白质合成率下降、降解率升高或两者共同作用的结果[14],最终导致蛋白质沉积减少。这种肌肉萎缩的病理生理变化可能涉及蛋白质和氨基酸代谢的改变、细胞凋亡的活化及肌纤维再生能力的下降等,且多与炎症有关,但具体分子机制则迄今也未阐明。
就蛋白降解机制而言,涉及炎症介质(例如细胞因子)和肿瘤源性因子(例如蛋白水解诱导因子PIF)活化的泛素—蛋白酶体途径是导致骨骼肌萎缩的主要蛋白质水解系统[1,15]。泛素—蛋白酶体依赖的蛋白质降解具有很高的可调控性:泛素链经E1泛素活化酶、E2泛素载体蛋白和E3泛素连接酶组成的反应序列结合至蛋白,其后26S蛋白酶复合物(20S与19S亚基)催化水解,将标记蛋白降解成为小肽。目前已知2种主要的肌肉特异性E3泛素连接酶肌肉环指基因1(muscle ring finger 1,MuRF1)和肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx/Atrogin-1)是泛素-蛋白酶体途径的重要组成部分,直接导致横纹肌分解和蛋白质合成抑制。促炎细胞因子,尤其是TNF-α和IL-6可调节这一过程。同时TNF-α也可经核因子-кB(nuclear factor-kappa B,NF-кB)依赖性途径刺激肌肉分解代谢。对于癌性恶病质骨骼肌蛋白质的合成机制,可能与其他肌肉消耗状况类似,也以雷帕霉素靶蛋白复合体1(mechanistic target of rapamycin complex 1,mTORC1)为中心,多种上游蛋白均可经mTOR介导而发挥作用,但由于其作为多因素综合征的特殊性,又往往表现出与理论不符的情况[1,16]。到目前为止,尚未确定究竟通过何种信号转导通路对骨骼肌蛋白质合成造成抑制。
由于癌性恶病质是多因素所导致的综合征,病理生理也非常复杂,使得治疗策略的复杂性成为必然。过去30年间,仅针对摄食量下降、炎症或蛋白质代谢紊乱的单一模式干预仅为癌性恶病质的治疗提供了非常有限的发展[17]:单一的抗细胞因子治疗对于癌性恶病质的防治无效[18-19];用于促进蛋白质合成的激素疗法因为可能刺激肿瘤生长而不得不尽量避免[20];药物除阿拉莫林之外也未能观察到对癌性恶病质的显著抑制作用[21]。近年来,结合药物、营养及运动等非药物治疗手段的恶病质多模式干预手段倍受关注,且目前认为此干预模式较传统单一模式干预效果更佳[22]。其中,运动结合营养支持的非药物干预模式倍受关注,但相关研究方兴未艾,目前尚无公认干预策略,作用机理也不清楚[23]。
正如美国运动医学会和美国心脏协会所倡导的 “Exercise is medicine”理念,运动所能带来的健康收益极为显著,在实践中,运动也常作为二级预防手段而用于疾病干预。在癌性恶病质的防治方面,规律有氧和抗阻运动均可提供助力[3,5,24]。其中,有氧训练的优势侧重于抗炎效应[5,8],而抗阻运动则在促进合成、抑制分解和削弱TNF-α水平等方面均具有良好作用[5,25]。就营养支持治疗而言,亮氨酸是必需氨基酸中最具有促进蛋白质合成功能的一种,适当补充可刺激食欲[26-27],且结合运动进行联合干预时可进一步优化其促合成代谢效应,增加骨骼肌蛋白质沉积[28]。笔者前期曾对自然衰老小鼠进行了中等强度有氧训练联合5%亮氨酸膳食干预或有氧、抗阻训练联合5%比例亮氨酸膳食干预,发现运动与亮氨酸2种干预手段之间产生了显著的协同效应,不仅促进骨骼肌蛋白质合成且能抑制其分解[10,29]。而与笔者研究组共同进行的另一项实验则发现,有氧运动结合亮氨酸抑制了肝脏TNF-α、IL-1β、IL-6等促炎细胞因子含量的增加[30],说明有氧训练结合亮氨酸可同时发挥促进蛋白合成、削弱降解、抑制炎症的作用。近年来的研究表明,将有氧与抗阻运动安排在相同训练时期但不同训练时段的训练模式可增强骨骼肌蛋白质合成反应[31],产生较单一有氧训练或抗阻训练更为显著的蛋白质正性平衡[32]、骨骼肌肥大及功能促进[33],且训练之后补充蛋白质可进一步提高蛋白质合成率[34]。本研究的结果也在一定程度上佐证了这一观点,凸显了运动训练干预与补充亮氨酸之间的良好交互效应,推测其可能通过协同促进的方式刺激癌性恶病质骨骼肌的蛋白质沉积。目前仅有的2项相关研究显示,Salom?觔o EM研究组给Walker 256荷瘤小鼠施加无负重游泳运动(30 min/d)、亮氨酸和谷氨酰胺干预10 d,研究结果表明游泳运动结合亮氨酸干预可最大程度地抑制肿瘤生长并促进蛋白质合成与瘦体重增长[11,35],进一步显示了运动结合亮氨酸干预可能具有防止癌性恶病质产生和增加的可能。本研究中,结合炎性细胞因子含量变化、蛋白质含量变化及体质量、湿重与肌力变化,推测运动结合亮氨酸干预对蛋白质沉积的影响可能是经由抑炎途径实现的,但具体的机制仍有待进一步研究来探明。
[14] KONOPKA A R, HARBER M P. Skeletal muscle hypertrophy after aerobic exercise training [J]. Exerc Sport Sci Rev, 2014, 42(2): 53.
[15] MARTINS T, VITORINO R, MOREIRA-GONCALVES D, et al. Recent insights on the molecular mechanisms and therapeutic approaches for cardiac cachexia[J]. Clin Biochem, 2014, 47(1-2): 8.
[16] EGERMAN M A, GLASS D J. Signaling pathways controlling skeletal muscle mass[J]. Crit Rev Biochem Mol Biol, 2014, 49(1): 59.
[17] SOLHEIM T S, LAIRD B J. Evidence base for multimodal therapy in cachexia [J]. Curr Opin Support Palliat Care, 2012, 6(4): 424.
[18] FEARON K, ARENDS J, BARACOS V. Understanding the mechanisms and treatment options in cancer cachexia[J]. Nat Rev Clin Oncol, 2013, 10(2): 90.
[19] KIR S, WHITE J P, KLEINER S, et al. Tumour-derived PTH-related protein triggers adipose tissue browning and cancer cachexia[J]. Nature, 2014, 513(7516): 100.
[20] FEARON K C, GLASS D J, GUTTRIDGE D C. Cancer cachexia: mediators, signaling, and metabolic pathways[J]. Cell Metab, 2012, 16(2): 153.
[21] TEMEL J S, ABERNETHY A P, CURROW D C, et al. Anamorelin in patients with non-small-cell lung cancer and cachexia (ROMANA 1 and ROMANA 2): results from two randomised, double-blind, phase 3 trials[J]. Lancet Oncol, 2016, 17(4): 519.
[22] FEARON K C. Cancer cachexia: developing multimodal therapy for a multidimensional problem[J]. Eur J Cancer, 2008, 44(8): 1124.
[23] WITARD O C, BAAL D.The interaction between nutrition and exercise for promoting health and performance[J]. Proc Nutr Soc, 2018, 77(1): 1.
[24] ALVES C R, DA CUNHA T F, DA PAIXAO N A, et al. Aerobic exercise training as therapy for cardiac and cancer cachexia[J]. Life Sci, 2015(125): 9.
[25] MURTON A J, GREENHAFF P L. Resistance exercise and the mechanisms of muscle mass regulation in humans: acute effects on muscle protein turnover and the gaps in our understanding of chronic resistance exercise training adaptation[J]. Int J Biochem Cell Biol, 2013, 45(10): 2209.
[26] ELEY H L, RUSSELL S T, TISDALE M J. Effect of branched-chain amino acids on muscle atrophy in cancer cachexia[J]. Biochem J, 2007, 407(1): 113.
[27] PETERS S J, VAN HELVOORT A, KEGLER D, et al. Dose-dependent effects of leucine supplementation on preservation of muscle mass in cancer cachectic mice[J]. Oncol Rep, 2011, 26(1): 247.
[28] DICKINSON J M, GUNDERMANN D M, WALKER D K, et al. Leucine-enriched amino acid ingestion after resistance exercise prolongs myofibrillar protein synthesis and amino acid transporter expression in older men[J]. J Nutr, 2014, 144(11): 1694.
[29] XIA Z, CHOLEWA J, ZHAO Y, et al. Hypertrophy-Promoting Effects of Leucine Supplementation and Moderate Intensity Aerobic Exercise in Pre-Senescent Mice[J]. Nutrients, 2016, 8(5): 246.
[30] 楊力源.亮氨酸结合有氧运动对衰老小鼠肝脏促炎细胞因子的影响[D].成都:成都体育学院,2014.
[31] 于洪军.论同期力量和耐力训练及其在竞技体育中的训练策略[J].体育科学,2014,34(2):18.
[32] DONGES C E, BURD N A, DUFFIELD R, et al. Concurrent resistance and aerobic exercise stimulates both myofibrillar and mitochondrial protein synthesis in sedentary middle-aged men [J]. J Appl Physiol, 2012, 112(12): 1992.
[33] MURACH K A, BAGLEY J R. Skeletal muscle hypertrophy with concurrent exercise training: contrary evidence for an interference effect[J]. Sports Med, 2016, 46(8): 1029.
[34] CAMERA D M, WEST D W, PHILLIPS S M, et al. Protein ingestion increases myofibrillar protein synthesis after concurrent exercise[J]. Med Sci Sports Exerc, 2015, 47(1): 82.
[35] SALOMAO E M, TONETO A T, SILVA G O, et al. Physical exercise and a leucine-rich diet modulate the muscle protein metabolism in Walker tumor-bearing rats [J]. Nutr Cancer, 2010, 62(8): 1095.
