新型骨显像剂99Tcm-HBIDP的制备与初步生物学性质
2012-01-04王立勤林建国南蓓蓓罗世能马海霞
王立勤,邱 玲,林建国,南蓓蓓,罗世能,马海霞,黄 洁
1.西北大学 化工学院,陕西 西安 710069;2.江苏省原子医学研究所,卫生部核医学重点实验室,江苏省分子核医学重点实验室,江苏 无锡 214063
放射性核素骨显像已成为临床诊断和研究骨质病变最为普遍的技术手段之一[1]。20世纪70年代中期,骨扫描代替了X射线用以研究骨质病变,它能够比X射线提早几个月探测到某些骨质病变的发生。Subramanian等[2]对99Tcm-MDP和其它99Tcm标记的骨显像剂进行了详细的对比,认为99Tcm-MDP用于骨显像效果最佳。然而99Tcm-MDP作为骨显像剂也存在不足之处,比如给药后2~6 h,骨扫描效果才比较好[3]。缩短给药后扫描等待时间可以减轻病人的负担,这就要求放射药物对骨质有更高的亲和力。在其后30多年里,科研工作者不断将双膦酸结构优化后进行99Tcm标记,以发展性能优异的新型骨显像剂[1,3-4]。
双膦酸以含P—C—P键为特征,侧链由R1和R2构成。改变两个侧链R1和R2的结构,极大地丰富了双膦酸的结构,为寻求更优秀的双膦酸提供了可能。侧链R1和R2决定了双膦酸的药理特性[5-7]。R1为羟基,提高了双膦酸对骨质的亲和力。R2的性质对于提高双膦酸抑制骨再吸收能力至关重要。R2为含氮氨烷基或含氮杂环、R1为羟基的双膦酸的治疗效果更好。帕米膦酸(pamidronate)的烷基链上有1个伯胺氮原子,其效能是不含氮原子的依替膦酸(etidronate)效能的10到100倍[6]。大多数的第三代双膦酸R2为含有1个或2个氮原子的杂环。唑来膦酸(1-羟基-2-(1H-咪唑-1-基)乙烷-1,1-双膦酸,Zoledronic acid)是目前综合治疗效果最佳的双膦酸,它的效能至少是帕米膦酸的100倍或者是依替膦酸的1 000倍[8]。
为了寻找新型品优双膦酸骨显像剂,本课题组进行了大量尝试,陆续制备了99Tcm标记的双膦酸,包括99Tcm-ZL[9]、99Tcm-MIDP[10]、99Tcm-EIDP[11]、99Tcm-PIDP[12]和99Tcm-EMIDP[13],探索了它们作为骨显像剂的可能性。结果表明,这些标记物有良好的生物学性质,注射药物后1~2 h可以给出清晰的全身兔骨显像,是潜在的骨显像剂。为了寻找新型性能更加优异的骨显像剂,本工作拟合成一种新型双膦酸,即1-羟基-2-(1-丁基-1H-咪唑-2-基)亚乙基-1,1-双膦酸(HBIDP),并用99Tcm进行标记,测定99Tcm-HBIDP的脂水分配系数和血浆蛋白结合率,比较99Tcm-HBIDP与99Tcm-ZL小鼠体内分布的差异。
1 实验部分
1.1 试剂和仪器
1-丁基咪唑(纯度为99%),上海邦成化工有限公司;其他试剂均为分析纯,无需提纯,可直接使用,国药集团上海化学试剂有限公司。
Yanaco MP-500熔点仪,日本岛津公司;Elementar Varil EL Ⅲ型元素分析仪,德国Elementar公司;TENSOR27型傅里叶变换红外光谱仪,德国Bruker光谱仪器公司;Waters Platform ZMD4000型质谱仪,美国Waters公司;Bruker DRX-500型核磁共振仪,德国Bruker光谱仪器公司;Waters 600型高效液相色谱仪,美国Waters公司;HPLC柱,SinoChrom ODS-BP,PN:E2117215-080108,4.6 mm×250 mm×10 μm,大连依利特分析仪器有限公司,Cd(Te)检测器,美国Perkin Elmer公司;PackardCobra型自动γ计数器,美国Victoreen公司。
ICR小鼠,18~20 g,上海斯莱克实验动物有限公司。
1.2 1-羟基-2-(1-丁基-1H-咪唑-2-基)亚乙基-1,1-双膦酸(6)(HBIDP)的合成
按图1所示,原料1-丁基咪唑(1)经五步反应,合成了目标化合物1-羟基-2-(1-丁基-1H-咪唑-2-基)亚乙基-1,1-双膦酸(6)。详细合成方法参见文献[14-15]。
图1 HBIDP的合成路线
1.3 99Tcm-HBIDP的制备
配体溶液的配制:将250 mg HBIDP加入到5 mL 0.02 mol/L NaOH溶液中使之溶解,其质量浓度为50 g/L,pH≈6。
SnCl2·2H2O溶液的配制:准确称量10 mg SnCl2·2H2O置于干净的西林瓶中,加入0.5 mol/L HCl 10 mL,将其溶解完全,其质量浓度为1 g/L。此溶液需现配现用。
向10 mL西林瓶中依次加入一定体积的50 g/L双膦酸钠盐溶液、一定体积的1 g/L SnCl2·2H2O盐酸溶液,一定量的Na99TcmO4溶液,再加入pH=6的磷酸盐缓冲溶液(PBS),控制总体积为2 mL,涡旋振荡器充分振荡混匀,室温(25±1)℃下反应一定时间即标记完毕。
1.4 标记率和放化纯的测定方法
1.5 最佳标记条件的选择
1.5.1pH值对放化纯的影响 向12个西林瓶中各加入100 μL 50 g/L HBIDP的钠盐溶液、100 μL 1 g/L SnCl2·2H2O的盐酸溶液、55.5 MBq新鲜淋洗的Na99TcmO4洗脱液,分别用pH为1至12的磷酸盐缓冲液将其定容至2 mL,涡旋混合器充分混匀后开始计时,室温(25±1)℃下反应20 min用TLC法测定各个体系的放化纯。
1.5.4配体用量对放化纯的影响 向10个西林瓶中分别加入含有2.0、2.5、3.0、3.5、4.0、4.5、5.0、6.0、8.0、10.0 mg HBIDP的钠盐溶液,再逐个加入100 μL 1 g/L SnCl2·2H2O的盐酸溶液,新鲜淋洗的Na99TcmO4洗脱液55.5 MBq,用pH=6的磷酸盐缓冲液将其定容至2 mL,涡旋混合器充分混匀后开始计时,室温(25±1)℃下反应20 min后用TLC法测定各个体系的放化纯。
1.5.5反应时间对放化纯的影响 向西林瓶中加入100 μL 50 g/L HBIDP的钠盐溶液,100 μL 1 g/L SnCl2·2H2O的盐酸溶液,新鲜淋洗的Na99TcmO4溶液(55.5 MBq),用pH=6的磷酸盐缓冲液将其定容至2 mL,涡旋混合器充分混匀后开始计时,室温(25±1)℃下反应,在30 min之内,每5 min取样1次测定不同时间下的放化纯。
1.6 脂水分配系数
将磷酸盐缓冲液与正辛醇超声振荡混合,使两相互相饱和后分离贮存备用。
取2支放敏管,编为1号与2号,向二者均加入饱和的1.0 mL正辛醇和1.0 mL磷酸盐缓冲溶液,其中向1号管所加磷酸盐缓冲液pH=7.0,向2号管所加磷酸盐缓冲液pH=7.4,然后向两支管中均加入100 μL99Tcm-HBIDP溶液(约1.85 MBq),室温下涡旋混合器混合振荡2 min,然后离心5 min(4 000 r/min),以保证两相完全分离,两相各取100 μL测其放射性计数。计算脂水分配系数lgP=lg(有机相放射性计数/水相放射性计数)。
1.7 血浆蛋白结合率
分别配制质量浓度为100 g/L和250 g/L的三氯乙酸;取新鲜肝素抗凝血浆2 mL(江苏省原子医学研究所附属江原医院提供),于4 ℃冰箱保存备用。
取3支放敏管,各加入100 μL血浆和100 μL99Tcm-HBIDP溶液(约55.5 kBq),37 ℃水浴孵育2 h。给每管加入250 g/L三氯醋酸1 mL,以使血浆蛋白沉淀。上层清液和沉淀离心分离5 min(2 000 r/min),收集上清液。向沉淀中加入100 g/L的三氯醋酸1 mL,涡旋混合器混匀,离心5 min(2 000 r/min),收集上清液。此步骤重复操作3次。分别测定沉淀的放射性计数和上清液的放射性计数,计算血浆蛋白结合率=沉淀物放射性计数/(沉淀物放射性计数+上清液放射性计数)×100%。
1.8 99Tcm-HBIDP在小鼠体内分布实验
ICR小鼠35只,随机分为7组,每组5只,每只小鼠尾静脉注射200 μL新配制的99Tcm-HBIDP(约7.4 MBq),分别于注射后5、10、15、30、60、120、240 min时断颈处死,先用一次性定量采血管取200 μL颈动脉血液,后解剖取心、肝、脾、肺、肾、大腿骨、关节、肌肉、脑等组织,称重,用γ计数仪测定放射性计数,同时测定标准液的放射性计数,分别计算各脏器每克组织的摄取量(%ID/g)。
2 结果与讨论
2.1 HBIDP的合成
HBIDP的合成反应前半步属于膦酰化反应,三氯化磷对于反应的顺利进行十分必要,没有三氯化磷反应不能进行[16]。该反应是一个强烈的放热反应,同时放出大量氯化氢气体。当三氯化磷加入速度过快时,体系内温度快速升高,反应异常剧烈,瞬间产生大量气体,容易造成危险,同时造成产物产率低下。通过控制三氯化磷的滴加速度和加料时油浴温度(70~80 ℃),既可以使反应较快进行,又不致因反应剧烈放热和放出气体使体积迅猛膨胀而发生危险,从而保证了反应平稳顺利进行。由于该反应是非均相反应,产率一般在40%~60%[7]。据文献[17]报道,若用甲磺酸做溶剂,整个反应过程保持均相反应,收率可达到90%,但后处理不如用氯苯简单方便,且后者更廉价。
本实验所得目标物HBIDP,收率:50.0%;熔点:140~145 ℃;元素分析:实测值(理论值)C 32.89%(32.94%),H 5.61%(5.53%),N 8.49%(8.54%);IR(KBr,cm-1):3 155(s),2 962(s),2 875(s),2 318(br,w),1 598(m),1 520(m),1 467(w),1 164(s),985(s);ESI-MS,m/z(%):329(100)=M+1;1H NMR(400 MHz,D2O,δ):7.31(d,1H,ring-H),7.26(d,1H,ring-H),4.21(t,2H,N—CH2),3.58(t,2H,JH-P=12 Hz,CH2C—P),1.81(m,2H,N—CH2CH2),1.32(m,2H,—CH2CH3),0.91(t,3H,—CH3)。
2.2 99Tcm-HBIDP的放射化学纯度
图2 Na99TcmO4(a)和99Tcm-HBIDP(b)的HPLC谱图分析
2.3 最佳标记条件
图3 pH对99Tcm-HBIDP放化纯的影响
2.3.1pH值对放化纯的影响结果 pH对放化纯的影响示于图3。从图3可以看出,放化纯对体系pH值变化很敏感。pH≈6时,放化纯最高,达到95%以上;pH大于7或小于2时,放化纯急剧下降,并小于90%。氯化亚锡在中性水溶液易分解生成沉淀,与碱作用生成水和氧化物沉淀,但碱量过剩时,生成能溶解的亚锡酸盐,均会使还原性大大降低甚至消失。但酸性太强时,放化纯也会明显下降。这可能是因为强酸性条件下,大量质子存在抑制了配位反应的发生。据此,选择pH=6作为标记反应条件。
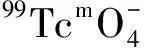
图4 氯化亚锡用量对99Tcm-HBIDP放化纯的影响
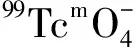
图5 活度对99Tcm-HBIDP放化纯的影响
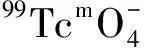
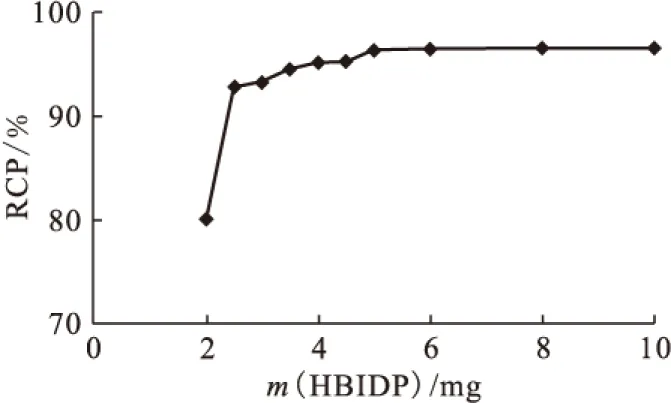
图6 配体用量对99Tcm-HBIDP放化纯的影响
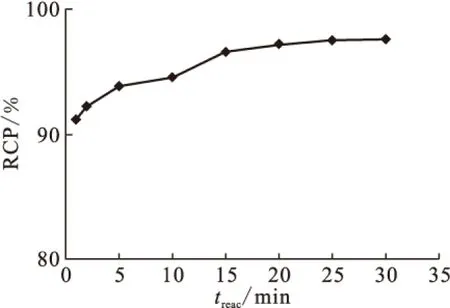
图7 反应时间对99Tcm-HBIDP放化纯的影响
2.3.5反应时间对放化纯的影响 反应时间(treac)对放化纯的影响示于图7。从图7可以看出,时间对放化纯的影响较小。1 min内放化纯已达90%,说明此反应十分迅速。15 min时RCP已达95%,时间再延长,标记率略有上升。为了缩短制备放射药物的时间,15 min已经可以满足使用要求。
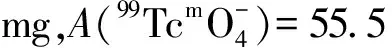
2.4 99Tcm-HBIDP的体外稳定性
标记物良好的体外稳定性是放射性药物能被应用的前提。将99Tcm-HBIDP置于室温(25±1)℃下,分别于标记后1、2、3、4、5、6 h时取样测定放化纯。其结果示于图8。由图8可知,6 h时放化纯大于90%,这说明99Tcm-HBIDP的体外稳定性较好,满足使用要求。
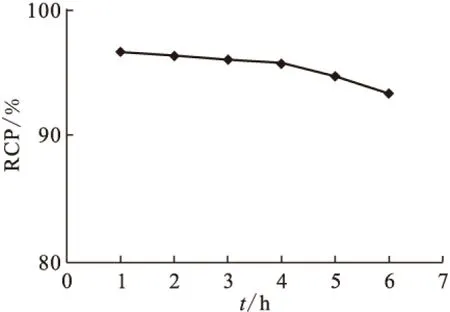
图8 99Tcm-HBIDP的体外稳定性
2.5 99Tcm-HBIDP的脂水分配系数
99Tcm-HBIDP在pH为7.0和7.4时,脂水分配系数lgP分别为-2.17和-2.28,表现出很强的亲水性。对骨显像药物而言,亲水性越好,单位质量的药物在软组织中的吸收将会相对下降,靶向组织(骨骼)中的摄取相对增加,有利于发挥药物的显像作用。
2.6 99Tcm-HBIDP的血浆蛋白结合率
99Tcm-HBIDP的血浆蛋白结合率为(31.41±1.25)%。99Tcm-ZL血浆蛋白结合率为17.40%[9]。前者血浆蛋白结合率高于后者,可能是分子中含有亲脂性丁基,增加了其与蛋白的结合能力,从而使其血浆蛋白结合率增大。
2.7 99Tcm-HBIDP在小鼠体内分布实验
99Tcm-HBIDP小鼠体内分布实验结果列于表1。从表1可以看出,99Tcm-HBIDP主要集中在骨、关节和肾中,并且在骨中有高度选择性的摄取。99Tcm-HBIDP在注射5 min后,在骨和关节中的摄取分别达到了(4.76±0.37)%ID/g和(11.55±0.85)%ID/g,并且逐渐增加,在30 min时达到最高,分别为(9.07±0.97)%ID/g和(30.12±2.36)%ID/g。随着时间的延长,其在骨和关节中的吸收有所下降,但是在240 min时仍分别高达(6.83±0.14)%ID/g和(18.96±1.87)%ID/g,而药物在心、肝、脾、肺等器官组织中已经基本清除完毕。99Tcm-HBIDP在肾脏和血液中的摄取随时间延长而快速下降,表明此药物主要经过肾脏代谢,经由泌尿系统排出体外。随着时间的延长,骨摄取与心、肝、脾、肺、血液中摄取的比值快速升高,有利于降低显像本底,提高骨显像质量。图9给出了99Tcm-HBIDP和99Tcm-ZL(其小鼠分布数据可参考文献[9])不同时刻骨、心、肝和脾器官组织中的摄取值的对比。前者在骨中摄取60 min内高于后者。在240 min内99Tcm-HBIDP在心、肝和脾器官组织中的摄取远低于99Tcm-ZL,表明99Tcm-HBIDP对这些重要脏器的伤害较小。总之,99Tcm-HBIDP有望成为新型骨显像剂。
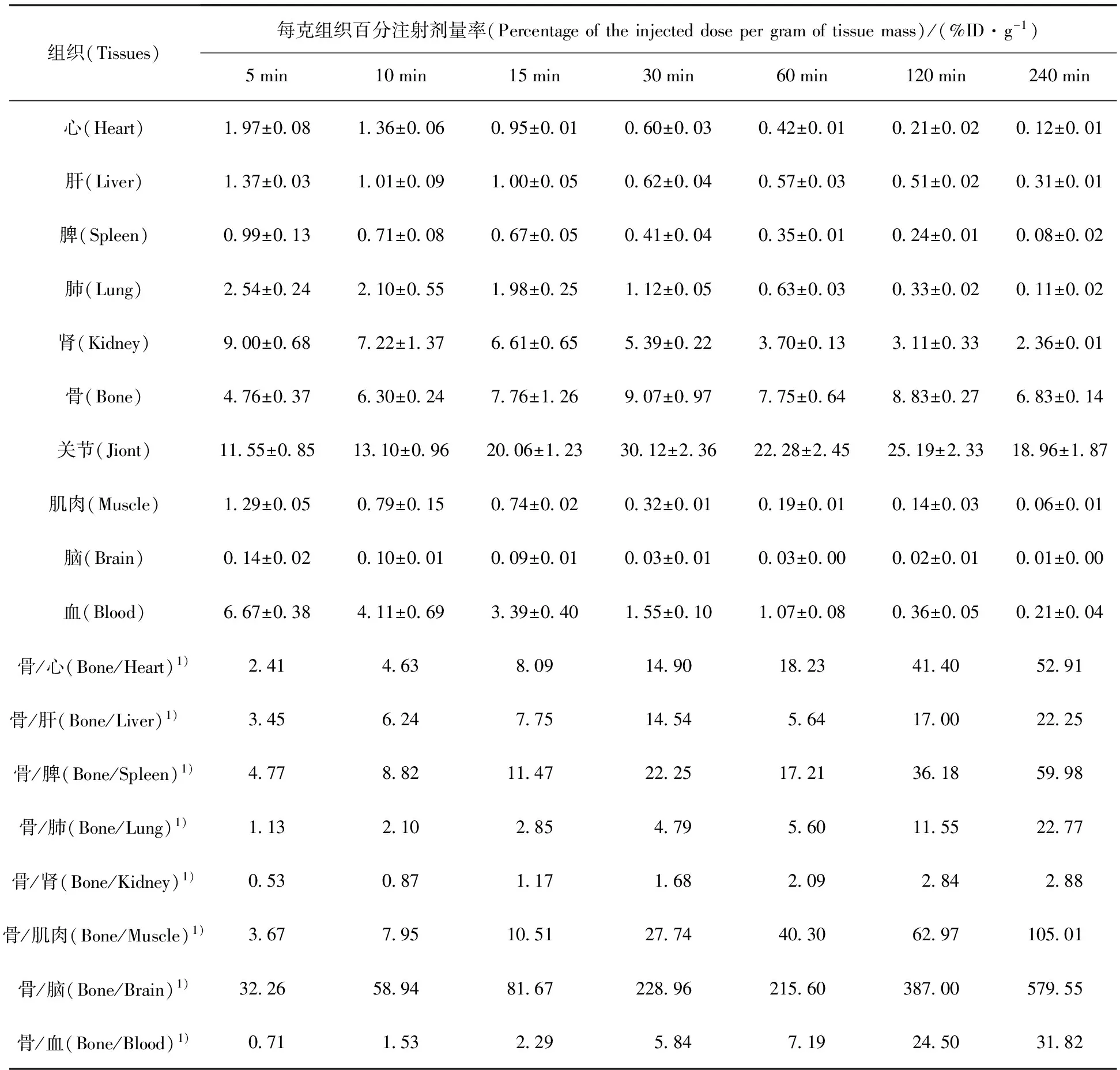
表1 99Tcm-HBIDP小鼠体内分布
注(Note):1)量纲为1(Unit is 1)
2)n=5
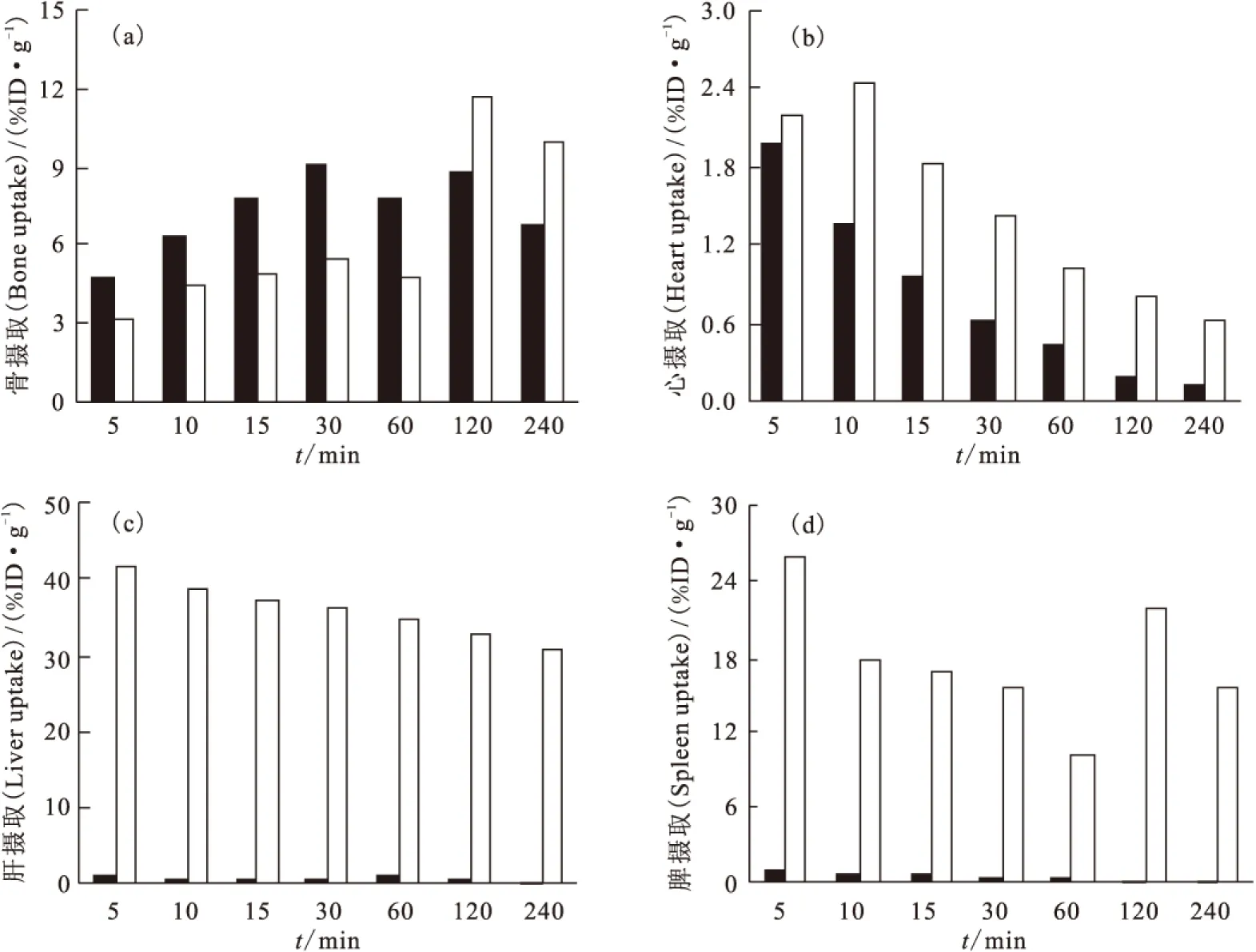
图9 99Tcm-HBIDP和99Tcm-ZL不同时刻的小鼠体内分布
3 结 论
[1]Vbrbeke K,Rozenski J,Cleynhens B,et al.Deve-lopment of a Conjugate of99Tcm-EC With Aminomethylenediphosphosphonate in the Search for a Bone Tracer With Fast Clearance From Soft Tissue[J].Bioconjugate Chem,2002,13 (1): 6-22.
[2]Subramanian G,Mcafee J G,Blair R J,et al.Technetium-99m-Methylene Diphosphonate-A Superior Agent for Skeletal Imaging: Comparison With Other Technetium Complexes[J].J Nucl Med,1975,16 (8): 744-755.
[3]Ogawa K,Mukai T,Inoue Y,et al.Development of a Novel99Tcm-Chelate-Conjugated Bisphosphonate With High Affinity for Bone as a Bone Scintigraphic Agent[J].J Nucl Med,2006,47 (12): 2 042-2 047.
[4]Fogelman I,Pearson D W,Bessent R G,et al.A Comparison of Skeletal Uptakes of Three Diphosphonates by Whole-Body[J].J Nucl Med,1981,22: 880-883.
[5]Russell R G G,Croucher P I,Rogers M J.Bisphosphonates: Pharmacology,Mechanisms of Action and Clinical Uses[J].Osteoporosis Int Suppl,1999,2: S66-80.
[6]Russell R G G,Rogers M J.Bisphosphonates: From the Laboratory to the Clinic and Back Again[J].Bone,1999,25 (1): 97-106.
[7]Widler L,Jaeggi K A,Glatt M.Highly Potent Geminal Bisphosphonates.From Pamidronate Disodium (Aredia)to Zoledronic Acid (Zometa)[J].J Med Chem,2002,45 (17): 3 721-3 738.
[8]Smith M R.Osteoclast Targeted Therapy for Prostate Cancer: Bisphosphonates and Beyond[J].Urol Oncol-Semin Ori,2008,26: 420-425.
[9]Lin Jiangguo,Qiu Ling,Cheng Wen,et al.Preparation andinVivoBiological Investigations on a Novel Radioligand for Bone Scanning: Technetium-99m-Labeled Zoledronic Acid Derivative[J].Nucl Med Biol,2011,38(5): 619-629.
[10]罗世能,王洪勇,谢敏浩,等.99Tcm- MIDP 的制备及其生物学分布[J].中华核医学杂志,2005,25(6):341-343.
[11]牛国塞,罗世能,严孝红,等.99Tcm-EIDP的制备及生物学分布[J].核技术,2008,31(9):698-701.
[12]Chen Chuanqing,Luo Shineng,Lin Jianguo,et al.Preparation and Biodistribution of99Tcm-PIDP as Bone Imaging Agent[J].Nucl Sci Technol,2009,20 (5): 302-306.
[13]Lin Jianguo,Luo Shineng,Chen Chuanqing,et al.Preparation and Preclinical Pharmacological Study on a Novel Bone Imaging Agent99Tcm-EMIDP[J].Appl Radiat Isot,2010,68: 1 616-1 622.
[14]南蓓蓓,邱玲,林建国,等.两种新型1-烷基咪唑类双膦酸的合成和表征[J].化学试剂,33(11):971-974.
[15]Guo Xuehua,Luo Shineng,Wang Hongyong,et al.Study on the Preparation and Biodistribution of99Tcm-HMIBP[J].Nucl Sci Tech,2006,17 (5): 285-288.
[16]Prentice J B,Quimby O T,Grabenstetter R J,et al.Interaction of Acylating Agents and Phosphorus (Ⅲ)Sources.I.Intermediacy of Condensed Species in the Formation of Ethane-1-Hydroxy-1,1-Diphosphonic Acid[J].J Am Chem Soc,94 (17): 6 119-6 124.
[17]Kieczykowski G R,Jobson R B,Melillo D G.Preparation of (4-Amino-1-Hydroxybutylidene)Bisphosphonic Acid Sodium Salt,MK-217(Alendronate Sodium).An Improved Procedure for the Preparation of 1-Hydroxy-1,1-Bisphosphonic Acids[J].J Org Chem,1995,60 (25): 8 310-8 312.
