PCR-DGGE对新生儿坏死性小肠结肠炎肠道菌落结构及其动态性研究
2012-01-03郑树芳徐艳珍余加林
郑树芳,徐艳珍,艾 青,余加林
(重庆医科大学附属儿童医院新生儿科/儿童发育疾病研究省部共建教育部重点实验室/儿科学重庆市重点实验室/重庆市儿童发育重大疾病诊治与预防国际科技合作基地 400014)
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是新生儿特别是早产儿的急腹症,临床以腹胀、呕吐、便血、严重休克为表现,X线片检查以肠壁囊样积气为特征。本病在国内的病死率约10%~50%,在美国病死率足月儿为5%,早产儿特别是体质量小于1 000 g的患儿可高达50%[1-2]。NEC是多因素的疾病,细菌感染是其中一个不可缺少的致病因素。有研究表明,NEC尚未发生在无菌的动物模型上[3]。也有假说表明新生儿肠道异常细菌的定植是NEC发生的一个重要因素,特别是在生后8~10 d的新生儿的肠腔内厌氧菌落开始定植生长[4]。但目前国内外对NEC肠道细菌感染的细菌成分和动态性变化尚无清晰的了解。传统方法学是采用培养技术来研究肠道微生态。据估计肠道内有60%~80%的细菌是不可培养或者难以培养的[5],远远低估了细菌的多样性,不能满足现在研究的需要。DGGE是通过对不同序列的DNA片段在不同浓度的变性剂下发生变性来进行分离,能够有效地克服传统培养法分析微生物菌落的不足。本实验采用PCR-DGGE技术来研究NEC肠道微生态组成和动态变化,为NEC疾病的发病机制和临床防治提供细菌学理论基础。
1 材料与方法
1.1实验对象 从重庆市儿童医院新生儿病房2009年8月至2009年12月共收治32例,NEC组和对照组各16例;其中NEC组按照临床诊断标准:临床症状(腹胀、呕吐、腹泻、血便等),体格检查(腹胀、肠鸣音减弱等),大便常规加隐血实验(+)以及X线片检查情况(有肠道动力学改变、肠壁积气、门静脉积气、气腹、膈下游离气体)之一;所有纳入的病例均有大便隐血(+)及X线片检查(+)。根据国际Walsh和Kliegman的BELL对于NEC疾病的分期标准[6],收集的NEC病例均为Ⅰ期(轻度)。对照组是基础疾病,临床特征尽量匹配,见表1。收集实验对象入院后不同时期的粪便标本。
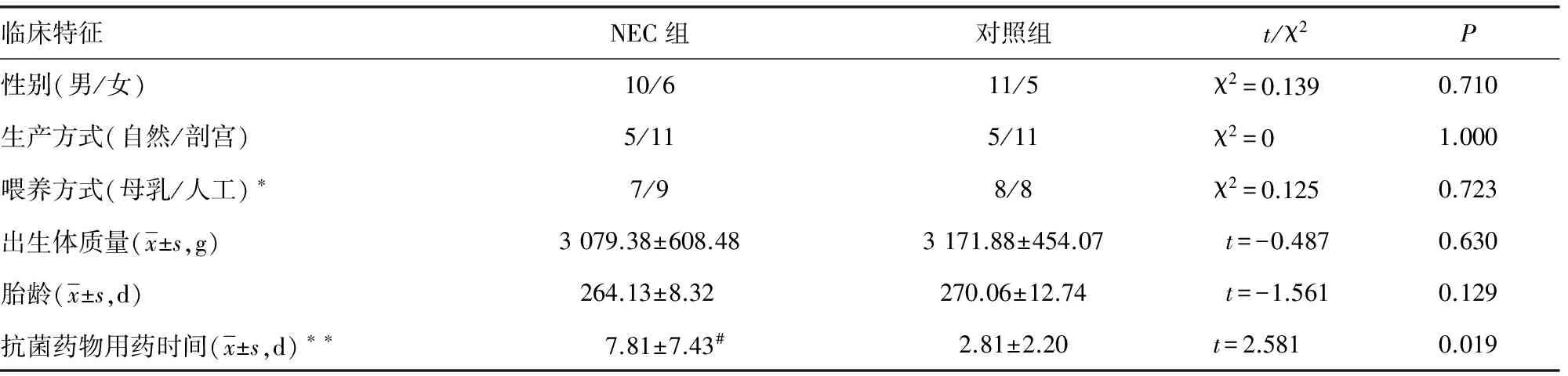
表1 NEC组和对照组的临床资料比较(n=16)
1.2标本的准备和保存,粪便细菌DNA的提取 本实验收集的新生儿新鲜粪便0.22 g,保存在-70 ℃冰箱。大便细菌DNA的提取参照QIAamp Stool Mini Kit(QIAGEN,德国)的说明书,总菌DNA提取后用可见紫外分光光度仪测定DNA样品浓度和纯度,1.5%琼脂糖凝胶电泳检测DNA完整性。
1.3对于粪便细菌DNA进行PCR扩增 采用引物扩增16S rDNA v3高变区,引物为带有“GC”帽的357F-GC和518R,其中V357F-GC(5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3′),518R(5′-ATT ACC GCG GCT GCT GG-3′)由上海英骏生物工程技术服务有限公司合成。PCR扩增体系(50 μL):上下游引物各2 μL(10 μmol/L),DNA模板 5 μL,premix 25 μL(宝生物提供),灭菌去离子水补充至50 μL。反应条件:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环,72 ℃延伸5 min。1.5%琼脂糖电泳检测PCR产物扩增效果。
1.4粪便细菌DNA进行PCR-DGGE,割胶回收DNA进行测序 采用BIO-RAD Dcode Universal Mutation System DGGE电泳系统进行DGGE分析,聚丙烯酰胺凝胶浓度是8%,变形梯度从上到下采用35%~65%;上样量为25 μL。其运行条件是:1×TAE电泳缓冲液,60 ℃电泳条件下,85 V,16 h。电泳完毕后, SYBR GREEN Ⅰ染色30 min。将染色后的凝胶用Bio-RAD的GELDOC-2000凝胶影响分析系统拍照;在BenchTop 3 UV紫外透射仪下进行优势条带割胶,回收细菌DNA。进行无帽PCR扩增,将其产物送往华大基因测序,测序结果于NCBI上进行Blast(http://www.ncbi.nlm.nih.gov/BLAST)比对分析。
1.5统计学处理 实验病例的数据使用SPSS17.0统计软件分析,其中胎龄、出生体质量、抗菌药物用药时间的数据符合正态分布,采用t检验;性别、生产方式、喂养方式数据为计数资料,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1NEC组和对照组的临床资料 见表1。
2.2肠道总菌DNA的PCR-DGGE图谱显示 不同泳道间条带分布模式有一定的相似,但某些条带亮度、粗细差异也有比较明显的差异性,说明对应其在DGGE胶上的密度大小是不同的。条带比较粗亮,说明细菌密度大;条带比较细浅则细菌密度小。DGGE条带的数量基本体现了肠道细菌种群的数量,而条带的亮度则反映该种细菌数量的多少(图1)。从图1可以看出,共检测到数量不等的16S rDNA V3区条带,每个泳道的条带数量都较多且不等,充分显示出新生儿肠道细菌的多样性(表2)。
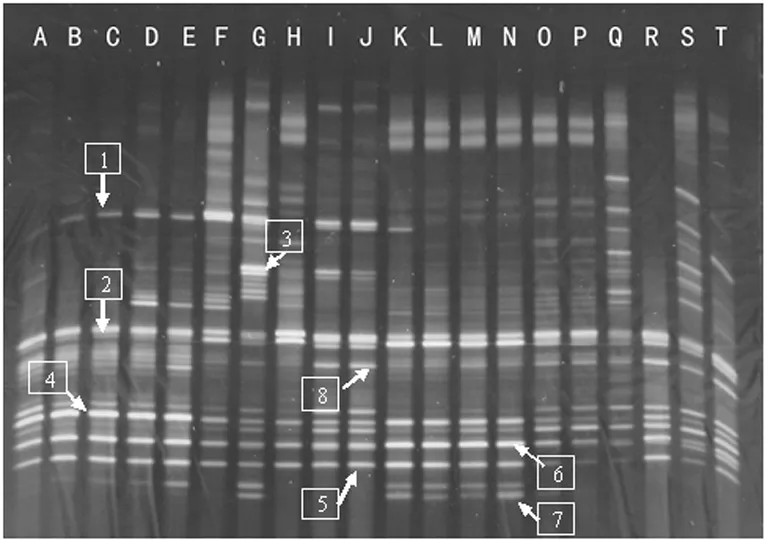
A~T列代表图中20个样本泳道,其中A~E代表对照组1号的连续不同时间的结果,F~J代表着NEC1号,K~N代表对照组2号,O~T代表NEC2号。
图1对照组与NEC组的DGGE图
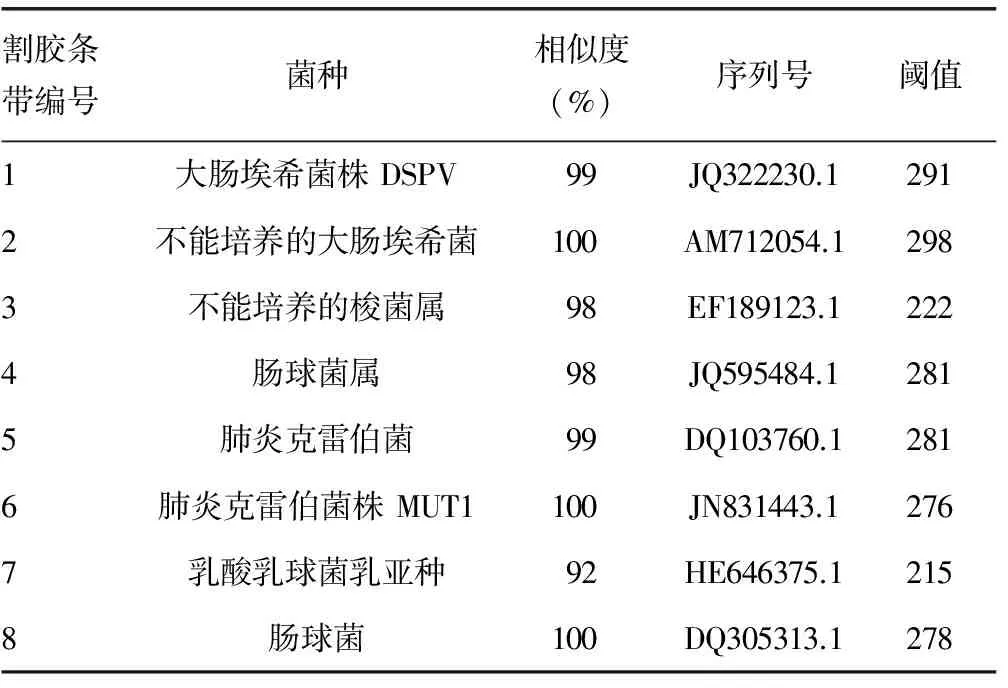
表2 DGGE胶回收的优势细菌DNA测序比对结果
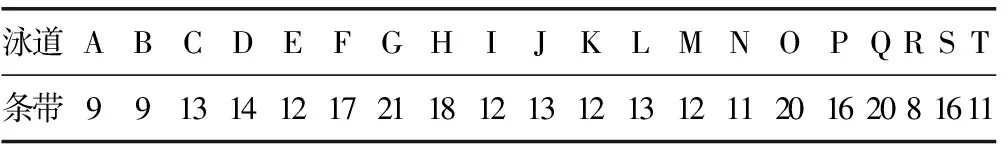
表3 DGGE图谱中不同泳道在quantity one软件可检测的条带数即丰富度(S)
粪便肠道细菌Shannon指数衡量细菌的多样性,细菌的多样性代表细菌菌种的多少和均匀度。菌种种类越多,各个种的数量分布越均匀,菌种多样性指数越大。实验后,对DGGE 图谱进行软件分析后进行Shannon指数计算。结果如表3及图2。统计软件分析对照组和NEC组的丰富度和多样性指数,如表4,两组间比较差异有统计学意义(P<0.05)。
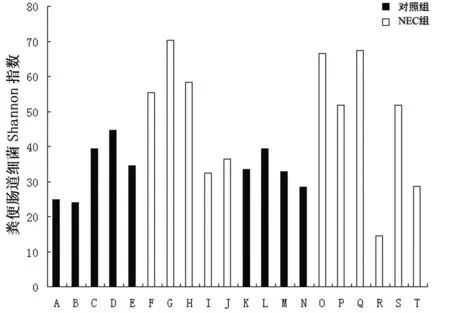
图2 DGGE多样性分析的Shannon指数(H′)

图1表明,对照组的肠道菌种动态性分布比较均一,多样性指数较小,而NEC组在开始发病初期,多样性指数明显高于对照组,分布不均。随着疾病的治疗进展,多样性指数有明显的降落;随着疾病的恢复,多样性指数缓慢回升。所以,作者发现NEC疾病初期,细菌多样性指数较对照组高,肠道细菌菌种多样性更为明显。
2.3对照组与NEC组的DGGE图片分析 得出同上趋势的有13/16(81.25%)。3/16(18.75%)趋势不明显,Shannon指数差异不大。对照组和NEC组肠道细菌种属区别不大(表5)。
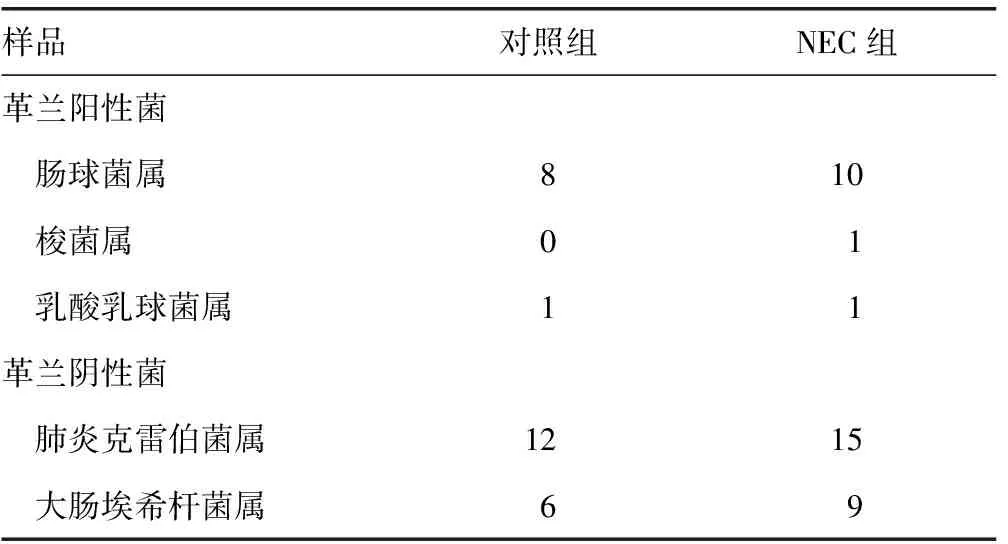
表5 对照组与NEC组检测到的细菌情况(n=16)
3 讨 论
正常胎儿的消化道是无菌的。在分娩过程中和以后,母亲和周围环境的微生物选择性地定植在新生儿的消化道里,直到一个密集的、复杂的肠道微生态的形成。异常的肠道细菌定植和肠道微生态菌落的紊乱会严重影响新生儿阶段的健康,导致各种疾病的发生、发展。另外,肠道菌群不同还会影响宿主对于药物的反应不同,根据药理代谢组学研究,肠道菌群结构的差异产生的宿主代谢表型可以用于预测宿主对于药物的不同反应[7]。
新生儿NEC是新生儿期间最严重的肠道系统的疾病之一。任何胃肠道生态系统的异常都可能导致发生NEC[8]。国内外研究均表明,用肠道益生菌制剂干预能有效地减少NEC的发病率,也能明显减少发病后的NEC的严重程度和缩短病程时间,减少病死率[9-12]。现在推测,胃肠道共生细菌的紊乱和致病细菌的定植是NEC的发病机制之一。但以前研究中使用细菌培养并没能有效地解释NEC中细菌感染的发病机制。据报道,80%的人类结肠菌群是传统培养法无法检测到的[13]。
因此,本研究用分子生物学技术PCR扩增几乎所有细菌(包括能够培养和目前不能培养的细菌)的16S-rDNA片断,然后通过DGGE区分不同的菌种和相对数量,来研究NEC疾病发展中肠道细菌组成及其动态发展。本研究表明对照组的患儿随着基础疾病的治疗,肠道菌落呈动态性的变化,条带数和Shannon指数均较为均一分布,呈稳态增多的趋势,较符合正常新生儿肠道微生态的发展规律。而大部分NEC组的患儿在发病初期的条带数和Shannon指数明显高于对照组,分布明显不均,在治疗过程中,有跳跃式的降低,在疾病恢复期,又有所回升,呈大起大落后缓升趋势。根据割胶回收后测序的结果显示,NEC组和对照组的肠道菌属区别并不大,并没有发现特定的细菌与NEC发病相关。因此,推测NEC发病中特定相关的致病菌并非其发病的主要原因;原本平衡的肠道菌落因为某些危险因素而导致肠道菌落数量比例失衡是NEC发病机制中的重要因素,这与国外的研究相一致。Mshvildadze等[14]发现NEC组与对照组的肠道微生态并没有显著的区别,肠道菌落紊乱是其发病的重要原因,但同时也报道NEC较对照组在发病初期,肠道细菌多样性降低,跟本研究中的结论相反。本研究中NEC组的抗菌药物使用时间比对照组长(P<0.05),抗菌药物为广谱抗菌药物加上二代头孢,可能导致肠道细菌紊乱。测序结果发现NEC肠道细菌跟对照组均以肺炎克雷菌属、大肠埃希菌属、肠球菌属为优势菌群,偶在某些个体中发现梭菌属和乳球菌属,两组优势菌群无太大差异。这些菌属均在国外研究NEC的相关文献中提及过。另外,国外也报道过NEC发病可能与产气荚膜梭菌属、葡萄球菌属相关,这个可能与本实验纳入的NEC的发病程度轻、地区差异、试验检测手段的不同有关。产气荚膜梭菌属可能与NEC的肠段坏死、肠壁间积气有关,在NEC发病的分期中属于Ⅲ期(重度)。当然,不同国家不同地区的肠道菌落存在区域性,这与饮食习惯、地域环境、人种均有关。同时,目前DGGE灵敏度存在一定局限,只能检测粪便中大于1%的优势菌种[15]。
新生儿出生后,肠道微生态是个动态的复杂过程,与个体、环境、喂养等相关,每个新生儿的肠道菌落均呈个体发展,这些无疑是新生儿期间肠道微生态研究的一个难点所在。PCR结合DGGE是目前观察肠道菌落变化的有效手段。本研究因为早产儿例数不足以比较早产儿跟足月儿NEC的肠道菌落是否存在差异性;纳入的患儿均为Ⅰ期NEC,未能深入观察不同发病程度的患儿间是否也存在肠道菌种的差异。后期实验还可深入观察NEC发病的各危险因素是否导致肠道微生态的规律性的差异;肠道细菌的代谢与肠道黏膜屏障和肠道免疫的相互作用等。另外,DGGE只能粗略的半定量,后期可以结合q-PCR更为准确地评估所测到的菌种数量的差异,探讨不同菌种对于疾病发展的可能作用,对于NEC的患儿肠道菌落整体更为清晰的了解,指导继续深入研究;同时,肠道细菌作为一个潜在的药物靶点,也为今后的临床个性化治疗方案提供新的研究方向。
[1]Yost CC.Neonatal necrotizing enterocolitis:diagnosis,management,and pathogenesis[J].J Infus Nurs,2005,28(2):130-134.
[2]Kitterman JA,Rudolph CD,Rudolph AM,et al.Rudolphis pdiatrics[J].Edzist Apleton Cang stamfor,2003,21(2):140-143.
[3]Morowtz MJ,Poroyko V,Caplan M,et al.Redefining the role of intestinal microbes in the pathogenesis of necrotizing enterocolitis[J].Pediatrcs,2007,125(4):777-785.
[4]Claud EC,Walker WA.Hypothesis:inapprppriate colonization of the premature intestine can cause neonatal necrotizing enterocolitis[J].FASEB J,2001,15(18):1398-1403.
[5]Suau A.Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut[J].Appl Environ Microbiol,1999,65(21):4799-4807.
[6]Walsh MC,Kliegman RM.Necrotizing enterocolitis:treatment based on staging criteria[J].Pediatr Clin N Am,1986,33(1):179-201.
[7]Clayton TA.Pharmaco-metabonomic phenotyping and personalized drug treatment[J].Nature,2006,440(7087):1073-1077.
[8]McCracken VJ,Lorenz RG.The gastrointestinal ecosystem:a precarious alliance among epithelium,immunity and microbiota[J].Cell Microbiol,2001,3(1):1-11.
[9]Lin HC,Su BH,Chen AC,et al.Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants Pediatrics[J].2005,115(1):1-4.
[10]Dani C,Biadaili R,Bertini G,et al.Probiotics feeding in prevention of urinary tract infection,bacterial sepsis and necrotizing enterocolitis in preterm infants a prospective double-blind study[J].Biol Neonate,2002,82(2):103-108.
[11]宋朝敏,王红,吴斌.益生菌与新生儿坏死性小肠结肠炎[J].中国微生态学杂志,2005,17(6):479-480.
[12]庄小原,李联桥,高璇璇,等.坏死性小肠结肠炎早产儿病因及微生态制剂预防作用[J].实用儿科临床杂志,2007,22(18):1392-1393.
[13]Eckburg PB,Bik EM,Bernstein CN,et al.Diversity of the human intestinal microbial flora[J].Science,2005,308(5728):1635-1638.
[14]Mshvildadze M,Neu J,Shuster J,et al.Intestinal microbial ecology in premature infants assessed with non-culture-based techniques[J].J Pediatr,2010,156(1):20-25.
[15]Muyzer G,de Waal EC,Uitterlinden AG.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16s rRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
