乌司他丁抑制人乳腺癌细胞的侵袭和转移及其分子机制*
2012-01-03崔晓江孙治君
王 宁,崔晓江,孙治君△
(1.重庆医科大学附属第二医院三腺外科 400010; 2.外科系,女性癌症研究中心/塞缪尔-奥斯钦综合癌症研究所/塞德斯-辛奈医学中心,美国,加利福尼亚州,洛杉矶 90048)
乙酰肝素酶(Heparanase,Hpse)是一种内源性-β-D-葡糖苷酶,通过裂解硫酸肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)中的硫酸乙酰肝素(heparan sulfat,HS)侧链降解细胞外基质(extracellular matrix,ECM)和基底膜(basilar membrane,BM),加快肿瘤细胞的侵袭和转移。透明质酸酶(hyaluronidase,Hyase)可以降解透明质酸(hyaluronic acid,HA)为寡聚透明质酸(OligσHA)。CD44为HA细胞表面受体,透明质酸酶和分解的透明质酸片段可以通过CD44受体影响肿瘤细胞的增殖迁移和血管形成,在肿瘤发展及转移中起重要作用[1]。乌司他丁(Ulinastatin,UTI)是一种蛋白酶抑制剂,有抑制各种酶活性的作用,常用于重症胰腺炎的治疗。本课题组前期研究显示乌司他丁能抑制肿瘤细胞增殖、侵袭和转移,促进细胞凋亡,同时可增强抗肿瘤药物的效果[2-3]。CD44v6是CD44的一种变异体,本实验主要通过测定乌司他丁对乙酰肝素酶、1型透明质酸酶和HA受体CD44v6的表达影响探讨其抑制乳腺癌细胞侵袭及转移的分子机制。
1 材料与方法
1.1主要实验材料及试剂 乳腺癌MCF-7(ER阳性)及MDA-MB-231(ER阴性)2个细胞系由重庆医科大学病理教研室免费提供。胎牛血清及RPMI-l640购自浙江省杭州四季青生物工程材料有限公司。Heparanase兔抗人抗体购自美国Santa公司,Hyaluronidase-1及CD44v6鼠抗人单克隆抗体均购自美国Abcam公司,辣根过氧化物酶标记山羊抗兔lgG抗体购自北京博奥森公司。泰索帝(TXT)购自杭州赛诺菲安万特民生制药公司,乌司他丁购自广东天普生化医药股份有限公司,药物浓度分别配成100×血浆峰浓度(peak plasma concertration,PPC)备用。实验使用药物浓度参考文献:乌司他丁分别为 400、800、1 600 U/mL 3个浓度组,泰索帝3.7 μg/mL。
1.2细胞的培养及传代 2个乳腺癌细胞系的细胞分别置于25 cm2玻璃培养瓶培养,瓶内均加入RPMl-l640培养液4 mL(包括10%胎牛血清),置于37 ℃、5.0%CO2培养箱中培养。细胞处对数生长期(细胞长满培养瓶底面积约80%以上)时传代培养。传代:弃培养液,PBS液洗涤瓶底2次并弃液,加入0.25%的胰酶1 mL消化1 min后吸管吸掉胰酶,继续消化2~3 min,加1 mL RPMl-1640液停止消化后吹打收集细胞,离心,分装培养瓶后各加入RPMl-l640培养液,置培养箱中继续培养。
1.3细胞实验分组及给药 培养传代后处于对数生长期的MCF-7及MDA-MB-231细胞分别分为5组(具体细胞量根据实验需求)并最终调节加药浓度:空白对照组、UTI低剂量组(400 U/mL)、UTI中剂量组(800 U/mL)、UTI高剂量组(1 600 U/mL)、UTI联合TXT用药组(UTI 800 U/mL+TXT 3.7 μg/mL),空白对照组加入等体积的生理盐水,培养箱继续培养。
1.4Western blot检测细胞乙酰肝素酶、透明质酸酶1和CD44v6蛋白 将置于25 cm2培养瓶培养的处于对数生长期的2个细胞系细胞各分5个实验组,分别以UTI 400、800、1 600 U/mL 3个组及3.7 μg/mL TXT+UTI 800 U/mL组药物单独或联合处理,空白对照组加等量生理盐水,孵育细胞24 h后吸弃培养液,用PBS漂洗2~3次,加入100 μL细胞裂解液,冰上放置约30 min,期间可混匀几次。升至4 ℃,用细胞刮刮下细胞收集于1.5 mL EP管,以12 000 r/min,离心15 min。收集上清液,用Bradford法测定各组裂解液中蛋白质浓度,于-70 ℃储存备用。根据蛋白定量结果加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,混合后于95 ℃变性10 min,立即插入冰中待用。分别配置分离胶和浓缩胶。样品加至凝胶孔中行SDS-PAGE电泳。电泳结束后,用湿式转印法将PAGE胶上的蛋白转至PVDF膜上,转移膜置于封闭液中,室温、摇床上缓慢摇动状态下封闭1 h,加入一抗(Heparanase兔抗人抗体、Hyaluronidase-1及CD44v6鼠抗人单克隆抗体,1∶1 000稀释),4 ℃反应过夜,洗膜,将二抗用1×TBST缓冲液稀释3 000倍,加入二抗(辣根过氧化物酶标记山羊抗兔IgG抗体)。室温、避光缓慢摇动1 h,洗膜。最后用DAB显色,使用凝胶图像处理系统分析目标带净光密度值,统计并做记录。
1.5Matrigel侵袭实验检测细胞的侵袭 冰上用预冷的移液枪吸取100 μL Matrigel加入预冷的300 μL无血清培养基中,充分混匀,取稀释过的Matrigel 25 μL加入24孔板的Transwell上室,置于孵箱,37 ℃,30 min使Matrigel聚合成胶。按计划每种细胞设置5组,每组设6个复孔。培养板Transwell上室中加入100 μL细胞悬液(4×104个)同时加入无血清培养基200 μL;每个下室加入含有10%胎牛血清的RPMI-1640培养液400 μL,放入37 ℃,5%CO2孵箱,培养24 h。PBS轻洗小室上室并用移液枪弃液,湿棉签轻擦去除小室上室的细胞和Matrigel胶;加入500 μL 0.1%结晶紫溶液,将小室膜浸没在其中,置于37 ℃,5%CO2培养箱中孵育30 min,加入500 μL 33%醋酸至浸没小室膜,低速振荡10 min,充分溶解结晶紫。取出小室后将24孔板置于酶标仪上570 nm波长下测光密度值(OD值),间接反映细胞数;此实验重复3次。
1.6Transwell细胞跨膜实验检测细胞的迁移 取处于对数生长期的各处理组及对照组细胞,用PBS液和无血清培养基洗涤细胞几次,消化细胞,用无血清RPMI-1640液制备细胞悬液,计数并调整细胞数为2×105/mL;取细胞悬液50 μL加入上室,下室加入500 μL含10%胎牛血清的RPMI-1640培养液,各组设置6个复孔。培养板于37 ℃,5%CO2培养箱培养24 h。取出小室并用移液枪吸干上室液体,棉签擦去上室未迁移的细胞,移至预先加好的4%多聚甲醛孔中固定30 min;吸干上室固定液移至Gimsa染液孔用Gimsa室温染色30 min,PBS液轻洗数次。小镊完整取聚碳酸酯膜后晾干使膜底面朝上,载玻片中性树胶封片。在光学显微镜高倍镜下(×40物镜)观察并随机取6个视野计数,取平均值并统计结果。

2 结 果
2.1乳腺癌细胞Heparanase、HYAL1、CD44v6的蛋白表达 蛋白印迹结果数据统计如图1、图2所示:各药物处理组Heparanase、HYAL1、CD44v6的蛋白表达水平较对照组显著降低,差异有统计学意义(P<0.05),组间比较差异有统计学意义(P<0.05)。凝胶图扫描如图3显示,UTI剂量与目标蛋白表达呈量效关系,UTI与TXT联合用药作用则更加显著(P<0.05)。
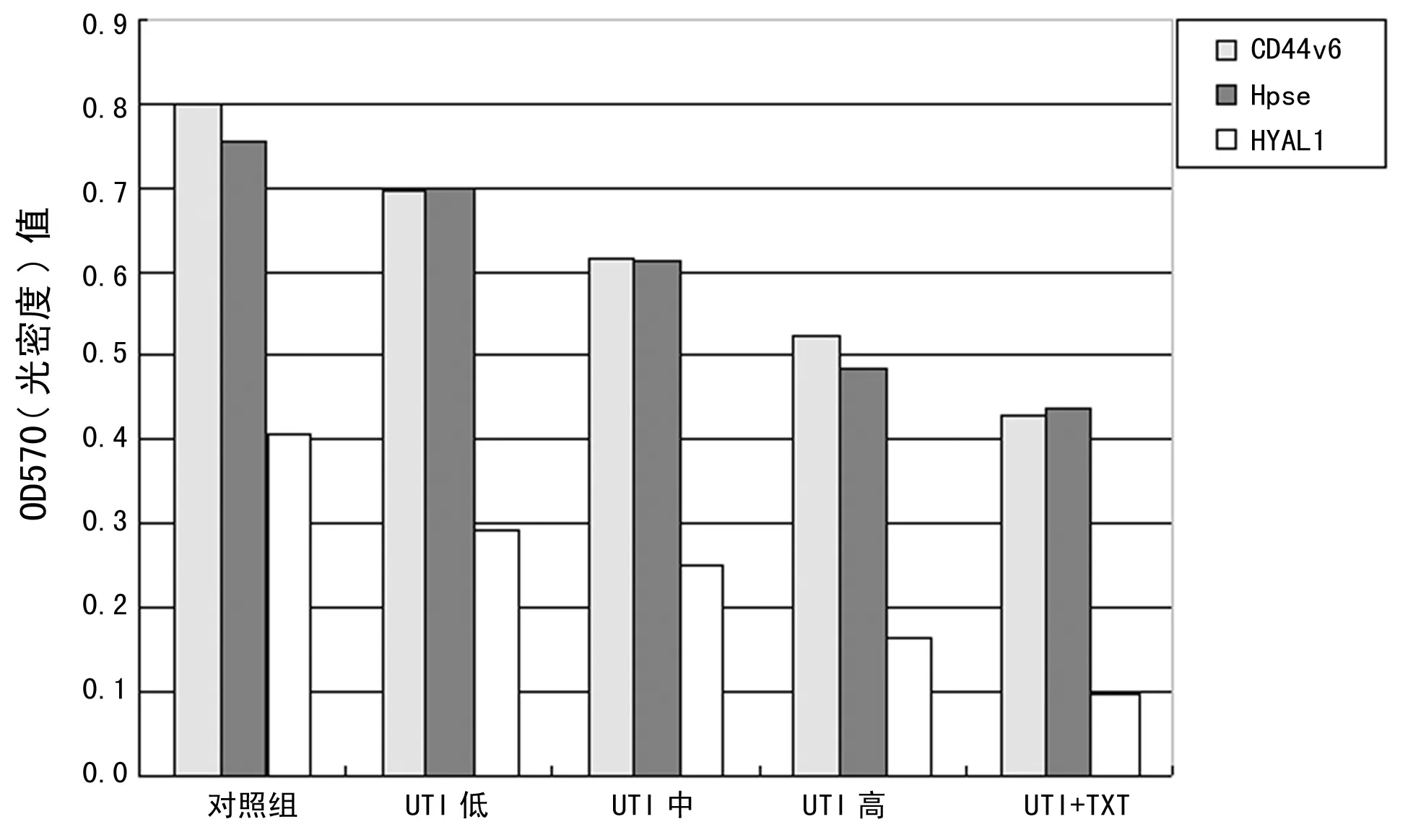
图1 Heparanase、HYAL1、CD44v6蛋白在MCF-7细胞中的表达水平
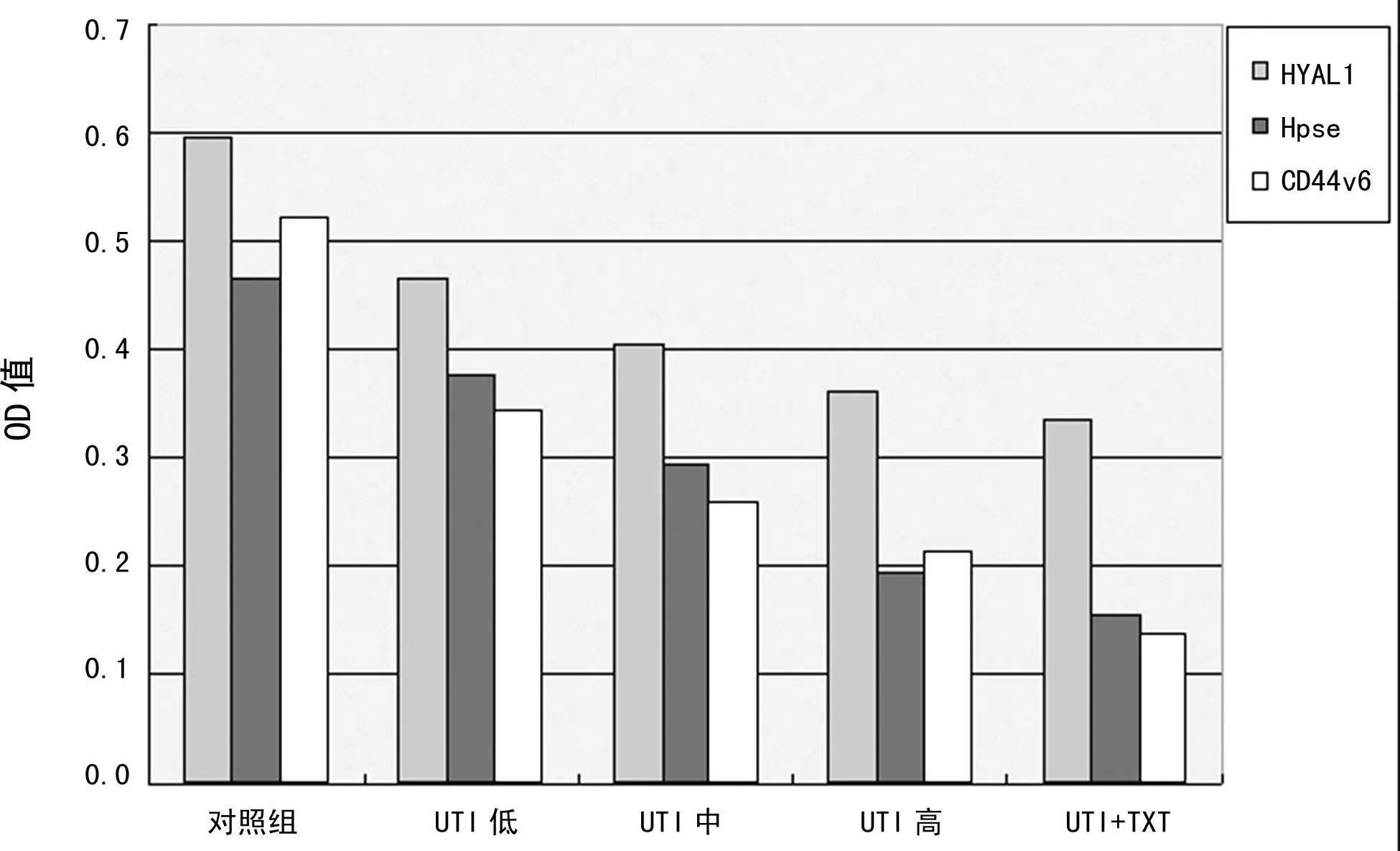
图2 Heparanse、HYAL1、CD44v6蛋白在MDA-MB-231细胞中的表达水平
2.2乳腺癌细胞的侵袭能力 如图4所示,两种细胞药物处理24 h后侵袭能力显著降低,与空白对照组比较差异有统计学意义(P<0.05);加药组UTI中和UTI高组间比较差异无统计学意义(P>0.05),其余各组两两比较差异均有统计学意义(P<0.05),可以看出UTI对细胞侵袭抑制效果显著且UTI与TXT联合用药效果更佳(其中MCF-7细胞对照组侵袭OD均值为1.059;联合用药后为0.393;MDA-MB-231对照组为1.107,联合用药后为0.469)。
2.3乳腺癌细胞的迁移能力 乳腺癌MCF-7和MDA-MB-231两系细胞分别处理24 h后迁移情况如图5所示(迁移程度采用细胞计数方法统计):UTI药物干预后两种乳腺癌细胞迁移能力显著下降,加药组与空白对照组细胞迁移数目差异有统计学意义(P<0.05);加药组UTI中和UTI高组间比较差异无统计学意义(P>0.05),其余各组两两比较差异均有统计学意义(P<0.05),UTI对细胞迁移抑制作用显著且UTI与TXT联合用药效果更加显著(其中MCF-7细胞对照组迁移平均数152个,联合用药后迁移为86个;MDA-MB-231对照组156个,联合用药后为93个)。
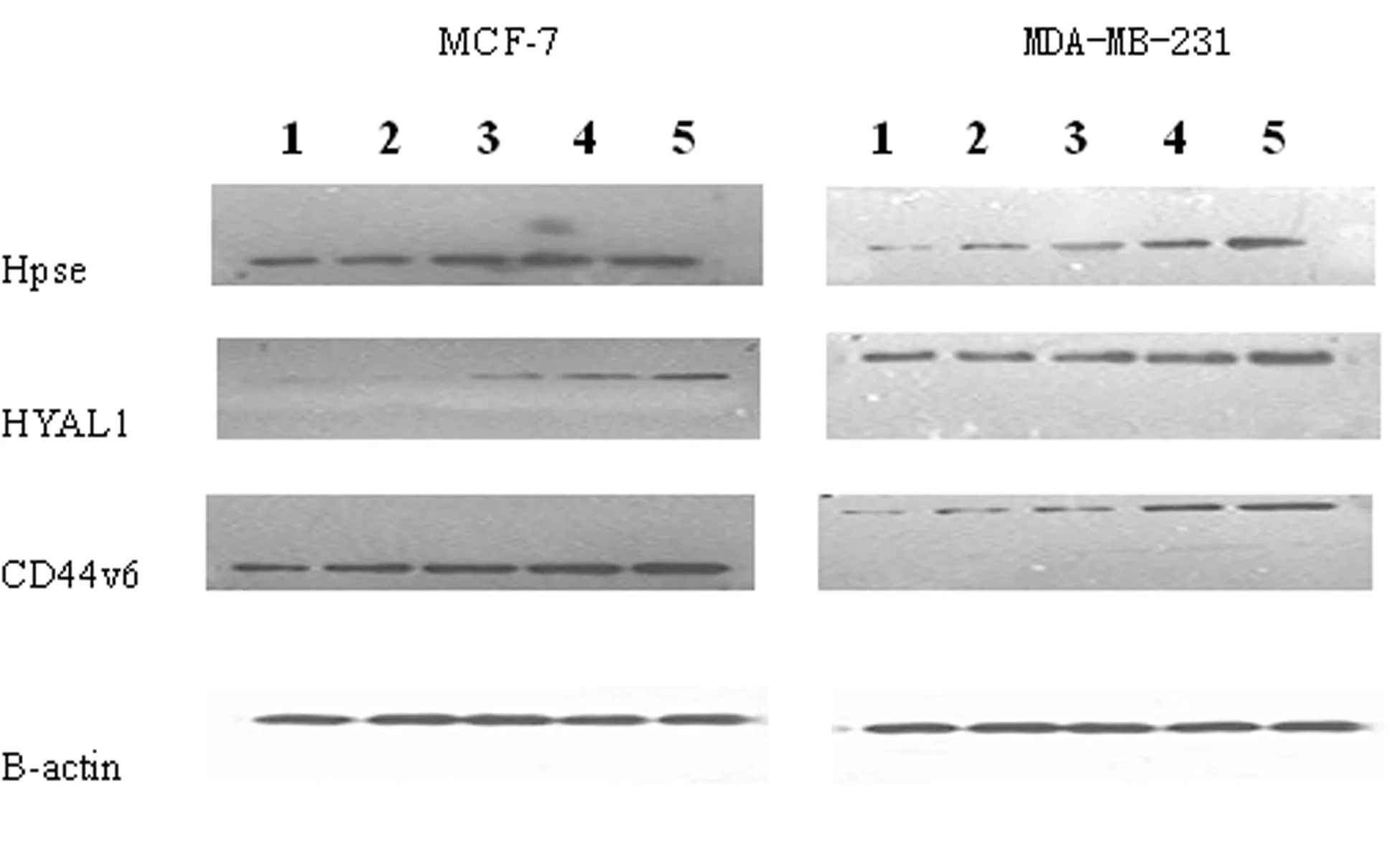
1:TXT+UTI;2:UTI高;3:UTI中;4:UTI低;5:空白对照组。
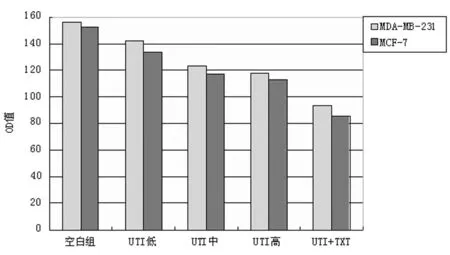
图4 乳腺癌细胞侵袭能力(OD570)
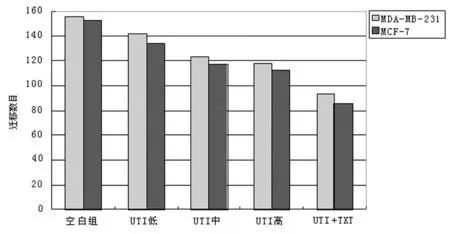
图5 乳腺癌细胞迁移能力(OD570)
3 讨 论
细胞发生侵袭和转移首先必须破坏细胞外基质(ECM)和基底膜(BM)构成的屏障,其主要成分为结构蛋白和糖胺聚糖。近期研究发现乙酰肝素酶是哺乳动物体内惟一能降解细胞外基质中硫酸肝素蛋白多糖(HSPG)侧链-硫酸乙酰肝素(HS)的内切糖苷酶,其酶活性启动后有几方面作用:首先,Hpse降解HS,破坏ECM和BM屏障,促进肿瘤细胞侵袭转移;其次,HSPG中大量储存的肝素结合型生长因子(VEGF、bFGF等)被释放,从而促进乳腺癌的血管生成,促进转移;再次,HSPG裂解产物抑制活化的T淋巴细胞使机体免疫功能降低;同时,尿激酶型纤溶酶原激活物(u-PA)和组织型纤溶酶原激活物(t-PA)被激活,激活纤溶酶后进而激活基质金属蛋白酶9(MMP-9)[4]。相关研究证明活化的MMP-9、u-PA等可以通过Ras-Raf-MEK-ERK信号通路激活细胞外信号调节激酶,使之磷酸化进而调控肿瘤细胞内基因表达、促进细胞生长,本课题组前期研究发现UTI可使MMP-9、u-PA等表达降低[2,5]。还有研究发现Hpse可以独立于酶活性之外发挥生物学功能,如:Hpse通过细胞表面相应受体蛋白结合后促使AKT、表皮生长因子受体(EGFR)的磷酸化作用,从而激活磷脂酰肌醇-3激酶(PI3K/Akt) 信号转导途径,激活内皮细胞,促进肿瘤细胞的生长和侵袭转移过程[4-7]。Zhang等[8]利用siRNA干扰沉默体外乳腺癌细胞Hpse基因的表达后发现癌细胞的侵袭、黏附能力显著降低,异体移植裸鼠模型实验也发现Hpse沉默表达显著降低了癌细胞的侵袭、转移能力。本实验发现UTI干预乳腺癌细胞后Hpse表达下降,细胞的侵袭、转移能力亦降低,提示可能与UTI抑制了Hpse蛋白表达有关。
透明质酸酶(HAase)和透明质酸(HA)是大部分哺乳类动物组织ECM的主要成分,HAase的分型HYAL1在人类乳腺癌细胞过度表达,Tan等[9]发现通过质粒转染细胞后划痕试验及ELISA实验证明HYAL1在体外乳腺癌的表达上调可以促进癌细胞侵袭和血管形成,同时HYAL1高表达可以促进裸鼠乳腺异种移植肿瘤的生长和转移。HYAL1可以特异水解HA,将HA分解成多个寡聚糖,相关文献分析相对分子质量较大的寡聚糖通过几种方式促进肿瘤的侵袭和转移:(1)通过MAPK通路刺激细胞的生长;(2)破坏胶原纤维和糖蛋白的网状结构平衡使组织变形促进细胞黏附、迁移;(3)HA与其受体CD44结合使酪氨酸激酶磷酸化产生细胞信号传导进而使细胞骨架变化增强肿瘤细胞的运动能力;小分子的寡聚糖则可以促进新生血管的形成从而为肿瘤的发展提供条件[10-11]。本实验发现UTI使乳癌细胞HYAL1表达显著降低,实验细胞侵袭、转移能力的降低可能和UTI抑制了HYAL1的表达有关。
CD44是一种细胞黏附分子,也是一种细胞表面跨膜糖蛋白,负责细胞之间及细胞与间质的连接。CD44v6是其中一种变异型,有研究表明CD44v6在肿瘤细胞中表达丰富并与乳腺癌细胞的侵袭和转移有关[12]。AKT是一种丝氨酸蛋白激酶,活化的AKT是促进细胞增殖转移和抑制凋亡的PI3K/AKT信号通路的关键酶,透明质酸与CD44v6结合后促进AKT的磷酸化在癌细胞的生长转移过程中作用显著,近期研究表明CD44v6高表达和AKT磷酸化密切相关[13-15]。本实验发现UTI可以显著抑制CD44v6蛋白的表达。
[1]Turley EA,Nobble PW,Bourguignon LY,et al.Signaling properties of hyaluronan receptors[J].J Biol Chem,2002,277(7):4589-4592.
[2]Sun ZJ,Yu T,Chen JS,et al.Effects of ulinastatin and cyclophosphamide on the growth of xenograft breast cancers,and expression of CXCR4 and MMP-9 in cancers[J].J Inter Med Res,2010,38(3):967-976.
[3]Luo J,Sun X,Gao F,et al.Effects of ulinastatin and docetaxel on breast cancer invasion and expression of uPA,uPAR and ERK[J].J Experi Clin Cancer Res,2011,29(1):71-73.
[4]Lyons JM,Schwimer JE,Anthony CT,et al.The role of VEGF pathways in human physiologic and patholog angiogenesis[J].J Surg Res,2010,159(4):517-527.
[5]陈建生,孙治君,于涛,等.乌司他丁和环磷酰胺对乳腺癌细胞增殖和侵袭及mmp9表达的影响[J].中国生物制品学,2009,22(9):865-868.
[6]Rao G,Liu DX,Xing MZ,et al.Induction of heparanase-1 expression by mutant B-Raf kinase:role of GA binding protein in heparanase-1 promoter activation[J].Neoplasia,2010,12(11):946-956.
[7]Fux L,Ilan N,Ralph D,et al.Heparanase:busy at the cell surface[J].NIH Public Access Author Manuscript,2009,34(10):511-519.
[8]Zhang ZH,Chen Y,Zhao HJ,et al.Silencing of heparanase by siRNA inhibits tumor metastasis and angiogenesis of human breast cancer in vitro and in vivo[J].Cancer Biol Therapy,2007,6(4):587-595.
[9]Tan JX,Wang XY,Su XL,et al.Upregulation of HYAL1 expression in breast cancer promoted tumor cell proliferation,migration,invasion and angiogenesis[J].PLoS One,2011,6(7):836-838.
[10]杨俊伟.透明质酸、透明质酸酶与泌尿系恶性肿瘤的研究进展[J].现代诊断与治疗,2011,22(1):25-28.
[11]李志强,姜书传,马玲,等.膀胱移行癌中HYAL1、CD44v6及MVD的临床意义[J].现代泌尿外科杂志,2011,16(5):439-404.
[12]Afify A,Purnell P,Nguyen L.Role of CD44s and CD44v6 on human breast cancer cell adhesion,migration,and invasion[J].Exp Mol Pathol,2009,86(2):95-100.
[13]Ghatak S,Hascall VC,Markwald RR,et al.Stromal hyaluronan interaction with epithelial CD44 variants promotes prostate cancer invasiveness by augmenting expression and function of hepatocyte growth factor and androgen receptor[J].Biol Chem,2010,285(26):9821-9824.
[14]Lilly YW,Bourguignon,Wong G,et al.Hyaluronan-CD44 interaction promotes c-Src-mediated twist signaling,microRNA-10b expression,and rhoA/RhoC up-regulation,leading to Rho-kinase-associated cytoskeleton activation and breast tumor cell Invasion[J].J Biol Chem,2010,285(47):36721-36735.
[15]Yu P,Zhou L,Ke W,et al.Clinical significance of pAKT and CD44v6 overexpression with breast cancer[J].Cancer Res Clin Oncol,2010,136(8):1283-1292.
