前列腺素E2对结肠癌细胞CacyBP/SIP核转位的影响*
2012-01-03谢福利翟惠虹
谢福利,翟惠虹
(1.宁夏师范学院医学院,银川 756000;2.宁夏医科大学总医院消化内科,银川 750004)
20世纪70年代研究发现大肠癌患者体内前列腺素E2(prostaglandin E2,PGE2)含量是其它肿瘤的1.7~5.0倍[1]。80年代应用非甾体消炎药可降低结肠癌40%~50%发病率[2]。PGE2异常升高与肿瘤的关系密切,促进结肠癌的进展[3]。钙周期素结合蛋白(calcyclin-binding-protein,or siah-1 interacting protein,CacyBP/SIP)自1996年发现以来,越来越多的证据显示[4-5]:CacyBP/SIP在肿瘤发生、发展、侵袭、转移等方面都有重要的作用;同时,CacyBP/SIP具有依赖Ca2+浓度的核转位现象[6]。PGE2是否可诱导CacyBP/SIP核转位,由此促进结肠癌细胞增殖?本研究拟通过构建CacyBP/SIP过表达慢病毒颗粒,转染至结肠癌细胞,给予PGE2刺激,观察CacyBP/SIP在结肠癌细胞中的定位,明确PGE2是否诱导CacyBP/SIP核转位。
1 材料与方法
1.1材料 结肠癌细胞SW480购于上海中科院。小牛血清、L15培养基、胰酶购自Gibco公司;CacyBP/SIP mAb购于Cell signaling;PGE2购于Cayman公司;胞浆胞核蛋白抽提试剂盒购于pierce公司;DAPI染色剂购于Sigma公司; FITC标记的羊抗鼠IgG为中山公司产品;Triton x-100裂解液试剂盒为北京鼎国公司;293T细胞、pGC-LV重组载体、pHelper 1.0、pHelper 2.0来源于吉凯基因公司;PVDF膜购自Merck公司;其他相关试剂购自Takara、Fermentas、SinoBio、NEB、捷瑞公司。
1.2方法
1.2.1过表达慢病毒载体构建 应用人结肠癌细胞株HCT-116的cDNA序列,采用Primer Premier v5.0软件设计上游和下游引物,PCR法扩增,分别用Nhe I和EcoR I进行双酶切,T4 连接酶将酶切后的产物相连,转化大肠杆菌DH5α感受态细胞,PCR法筛选阳性克隆,接种阳性转化子,送测序。慢病毒包装、采用逐孔稀释法测定并标定病毒滴度。
1.2.2转染人结肠癌细胞SW480细胞 用含10%的56 ℃、30 min热灭活小牛血清的L15培养基,在37 ℃、5%CO2饱和湿度培养箱中培养,隔天换液,待细胞长至80%~90%传代。至细胞在T50瓶长至30%~50%时,每瓶加入500 μL(5 μg/mL)Polybrene、4 400 μL完全培养基和100 μL(1×108)过表达CacyBP/SIP的慢病毒颗粒,在水平方向轻轻摇动培养瓶,使其充分混匀,放入培养箱培养8~12 h以后观察细胞状态,更换为新鲜培养基继续培养。
1.2.3激光共聚焦和Western blot检测 正常消化传代并行激光共聚焦检测。再取3个12孔培养板,每孔放置一个细胞爬片,每孔接种(3~4)×104细胞于12孔板。至细胞长至最佳状态时,吸干培养基,用PBS冲洗2次,每个培养板加入2 mL含100 μmol/L PGE2培养基,对照组每孔分别加入完全培养基作为对照。放入培养箱培养1 h。固定、打孔、用含DAPI封片剂染色封片。激光共聚焦检测CacyBP/SIP在细胞中的定位。Western blot法检测:分别取转染后的SW480细胞,在给予100 μmol/L PGE2刺激前、后1 h,分别抽提胞浆、胞核蛋白,用BCA定量;上样缓冲液稀释至5 μg/uL、煮沸后-80 ℃冻存;把20 μL蛋白样品上样到12%SDS-PAGE胶加样孔内,电泳电压80 V,时间20 min;湿式转膜,电流200 mA,60 min;加入5%脱脂牛奶封闭60 min后,加入CacyBP/SIP单抗(1∶200)4 ℃孵育过夜,常规洗膜后加入羊抗鼠IgG(1∶2 000)的二抗,室温孵育1 h,洗涤。曝光、显影。
2 结 果
2.1激光共聚焦检测PGE2刺激前、后CacyBP/SIP 在细胞内定位和表达 无PGE2刺激条件下 CacyBP/SIP 主要位于细胞胞质内,给予100 μmol/L PGE2刺激1 h条件下CacyBP/SIP可转位至细胞核内(图1);100 μmol/L PGE2刺激0.5 h条件下CacyBP/SIP无明显核转位(图2)。
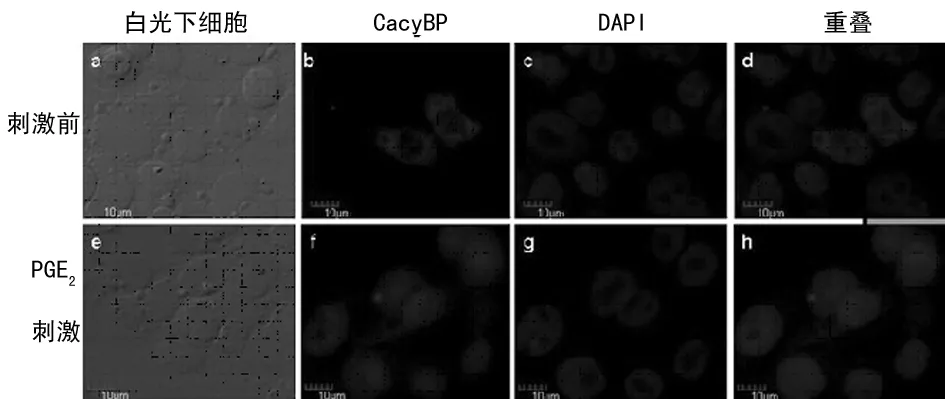
a:白光下细胞;b:未给予PGE2刺激CacyBP/SIP位于胞浆;c:DAPI染色;d:重叠图像显示CacyBP/SIP位于胞浆;e:白光下细胞;f:给予PGE2刺激 CacyBP/SIP进入胞核;g:DAPI染色;h:重叠显示CacyBP/SIP位于胞核。
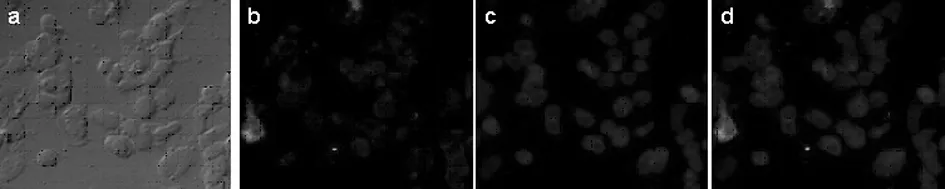
a:白光下细胞;b:CacyBP/SIP;c:DAPI染色;d:重叠图像显示。
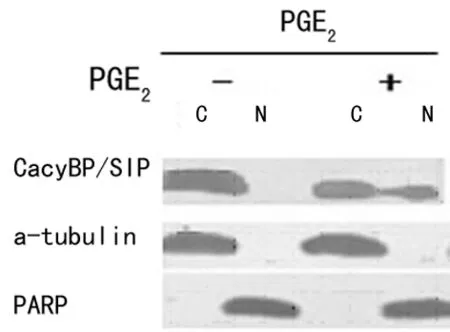
-:表示无刺激;+:有刺激;C:胞浆;N:胞核。
2.2Western blot检测PGE2刺激前、后CacyBP/SIP在细胞内定位和表达 无刺激条件下,CacyBP/SIP主要在胞质内表达,给予100 μmol/L PGE2刺激1 h,可在细胞核内表达(图3)。
3 讨 论
1996年Filipek从小鼠腹水瘤细胞和鼠脑组织中首次发现一个以依赖Ca2+浓度,可与S100 A6结合,命名为 Calcyclin(S100A6)-binding-protein(钙周期素结合蛋白),既CacyBP。2001年在研究p53刺激下β-catenin泛素化降解新通路时,从cDNA文库中调到一个可以与Siah-1相互作用的蛋白,命名为 Siah-1-interacting-protein,即SIP。进一步研究发现,SIP即CacyBP,因此,目前命名为CacyBP/SIP。其相对分子质量约26×103,含一个687 bp的开放阅读框,编码228个氨基酸,存在7个磷酸化位点和1个核定位信号[7]。
目前,对CacyBP/SIP功能研究较少,其功能主要表现在:(1)与p53有关:参与了新的泛素-蛋白酶体降解,当p53在细胞内表达升高时,可诱导Siah-1基因的表达,共同组成泛素连接酶复合体(Siah-1-CacyBP/SIP-SCF),将未被磷酸化的β-catenin蛋白酶体降解;(2)与红细胞有关[8]:有报道促红细胞生成素受体活化可促进CacyBP/SIP表达上调。
以往研究发现, CacyBP/SIP在胃癌阿霉素耐药细胞中高表达[9]并参与胃癌细胞多重耐药,其下调可以部分逆转耐药性[10]。在肾细胞癌中发现:CacyBP/SIP表达上调能抑制肾细胞癌的增殖和肿瘤形成[11]。近年来又发现CacyBP/SIP参与乳腺癌、胰腺癌的发生、发展及复发转移,可能成为预后不良的生物学指标之一[12-14]。因此,推断CacyBP/SIP与恶性肿瘤的发生、发展密切相关。
本课题组前期利用淋巴细胞杂交瘤技术制备了3株CacyBP/SIP单克隆抗体,对正常及肿瘤组织中CacyBP/SIP表达分布状况做了较系统的研究,研究发现[15-16]:CacyBP/SIP在结肠癌组织中的表达明显高于癌旁组织,在正常结肠组织不表达,且主要定位于胞浆及胞核;给予给KCl刺激后,通过升高胞浆内Ca2+浓度,可诱导CacyBP/SIP核转位。
2002年Filipek等[6]首次发现CacyBP/SIP具有依赖Ca2+浓度的核转位现象,那么,究竟哪些因素可以引起CacyBP/SIP核转位?
PGE2在生理状态下含量很低,却又具有很强的生理活性。环氧酶-2(COX-2)是 PGE2合成的限速酶,应用非甾体消炎药降低结肠癌发病率主要是通过抑制COX-2活性达到治疗作用,选择性COX-2抑制剂成为结肠癌防治的一条新途径。PGE2异常升高与肿瘤的关系密切:直肠癌PGE2含量与肝肺转移呈正相关;大肠癌PGE2含量和肿瘤大小呈正相关,并且Dukes′D期明显高于B、C期;PGE2能显著促进结肠癌细胞的生长;PGE2含量与肿瘤分化程度呈正相关;结肠癌化疗中用其抑制剂提高了患者生存率[18]。
本研究通过CacyBP/SIP过表达慢病毒颗粒转染至结肠癌SW480细胞,激光共聚焦显微镜发现CacyBP/SIP主要位于细胞胞浆,Western blot亦证实其位于胞浆。给予PGE2刺激发现CacyBP/SIP可发生核转位现象,Western blot亦证实CacyBP/SIP在刺激前位于胞浆,刺激后位于胞核。蛋白在细胞中的定位常常与其功能密切相关, CacyBP/SIP在给予刺激后发生核转位及磷酸化,提示其可能做为信号分子传递信息,从而参与细胞功能的调节。作者前期已发现CacyBP/SIP在结肠癌中高表达,免疫组化结果提示CacyBP/SIP位于胞浆及胞核,PGE2可诱导CacyBP/SIP核转位,CacyBP/SIP是否作为信使,传递上游促进恶性肿瘤增殖的信号,需进一步研究。
[1]Jaffe BM,Parker CW,Philpott GW.Immunochemical measurement of prostaglandin or prostaglandin-like activity from normal and neoplastic cultured tissue J[J].Surg Forum,1971,22:90-92.
[2]Jacoby RF,Seibert K,Cole CE,et al.The cyclooxgenase-2 inhibitor celecoxib is a potent preventive and therapeutic agent in the min mouse model of adenomatous polyposis[J].Cancer Res,2000,60(18):5040-5044.
[3]杨鹏远.前列腺素E2通过Gs_Axin_Catenin信号途径促进结肠癌细胞生长[J].中国肿瘤生物治疗杂志,2007,14(1):25-27.
[4]Wu J,Tan X,Peng X,et al.Translocation and phosphorylation of calcyclin binding protein during retinoic acid-induced neuronal differentiation of neuroblastoma SH-SY5Y cells[J].J Biochem Mol Biol,2003,36(4):354-358.
[5]胡文华,尹芳,金晓航,等.CacyBP编码基因对胃癌细胞多药耐药性形成的影响[J].中华肿瘤杂志,2002,24(5):426-429.
[6]Filipek A,Jastrzebska B,Nowotny M,et al.Ca2+-dependent translocation of the calcyclinbinding protein in neurons and neuroblastoma NB-2a cells[J].J Biol Chem,2002,277(23):21103-21109.
[7]Filipek A,Kuznicki J.Molecular cloning and expression of a mouse brain cDNA encoding a novel protein target of calcyclin[J].J Neuroehem,1998,70(5):1793-1798.
[8]Pircher TJ,Geiger JN,Zhang D,et al.Integrative signaling by minimal erythropoietin receptor forms and c-Kit[J].J Biol Chem,2001,276(12):8995-9002.
[9]Hu W,Yin F,Jin X,et al.Effect of human calcyclin binding protein encoding gene on development of multiple drug resistance in gastric cancer[J].Zhonghua Zhongliu Zazhi,2002,24(5):426-429.
[10]Yongquan Shi,Wenhua Hu,Fang Yin,et al.Regulation of drug sensitivity of gastric cancer cells by human calcyclin-binding-protein(CacyBP)[J].Gastric Cancer,2004,7(3):160-166.
[11]Sun S,Ning X,Liu J,et al.Over expressed CacyBP/SIP leads to the suppression of growth in renal cell carcinoma[J].Biochem Biophys Res Commun,2007,356(4):864-871.
[12]宁晓暄,孙世仁,张坤,等.S100分子结合域缺失对钙周期素结合蛋白生物学功能影响的研究[J].中华肿瘤防治杂志,2008,15(13):968-971.
[13]王宁菊,马刚,翟惠虹.钙周期素结合蛋白与乳腺癌临床的相关性研究[J].第四军医大学学报,2009,30(21):2403-2407.
[14]Chen X,Han G,Zhai H,et al.Expression and clinical significance of CacyBP/SIP in pancreatic cancer[J].Pancreatology,2008,8(4):470-477.
[15]Chen X,Mo P,Li X,et al.CacyBP/SIP protein promotes proliferation and G1/S transition of human pancreatic cancer cells[J].Mol Carcinog,2011,46(10):1002-1004.
[16]Zhai H,Shi Y,Yu J,et al.Establishment and characterization of calcyclin-binding-p rotein(CacyBP) monoclonal antibody[J].Hybri doma(Larchm),2006,25(2):91-94.
[17]Zhai HH,Shi YQ.Expression of calcyclin-binding-protein/ Siah-1-interacting-protein in normal and malignant human tissues:an immunohisto- chemical survey[J].J Histochem Cytochem,2008,56(8):765-772.
[18]俞慧宏,吴小翎,张苜,等.测定胃癌患者肿瘤组织与外周血中前列腺素E2的临床意义[J].第三军医大学学报,2008,30(5):444-446.
