SOX7对胃癌MKN45细胞株体外迁移侵袭的影响
2012-01-03宋隆明
宋隆明
(重庆市合川区中西医结合医院外科 401520)
胃癌是常见的消化道恶性肿瘤,在世界范围内其发病率和致死率均排在所有恶性肿瘤的第4位[1]。在中国,其发病率和死亡率高居所有恶性肿瘤的首位。目前,胃癌发生、发展的机制尚不清楚,其诊断和治疗仍是医学界悬而未决的难题。从分子生物学的角度来探讨这些问题将是未来解决胃癌治疗难题的重要手段。SOX7是近期发现的Wnt/β-catenin信号通路的关键的负性调控因子,SOX基因根据HMG盒基因序列的同源性分为10个亚组,SOX7是SOX家族F亚组的成员之一,它可以和β-catenin竞争TCF/LEF(T cell factor/lymphoid enhancer factor)上的结合位点,从而抑制Wnt/β-catenin信号通路的激活[2]。已有报道,SOX7在一些恶性肿瘤中低表达,如乳腺癌、肝癌、前列腺癌和结肠癌,且和这些肿瘤的进展有明显的相关性[3-4];作者在前期的研究中已经发现SOX7在胃癌组织中低表达,且其表达水平与胃癌病灶的大小、淋巴结转移和临床分期有关。为了进一步验证SOX7抑制胃癌进展的作用,作者通过在MKN45胃癌细胞中外源性的过表达SOX7,观察细胞增殖和侵袭能力的改变,并检测与肿瘤转移相关的Wnt/β-catenin信号通路下游靶蛋白MMP-9的表达情况,初步探讨其分子机制。
1 材料与方法
1.1细胞培养 人类低分化胃癌细胞株MKN45购于中国科学院典型培养物保藏委员会细胞库,在含10%胎牛血清(四季青生物工程有限公司)的RPMI-1640培养基(Hyclone公司)中,37 ℃、5% CO2条件下培养。倒置相差显微镜下观察细胞生长情况,1~2 d换液,生长至80%覆盖率时用胰酶消化传代。
1.2质粒转染及稳定表达SOX7细胞株建立 从GeneBank中调取SOX7的CDS区碱基序列(NM_031439),委托北京基诺生物有限公司合成pIRES2-EGFP-SOX7重组质粒和pIRES2-EGFP质粒。将对数期生长的MKN45细胞接种至6孔板中,待细胞长至50%融合时,每孔按质粒和脂质体体积比1∶2.5加1 mL无血清培养基进行转染,培养8 h后,更换为普通培养基。24 h后荧光显微镜观察转染效率,并加入终浓度400 μg/mL的G418(Sigma公司)进行筛选,2周后挑选发绿色荧光的单克隆进行扩大培养,培养基中加入200 μg/mL的G418维持。相同的方法用pIRES2-EGFP质粒转染细胞作为对照组。
1.3Real-time PCR检测 取对数生长期的细胞,待其生长至80%融合后,用Trizol法提取总RNA,用紫外分光光度计在260、280 nm处测吸光度值,计算RNA含量和纯度。按cDNA反转录酶试剂盒(TaKaRa公司)说明书进行操作,取2 μg RNA反转录为cDNA,以cDNA为模板进行PCR扩增,PCR引物由上海生工生物工程技术服务有限公司合成。SOX7上游引物序列为5′-CAA GAT GCT GGG AAA GTC GT-3′,下游引物序列为5′-CCG GTA CTT GTA GTT GGG GTA GT-3′,产物长度118 bp;内参GAPDH上游引物序列为5′-AGC CTC AAG ATC ATC AGC AAT G-3′,内参GAPDH下游引物5′-TGT GGT CAT GAG TCC TTC CAC G-3′。反应体系:总体积20 μL,其中cDNA 1.5μL,上、下游分别1 μL,SYBR mix 10 μL(TaKaRa公司),灭酶水6.5 μL。扩增条件:95 ℃预变性3 min,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,采集荧光,获取熔解曲线。以GAPDH为内参,使用2-ΔΔCt方法进行分析。
1.4Western blot检测 取对数生长期的细胞,待其生长至80%融合后,使用RIPA强效裂解液(碧云天公司)提取总蛋白,用BCA蛋白定量试剂盒(碧云天公司)进行定量,根据分子量配置10% SDS-PAGE胶,上样量100 μg,40 V恒压电泳,待溴酚蓝离开浓缩胶后,恒压80 V电泳至溴酚蓝到玻板底部终止,恒流250 mA将蛋白转印至PVDF膜上,脱脂奶粉封闭1 h,SOX7一抗1∶100(Santa Cruz公司),MMP-9一抗1∶100(博奥森公司)或GAPDH一抗1∶1 000(碧云天公司)4 ℃孵育过夜。TBST洗膜3次,每次10 min;加二抗37 ℃孵育90 min,洗膜3次,每次10 min;ECL化学发光试剂盒显影(碧云天公司)。用Quantity One 4.6.2软件对条带灰度值进行分析。
1.5细胞增殖率检测 用MTT细胞增殖及细胞毒性检测试剂盒(碧云天公司)检测各组细胞的增殖率,操作按照试剂盒说明进行。
1.6细胞侵袭检测 将各组细胞按1×105种于底部铺有Matrigel胶(BD公司)的Millicell小室中(Millipore公司),小室内加入含1%胎牛血清的培养基并将之放于24孔板上,24孔板内加入含10%胎牛血清的培养基作为诱导,培养24 h后用棉签去除小室底部的胶和未穿透的细胞,用4%的多聚甲醛固定小室外穿透的细胞,吉姆萨进行染色,取随机5个100倍视野计数穿透细胞进行分析。
2 结 果
2.1SOX7过表达的MKN45细胞稳定株建立 pIRES2-EGFP-SOX7和pIRES2-EGFP转染细胞后,经G418筛选后的稳定株均显现绿色荧光(图1A)。转染SOX7质粒组的SOX7 mRNA和蛋白水平明显高于转染空白质粒组和亲代MKN45细胞组(图1B)。
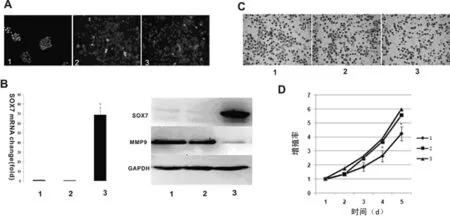
A1:筛选稳定过表达的SOX7单克隆;A2:转染空白载体的MKN45细胞;A3: SOX7转染组。B1:筛选稳定过表达的SOX7单克隆;B2:转染空白载体的MKN45细胞;B3: SOX7转染组;转染SOX7质粒组的mRNA和蛋白水平明显高于转染空白质粒组和亲代MKN45细胞组;转染SOX7质粒组的MMP9蛋白表达明显低于转染空白质粒组和亲代MKN45细胞组。C1:筛选稳定过表达的SOX7单克隆;C2:转染空白载体的MKN45细胞;C3: SOX7转染组;转染SOX7质粒组的侵袭能力明显低于转染空白质粒组和亲代MKN45细胞组。D1:筛选稳定过表达的SOX7单克隆;D2:转染空白载体的MKN45细胞;D3: SOX7转染组;转染SOX7质粒组的增殖能力明显低于转染空白质粒组和亲代MKN45细胞组。
2.2SOX7过表达抑制MKN45细胞增殖和侵袭能力 转染SOX7质粒组的侵袭能力明显低于转染空白质粒组和亲代MKN45细胞组(P<0.05),见图1C。转染SOX7质粒组(60±9)的增殖能力明显低于转染空白质粒组(122±17)和亲代MKN45细胞组(137±24),P<0.05,见图1D。
2.3SOX7过表达下调MMP-9表达 转染SOX7质粒组的MMP-9蛋白表达明显低于转染空白质粒组和亲代MKN45细胞组(P<0.05),见图1B。
3 讨 论
Wnt/β-catenin信号通路是一种对细胞增殖和分化具有重要调节作用的信号传导系统。越来越多的研究证明Wnt/β-catenin信号通路在肿瘤发生、发展中也同样发挥了重要作用[5]。β-catenin是Wnt/β-catenin信号通路中关键性因子,它进入细胞核后,能与TCF/LEF结合,激活其下游的与肿瘤转移和发生有关的靶基因,如CD44[6]、MMP-9[7]及C-MYC[8]等,从而促进肿瘤的进展。SOX7是近期发现的Wnt/β-catenin信号通路的关键负性调控因子,它可以和β-catenin竞争TCF上的结合位点,从而抑制Wnt/β-catenin信号通路的激活。而且,SOX7在胞浆中还可以通过促进β-catenin-AXIN1-GSK3β-APC复合体的形成,促进β-catenin的磷酸化降解,阻止β-catenin进入胞核发挥作用[9]。
在前期的研究中,作者已经发现SOX7在胃癌组织中低表达,且其表达水平与胃癌的大小,淋巴结转移和临床分期有关。为了进一步验证SOX7抑制胃癌进展的作用,作者通过在MKN45胃癌细胞中外源性的过表达SOX7,观察细胞增殖和侵袭能力的改变,结果发现SOX7过表达可以降低MKN45细胞的增殖和侵袭能力,这与之前在结肠癌中的研究结果类似[10],作者推测其可能的机制与SOX7负性调控Wnt/β-catenin信号通路有关。为了验证这一假设,作者检测了过表达SOX7前后MKN45中与肿瘤转移相关的Wnt/β-catenin信号通路下游靶蛋白MMP-9的表达情况,MMP-9是肿瘤转移过程中的一个重要蛋白,它可以降解细胞外基质,为癌细胞的游走转移提供必要的通道[11]。实验结果提示过表达SOX7后MMP-9的表达是明显下调的,因此,作者认为在胃癌MKN45细胞中,过表达SOX7可以通过和β-catenin竞争TCF/LEF结合位点,阻止β-catenin-TCF/LEF复合体的形成,继而抑制下游靶蛋白而发挥作用。此外,过表达SOX7可以增加胞浆中游离SOX7蛋白的水平,SOX7在胞浆中可以促进β-catenin-AXIN1-GSK3β-APC复合体的形成,增加β-catenin的磷酸化降解。Wnt/β-catenin信号通路下游还有许多与上皮细胞间质转化及肿瘤干细胞相关的因子[12],如重要的间质标志物VIMENTIN[13],它已经被证明是Wnt/β-catenin信号通路下游的靶点,因此,SOX7对于抑制EMT可能也有重要的作用,也可能是SOX7发挥抑癌作用的潜在机制。此外,有研究发现,SOX7和SOX18在斑马鱼发育过程中调节其血管生成[14],但是目前尚无SOX7对于肿瘤血管生成调控的研究,肿瘤血管生成是肿瘤进展的必要条件,探讨SOX7对于肿瘤血管生成的作用对于肿瘤发生、发展的研究可能有潜在的意义。
综上所述,作者在胃癌组织中发现SOX7可能是胃癌进展的一个重要抑制因子,随后在体外研究中进一步证实了这一现象,并初步探讨了可能的机制。研究发现,SOX7不仅可以抑制胃癌细胞的增殖,促进胃癌细胞的转移,并且可能对于胃癌细胞的凋亡、耐药和血管生成有一定的调控作用。在下一步的研究中作者将在检测更多的Wnt/β-catenin
信号通路下游靶蛋白(如CD44、C-MYC、VIMENTIN)的同时,横向的探讨SOX7对胃癌细胞凋亡、耐药性和血管生成的作用,并且纵向的对SOX7和TCF/LEF的关系进行深入探讨,本研究可能为胃癌的诊断和治疗提供一个新的靶点。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Khan NP,Pandith AA,Hussain MU,et al.Novelty of Axin 2 and lack of Axin 1 gene mutation in colorectal cancer:a study in Kashmiri population[J].Mol Cell Biochem,2011,355(1/2):149-155.
[3]Katoh M.Expression of human SOX7 in normal tissues and tumors[J].Int J Mol Med,2002,9(4):363-368.
[4]Lu T,Hano H,Meng C,et al.Frequent loss of heterozygosity in two distinct regions,8p23.1 and 8p22,in hepatocellular carcinoma[J].World J Gastroenterol,2007,13(7):1090-1097.
[5]Espada J,Calvo MB,Diaz-Prado S,et al.Wnt signalling and cancer stem cells[J].Clin Transl Oncol,2009,11(7):411-427.
[6]Wielenga VJ,Smits R,Korinek V,et al.Expression of CD44 in Apc and Tcf mutant mice implies regulation by the WNT pathway[J].Am J Pathol,1999,154(2):515-523.
[7]Blavier L,Lazaryev A,Dorey F,et al.Matrix metalloproteinases play an active role in Wnt1-induced mammary tumorigenesis[J].Cancer Res,2006,66(5):2691-2699.
[8]He TC,Sparks AB,Rago C,et al.Identification of c-MYC as a target of the APC pathway[J].Science,1998,281(5382):1509-1512.
[9]Sinner D,Kordich JJ,Spence JR,et al.Sox17 and Sox4 differentially regulate beta-catenin/T-cell factor activity and proliferation of colon carcinoma cells[J].Mol Cell Biol,2007,27(22):7802-7815.
[10]Zhang Y,Huang S,Dong W,et al.SOX7,down-regulated in colorectal cancer,induces apoptosis and inhibits proliferation of colorectal cancer cells[J].Cancer Lett,2009,277(1):29-37.
[11]李斌,陈武科,陈鹏,等.乳腺癌中MTA1、MMP-9表达与临床病理研究[J].重庆医学,2010,39(12):1552-1554.
[12]Singh A,Settleman J.EMT,cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer[J].Oncogene,2010,29(34):4741-4751.
[13]Gilles C,Polette M,Mestdagt M,et al.Transactivation of vimentin by beta-catenin in human breast cancer cells[J].Cancer Res,2003,63(10):2658-2664.
[14]Pendeville H,Winandy M,Manfroid I,et al.Zebrafish Sox7 and Sox18 function together to control arterial-venous identity[J].Dev Biol,2008,317(2):405-416.
