不同低氧分压对SD大鼠骨髓间充质干细胞增殖分化的影响*
2012-01-03彭涛,黄姣,徐凌
彭 涛,黄 姣,徐 凌
(1.重庆市黔江中心医院口腔科 409000;2.重庆市口腔疾病与生物医学研究中心/重庆医科大学附属口腔医院牙周黏膜科 401147;3.重庆市口腔疾病与生物医学研究中心/重庆医科大学附属口腔医院修复科 401147)
骨髓间充质干细胞(bone marrow stromal cells,MSCs),由于其特有的成骨分化潜能,因而在骨组织工程领域中备受关注[1-2]。但是在组织工程实际应用中,做为种子细胞移植入缺损处后,因为没有血管化的同步形成,最初处于一相对低氧环境中,因此研究MSCs的增殖和分化是否受缺氧或低氧环境影响具有重要的意义。近年有研究也发现,间充质源性细胞均属于氧感应细胞。本实验通过建立低氧-细胞培养模型,探讨不同低氧分压微环境对MSCs增殖及成骨向分化的影响,为后续的进一步研究提供理论依据。
1 材料与方法
1.1主要材料与仪器 (1)主要材料:α-MEM培养基(Gibco,美国),胰蛋白酶、EDTA、牛血清清蛋白(BSA),考马斯亮蓝(Sigma,美国),胎牛血清(Hyclone,美国),MTT试剂(Gibco,美国),二甲基亚砜(分析纯,中国),兔抗鼠SH3、CD34、CD44、CD54、CD105抗体,兔抗鼠Ⅰ型胶原蛋白(COLⅠ)抗体,生物素化山羊抗兔抗体(BOSTER,中国),DAB(北京中杉金桥生物技术公司,中国)。(2)主要仪器:25 cm2培养瓶、6孔培养板、96孔培养板(Corning,美国);CO2孵育箱(Sanyo,日本)、Heraeus三气细胞培养箱(Pierce,德国)、倒置相差显微镜(Olympus,日本)、碱性磷酸酶(ALP)检测试剂盒(北京柏定生物工程有限公司)、Leica显微镜(德国)、图像分析系统Image-Pro Plus 4.5(Media,美国)、HTS7000plus多孔板高效分析仪(PE,美国)。
1.2方法
1.2.1细胞来源和培养 取雄性4周龄SD大鼠,引颈法处死,无菌条件下取大鼠股骨,切除两侧的股骨端,用针管吸取5 mL含10%胎牛血清的α-MEM培养基,冲出骨髓,将其接种于25 cm2培养瓶中,用巴氏吸管吹散细胞,然后置于5%CO2、37 ℃、饱和湿度条件的CO2培养箱中静置培养。第7天换液,弃悬浮细胞。以后每3~4天换液1次,待原代细胞生长融合达到80%以上进行传代培养,取第4代细胞作为实验细胞。进行免疫荧光染色,证实获得SH3+、CD34-、CD44+、CD54+和CD105+的单核细胞为MSCs。
1.2.2不同低氧分压下MSCs细胞增殖率的MTT法检测 实验分为低氧组和常氧组(21%),低氧组再分2%、4%、6%、8%氧分压组(分别为低氧1组、低氧2组、低氧3组、低氧4组)。取第4代MSCs消化后,用含10%胎牛血清α-MEM培养基配制成4×104个/mL的细胞悬液。将细胞接种于96孔板中,每孔加入200 μL细胞悬液,每组每个时间点设5个复孔。按照分组情况,将实验组细胞放置于预先设置好氧分压的三气培养箱中,常氧组细胞放置于5%CO2孵箱中静置培养。3~4天换液1次。在1、3、5、7、9 d 5个时间点,取出96孔板,采取MTT法,用酶联免疫检测仪在490 nm波长下测定其调零后的光吸收度值(OD值)。
1.2.3不同低氧分压下MSCs细胞ALP活性检测 实验分组同1.2.2。取第4代MSCs消化后,配制成1×105个/mL的细胞悬液,接种于25 cm2培养瓶里,每瓶加入2 mL细胞悬液,每组每个时间点设3个复瓶。按照分组情况,将实验组细胞放置于预先设置好氧分压的三气培养箱中,常氧组细胞放置于5%CO2孵箱中静置培养。3~4天换液1次。在1、3、5、7、9 d 5个时间点收集需要检测的细胞,待样品全部收集完成后送检。送检前,反复冻融3次,形成冻融液。按试剂使用说明处理收集的样本,用酶联免疫检测仪在405 nm波长下测定其OD值,再乘以系数1 383求出样本中ALP活力(U/L)。同时相同办法计算出细胞内总蛋白含量(mg/mL)。最后计算单位蛋白含量的相对ALP活性,计算公式为:
1.2.4不同低氧分压下MSCs细胞COLⅠ的检测 实验分组同1.2.2。取第4代MSCs消化后,配制成1×105个/mL的细胞悬液。将细胞接种于6孔板中的玻璃片上,每张加入1 mL细胞悬液,每组每个时间点设5张复片。按照分组情况,将实验组细胞放置于预先设置好氧分压的三气培养箱中,常氧组细胞放置于5%CO2孵箱中静置培养。3~4天换液1次。在1、3、5、7、9 d 5个时间点,取出6孔板,采用streptavidin biotin-peroxidase complex method(SABC法)对MSCs进行免疫细胞化学染色。第一抗体为COLⅠ兔抗鼠多克隆抗体,第二抗体为链酶亲和素化山羊抗兔IgG。设置阴性对照(用PBS液代替一抗,其余条件不变)。采用图像分析系统对染色切片进行检测。在200倍显微镜下将每张切片按系统抽样法随机选择4个视野测定棕黄色阳性颗粒的总面积及平均透光度。然后,通过计算平均积分光密度值(integrated optical density,IOD值)得出阳性染色强度,试算公式为:
平均IOD值=平均透光度×平均阳性面积 (2)
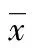
2 结 果
2.1MTT法检测MSCs细胞增殖率结果 MSCs在低氧微环境中生长时,OD值均较其在常氧微环境中生长的OD值高,其中低氧2组最明显。在第1、3天各低氧组的OD值变化幅度较小,至第5天各组的OD值变化幅度开始增加,第7、9天各低氧组OD值增加明显,而常氧组OD值增加较平缓。各低氧组的OD值与常氧组比较,在第5、7、9天均差异有统计学意义(P<0.05),显示低氧微环境能促进MSCs的增殖活性。其中,在4%氧分压为微环境中,MSCs增殖活动最为活跃,但与其他各低氧组比较其OD值差异无统计学意义(P>0.05),见表1。
2.2MSCs细胞ALP活性定量检测结果 培养第1天时各低氧组与常氧组的MSCs细胞内ALP表达活性均较弱,随着培养时间的延长,各低氧组与常氧组MSCs细胞内ALP表达活性逐渐增强,常氧组的ALP表达活性变化幅度较大,而各低氧组升高较平缓。第3、5、7、9天时各低氧组与常氧组比较,差异有统计学意义(P<0.05);在各个低氧组内,第7、9天时低氧1组与低氧4组间差异有统计学意义((P<0.05),见表2。
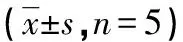
表1 各低氧组与常氧组MSCs细胞的OD值比较
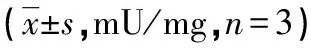
表2 各组 MSCs细胞 ALP活性比较
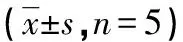
表3 各组MSCs细胞内COLⅠ的IOD值比较
2.3各组MSCs细胞COLⅠ免疫细胞化学染色结果 各低氧组MSCs细胞内COLⅠ表达均较弱,常氧组COLⅠ表达相对较强。随着时间延长,各低氧组MSCs细胞内COLⅠ增加较平缓,常氧组COLⅠ表达变化幅度相对较大。第7、9天时各低氧组与常氧组比较,差异有统计学意义(P<0.05);但各时间点各低氧组内的差异均无统计学意义(P>0.05),见表3。
3 讨 论
在骨组织工程学应用上,通常采用的方法是从体内获得一定数量的种子细胞,然后在体外进行扩增,之后将其附于一生物相容性以及力学性能良好的支架材料上,移植入体内相应组织缺损处进行修复[1-3]。但是,以往通常忽略了一个这样的问题,在体外扩增时,细胞处于一个常氧(21%)状态之下,而移植入体内组织缺损处后,因为缺损组织血管化过程需要一定时间,所以种子细胞一开始是处于一个相对低氧的微环境中,以后随着血管化的逐渐形成,微环境的氧分压逐渐回升,但就骨组织而言,始终无法达到21%氧分压的环境中[4-7]。因此,常常在体外实验中研究种子细胞(如MSCs)的增殖以及成骨向分化的生物学行为,这与将种子细胞置于低氧微环境中生长时的生物学行为相比,可能会有很大的出入。而研究低氧微环境下种子细胞增殖、成骨向分化的生物学行为,对于以后的相关实验动物研究以及临床应用更有实际意义。因此本课题以此为出发点,设计研究MSCs在2%、4%、6%、8%、21%氧分压环境下的增殖活性以及成骨向分化能力,为将其作为种子细胞应用于牙周骨组织工程学上提供实验依据。
对于实验所选择的氧分压,本课题尽量模拟种子细胞移植入骨缺损处所经历的一个氧分压变化。但是这个影响因素很多,如骨缺损的大小势必会影响细胞所处的氧环境,缺损较大,相应组织血管化就会减慢,多数细胞会较长时间处于低氧环境中,反之,缺损小,组织血管化进程快,血管化面积大,相应细胞就会处于一较高氧分压的环境中;而且移植处组织的血流受阻情况也存在各种差异,这些也会影响到移植种子细胞所处的氧环境。有研究表明,骨髓组织为一相对缺氧组织,其氧分压范围为1%~7%。本课题选择了氧分压为2%、4%、6%、8%、21%作为细胞生长的微环境,一方面希望选择的这个范围能尽可能真实反映种子细胞移植到缺损处所经历的一个氧分压变化范围;另一方面也希望通过这几个氧分压的选择,能研究出MSCs在不同氧分压下生物学行为的一个变化规律,为以后的进一步研究提供实验依据。
本实验中采取MTT比色试验用于检测细胞的增殖率。MTT法的检测原理是活细胞线粒体内的琥珀酸脱氢酶能够使外源性的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(商品名噻唑蓝,简称MTT)还原为难溶性的蓝紫色结晶物甲臜,沉积在细胞中,用二甲基亚砜溶解细胞中的甲臜,最后用酶联免疫检测仪在490 nm波长处测定其OD值,因为MTT结晶物形成的量与细胞数成正比关系,所以该检测方法可以间接反映活细胞的数量。本实验中MTT法检测结果显示,各低氧组对MSCs的增殖活性有明显的促进作用,在4%氧分压时,其促进作用最为明显。这与国外有关研究结果一致,即低氧环境促进MSCs的增殖[6,8-10]。从细胞增殖活性上看,低氧预处理的MSCs细胞作为种子细胞是相当有利的。但是,也要考虑到的就是MSCs细胞处于低氧环境下的分化情况,特别是成骨向分化的情况,这也是本研究选用其作为种子细胞的重要原因。
众所周知,成骨细胞早期分化的指标之一就是ALP活性的增加。ALP可以水解有机磷酸酯,进而释放出磷酸盐,使得游离的磷酸盐与钙发生结合,形成磷酸钙,磷酸钙再沉积在细胞周围基质的胶原中,最终形成了新生骨。众多实验证实,没有ALP的生成,骨组织钙化就不会发生。从骨组织结构来看,是由2/3的无机物和1/3的有机物构成,其中COLⅠ就占到了有机物中的80%~90%,对骨组织结构的完整、、生物力学的维持起着重要的作用。COLⅠ构成骨组织的框架,其合成和分泌是骨组织形成的前提条件,加速它的合成分泌,可以明显促进骨组织的矿化进程。因此,本实验选取ALP和COLⅠ作为检测指标,用于观察MSCs细胞在不同低氧分压下成骨向分化的情况。从本实验的数据可以看出,低氧微环境抑制MSCs细胞ALP活性和细胞内COLⅠ的表达,也抑制MSCs细胞成骨向分化,而且这种抑制作用与氧分压有关,氧分压越低其抑制作用越明显。这与有关研究结果一致,即认为低氧环境抑制MSCs内ALP以及COLⅠ的表达,抑制MSCs成骨向分化[11-13]。 但也有研究却认为低氧环境能促进MSCs内ALP以及COLⅠ的表达[14-15]。其研究结果的差异性可能为细胞模型不同,或培养条件不同所造成。
以上实验说明在运用组织工程学方法修复牙周骨缺损中,通过低氧预处理的MSCs细胞仅能增加其增殖活性但不利于MSCs细胞ALP活性和COLⅠ的表达,也极不利于MSCs细胞的成骨向分化。以后的研究应该进一步明确其抑制成骨向分化的作用机制,以期在体外细胞培养中加以干预,使其移植入缺损后更有利于骨组织的形成。
[1]Kumbar SG,Toti US,Deng M,et al.Novel mechanically competent polysaccharide scaffolds for bone tissue engineering[J].Biomed Mater,2011,6(6):3265-3273.
[2]Klein JD,Fauza DO.Amniotic and placental mesenchymal stem cell isolation and culture[J].Methods Mol Biol,2011,698(1):75-88.
[3]Oh JS,Ha Y,An SS,et al.Hypoxia-preconditioned adipose tissue-derived mesenchymal stem cell increase the survival and gene expression of engineered neural stem cells in a spinal cord injury model[J].Neurosci Lett,2010,472(3):215-219.
[4]Kubo M,Li TS,Suzuki R,et al. Hypoxic preconditioning increases survival and angiogenic potency of peripheral blood mononuclear cells via oxidative stress resistance[J].Am J Physiol Heart Circ Physiol,2008,294(2):590-595.
[5]Brahimi-Horn MC,Chiche J,Pouysségur J.Hypoxia signaling controls metabolic demand[J].Curr Opin Cell Biol,2007,19(2):223-231.
[6]D′Ippolito G,Diabira S,Howard GA,et al.Low oxygen tension inhibit s osteogenic differentiation and enhances stemness of human MI2 AM I cells[J].Bone,2006,39(3):513-519.
[7]Tang YL,Zhu W,Cheng M,et al.Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR-4 expression[J].Circ Res,2009,104(10):1209-1216.
[8]NaganoM,KimuraK,YamashitaT,et
al.Hypoxia responsive mesenchymal stem cells derived from human umbilical cord blood are effective for bone repair[J].Stem Cells Dev,2010,19(8):1195-1210.
[9]Gruber R,Kandler B,Agis H,et al.Bone cell responsiveness to growth and differentiation factors under hypoxia in vitro[J].Int J Oral Maxillofac Implants,2008,23(3):417-426.
[10]Volkmer E,Kallukalam BC,Maertz J,et al.Hypoxic preconditioning of human mesenchymal stem cells overcomes hypoxia-induced inhibition of osteogenic differentiation[J].Tissue Eng Part A,2010,16(1):153-164.
[11]Kanichai M,Ferguson D,Prendergast PJ,et al.Hypoxia promotes chondrogenesis in rat mesenchymal stem cells:a role for A KT and hypxia2 inducible factor(HIF)2 alpha[J].J Cell Physiol,2008,216(3):708-716.
[12]Bessa PC,Casal M,Reis RL.Bone morphogenetic proteins in tissue engineering:the road from the laboratory to the clinic,part I(basic concepts)[J].J Tissue Eng Regen Med,2008,2(1):1-13.
[13]Usami K,Mizuno H,Okada K,et al.Composite implantation of mesenchymal stem cells with endothelial progenitor cells enhances tissue-engineered bone formation[J].J Biomed Mater Res A,2009,90(3):730-741.
[14]金小岚,郎红梅,万勇,等.不同氧浓度对骨髓基质细胞向成骨细胞分化的影响[J].中国病理生理杂志,2010,26(5):982-985.
[15]Pietrogrande L,Raimondo E,Fossali A,et al.Biological and pharmacological factors influencing the fracture healing[J].Aging Clin Exp Res,2011,23(2 Suppl):S65-68.
