乳腺癌MDA-MB-231细胞源exosomes对血管内皮细胞EGFR表达的影响*
2012-01-03谢莹珊范维柯
谢莹珊,沈 宜,隆 霜,范维柯,姜 蓉,陈 黎
(重庆医科大学干细胞与组织工程研究室 400016)
乳腺癌是女性最常见的恶性肿瘤之一,近年来中国乳腺癌发病率呈快速上升趋势。乳腺癌的转移是影响生存期的主要因素之一。肿瘤内血管新生是一种病理性血管生长,与肿瘤的生长、侵袭和转移密切相关。肿瘤内血管新生不仅为原发肿瘤生长所必须,也是肿瘤细胞向远处转移的必备条件之一。血管内皮细胞是肿瘤血管新生的重要效应细胞,对肿瘤血管内皮细胞生长机制的研究虽已进行多年,但对肿瘤细胞与周围血管内皮细胞之间有怎样联系、对肿瘤血管内皮细胞的病理性生长的分子机制目前还不清楚。深入研究其分子机制,有助于寻找有效的靶点,特异抑制肿瘤血管内皮细胞生长,对提高乳腺癌治疗效果有重大意义。
目前对细胞分泌exosomes研究显示,exosomes能将其携带的蛋白质、mRNA及miRNA选择性地递送至受体细胞,在细胞间传递信息,在炎症、妊娠、病原微生物转播中发挥生物学作用。有研究发现肿瘤组织中血管内皮细胞往往表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达[1-3]。本研究通过体外共培养人脐静脉内皮细胞株(human umbilical vein endothelial cell,HUVECs)与人乳腺癌细胞株MDA-MB-231源exosomes,探讨乳腺癌细胞MDA-MB-231源exosomes对血管内皮细胞EGFR表达的影响。
1 材料与方法
1.1材料 HUVECs与人乳腺癌细胞株MDA-MB-231由本研究室提供,复苏后使用。RPMI1640培养基、DMEM高糖、新生牛血清购自美国Gibco公司,重水购自青岛腾龙微波科技有限公司,分析纯蔗糖购自上海生工生物有限公司,链霉亲和素-生物素-过氧化物酶复合物(SABC)试剂盒、DAB酶底物显色试剂盒购自武汉博士德生物工程有限公司,二辛可酸(BCA)蛋白定量试剂盒、预染蛋白标准品、Western blot试剂盒、ECL试剂盒、增强型化学发光试剂盒购自南京碧云天公司,兔抗人EGFR多克隆抗体购自美国Santa Crus,聚偏二氟乙烯膜(PVDF膜)购自美国Millpore公司,EGFR及GAPDH特异性引物购自成都天泰公司,RNAisoTMPlus总RNA提取试剂盒、cDNA合成试剂盒、PCR扩增试剂盒购自日本Takara公司,DNA Marker、Gold view核酸染料购自北京天根公司。
1.2方法
1.2.1细胞培养 MDA-MB-231细胞系与HUVECs细胞系分别置于含10%新生牛血清RPMI1640与DMEM培养基中培养,37 ℃、5%CO2培育箱内孵育,0.25%胰蛋白酶消化传代。收集培养2 d肿瘤细胞上清液共200 mL,-20 ℃保存。
1.2.2exosomes制备及蛋白定量 参照文献[4]采用超速离心及密度梯度离心法提取MDA-MD-231细胞exosomes(此法为本实验室常规提取exosomes的方法,前期实验中已成功鉴定),0.22 μm滤膜过滤分装,-80 ℃保存。BCA蛋白定量法测定exosomes样品总蛋白量,步骤按照产品说明书进行。
1.2.3免疫细胞化学法检测MDA-MB-231细胞EGFR表达 取5×104/mL对数生长期细胞悬液进行爬片,每孔2 mL,置于37 ℃、5%CO2培养箱中培养,使细胞铺满约80%时进行免疫细胞化学染色测定。吸弃培养液,室温下PBS洗2次,每次2 min;4%多聚甲醛固定30 min,PBS洗3次,每次3 min;3%H2O2封闭内源性过氧化物酶,室温下放置15 min,PBS洗3次,每次3 min;滴加5%牛血清清蛋白封闭液,室温20 min;吸弃多余液体,不洗;滴加1∶40稀释的兔抗人EGFR一抗,37 ℃孵育1 h;PBS洗3次,每次2 min;滴加生物素化山羊抗兔IgG,37 ℃孵育20 min;PBS洗3次,每次5 min;滴加试剂SABC,37 ℃孵育20 min;PBS洗4次,每次5 min;DAB显色:取1 mL蒸馏水,加A、B、C试剂各一滴,混合后加至玻片,室温显色,显微镜下控制反应时间;苏木素复染2 min,自来水冲洗10 min。脱水,透明,封片。显微镜下观察,照相。
1.2.4Western blot法检测MDA-MB-231细胞、exosomes及HUVECs EGFR蛋白表达 取对数生长期细胞,PBS洗3次,每瓶细胞各加入200 μL RIPA细胞裂解液和2 μL苯甲基磺酰氟(PMSF),置冰上充分裂解,将裂解物移至不同离心管(EP)中,4 ℃,12 000 g离心30 min,收集上清液,BCA法蛋白定量。 exosomes经超声破碎后BCA法测蛋白浓度,各取40 μg上样于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);蛋白质通过湿转法转至PVDF膜上,用含8%脱脂牛奶的TBST溶液室温封闭2 h,加入兔抗人EGFR一抗(1∶200),4 ℃过夜;加入辣根过氧化物酶标记的山羊抗兔二抗(1∶2 000),室温下结合1 h;TBST充分洗涤3次,加入ECL显影剂,显影定影后于凝胶成像系统曝光,观察结果。
1.2.5HUVECs与exosomes共培养体系 常规传代HUVECs细胞,待细胞贴壁后弃上清液,加入含终浓度为200 μg/mL的exosomes新鲜培养液(实验组),同时设置细胞无exosomes处理(对照组),继续置培养箱培养24 h即可做进一步检测。
1.2.6免疫细胞化学法检测实验组HUVECs EGFR的表达 方法同1.2.3。结果根据显微镜下细胞着色的数目评分,进行半定量计数以评价EGFR蛋白的表达。在高倍镜下随机选取5个视野,计算染色阳性的细胞占所计数细胞的百分比,取各视野区的平均值作为终值。
1.2.7RT-PCR法检测MDA-MB-231细胞与实验组HUVECs细胞 EGFR mRNA的表达 常规消化细胞,离心后弃上清液,用预冷PBS洗涤细胞2次,细胞计数,分别收集1×107个MDA-MB-231细胞和HUVECs细胞,分别加入1 mL的RNAisoTMplus提取总RNA。按逆转录试剂盒合成cDNA,再以cDNA为模板进行PCR反应。EGFR上游引物序列:5′-CAA AGT GCC TAT CAA GTG G-3′,下游引物序列:5′-GAA TTG TTG CTG GTT GCA-3′,扩增片段长度为513 bp;GAPDH上游引物序列:5′-AGA AGG CTG GGG CTC ATT TG-3′,下游引物序列:5′-AGG GGC CAT CCA CAG TCT TC-3′,扩增片段长度为258 bp。EGFR逆转录反应条件37 ℃ 15 min,85 ℃ 5 s。PCR反应条件为94 ℃ 5 min,循环1次;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,循环30次;72 ℃延伸5 min结束PCR反应。各取5 μL产物与1 μL 6×上样缓冲液混匀后进行琼脂糖凝胶电泳,100 V恒压电泳30 min。电泳结束后取出琼脂糖,紫外分析仪下观察结果,凝胶成像系统成像,使用Quantity One软件进行分析。
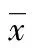
2 结 果
2.1免疫细胞化学法检测MDA-MB-231细胞EGFR表达 MDA-MB-231细胞的细胞质和细胞膜均呈现棕黄色颗粒均匀分布,为EGFR蛋白阳性表达,见封2图1。
2.2Western blot法检测MDA-MB-231细胞、exosomes及HUVECs EGFR蛋白表达 EGFR相对分子质量为170×103,PVDF膜经化学发光后可见MDA-MB-231细胞及exosomes的EGFR蛋白呈阳性反应带,HUVECs呈阴性反应带,见图2。

1:MDA-MB-231细胞;2:MDA-MB-231细胞源exosomes;3:HUVECs。
2.3免疫细胞化学法检测HUVECs EGFR的表达 实验组HUVECs与exosomes混合培养24 h后,镜下可见部分HUVECs细胞质有淡黄色或棕黄色颗粒,EGFR阳性表达率为(21.4±3.1)%,与对照组(无EGFR蛋白表达)比较,差异有统计学意义(P<0.01),见插Ⅰ图3。
2.4RT-PCR法检测MDA-MB-231细胞与实验组HUVECs细胞EGFR mRNA的表达 MDA-MB-231细胞在513 bp处可见一条明显的扩增条带,而实验组HUVECs细胞未见EGFR 513 bp的扩增产物,见图4。
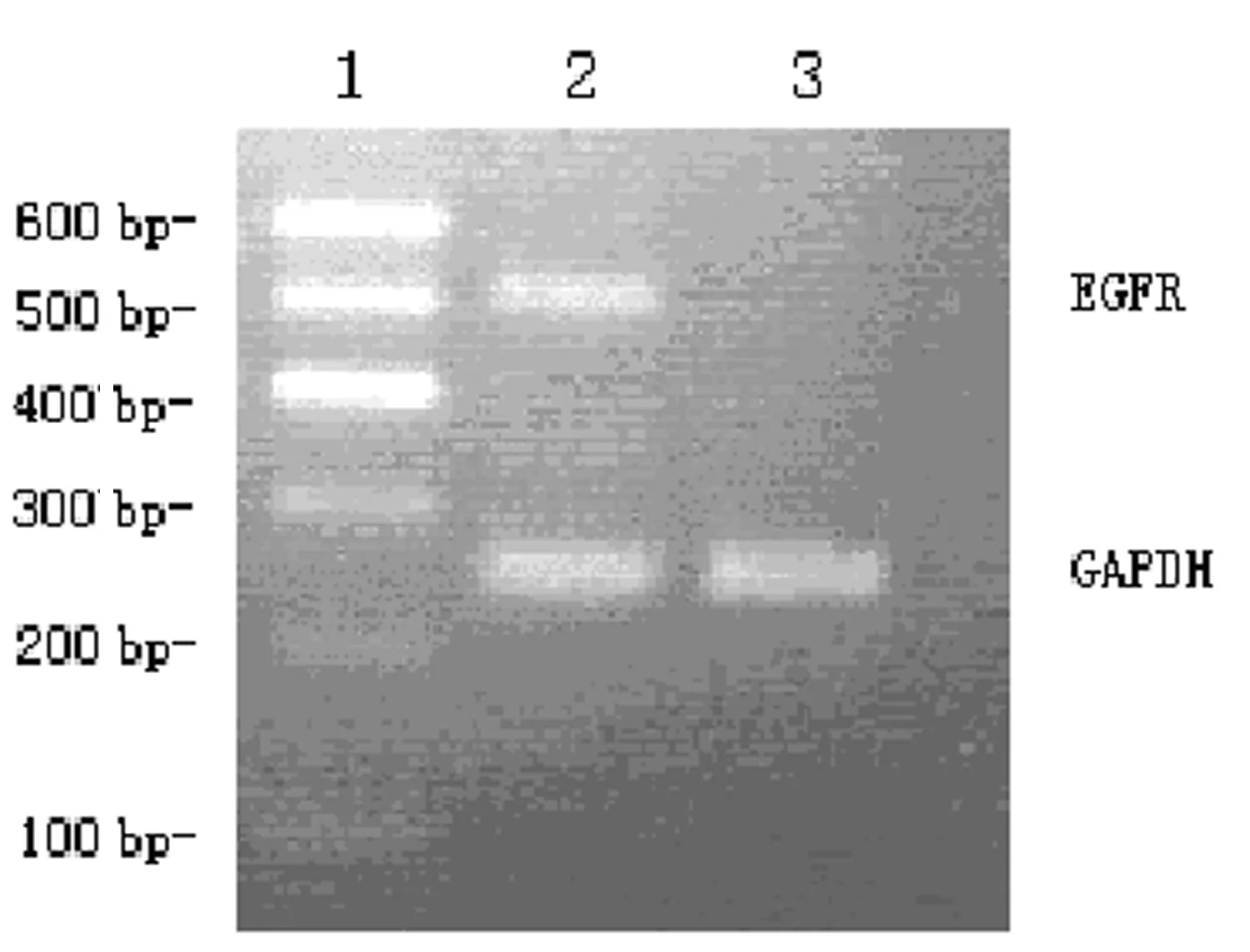
1:DNA 标记物;2:MDA-MB-231细胞;3:实验组HUVECs细胞。
3 讨 论
EGFR或HER-1/erbB1是首先发现的HER/erbB家族跨膜受体酪氨酸激酶成员,该家族成员还包括HER-2/erbB2、HER-3/erbB3、HER-4/erbB4,有高度同源的酪氨酸序列和相似的结构特征[5]。EGFR基因位于7P11-13,编码蛋白相对分子质量为170×103,是一种跨膜分布的细胞表面传感器。EGFR在非活性状态下是单体,与配体结合后形成同源或异源二聚体,细胞内区的酪氨酸激酶活化,酪氨酸残基位点发生自身磷酸化,进而激活Ras-Raf-MAPK、PI3K/AKT、JAK/STAT等多条信号转导途径[6],将信号由细胞质转到细胞核内,启动DNA复制、引起细胞增殖、抑制细胞凋亡、促进肿瘤浸润和转移等。
EGFR表达异常主要表现为EGFR过表达和(或)突变,研究发现,EGFR在多种肿瘤中有不同程度的表达,头颈部鳞癌中表达率为90%~100%,肺癌中表达率为40%~80%,肾癌中表达率为50%~90%,结直肠癌中表达率为25%~77%,卵巢癌中表达率为25%~70%,前列腺癌中表达率为39%~47%,神经胶质瘤中表达率为40%~63%,乳腺癌中表达率为14%~90%[7]。EGFR的过表达和(或)突变与肿瘤细胞增殖、新生血管形成、侵袭、转移、抗凋亡及对放疗耐受等密切相关。
有研究表明,人体正常血管内皮细胞不表达EGFR,表皮生长因子(EGF)对体外培养的HUVECs增殖迁移没有影响,而当HUVECs与高表达EGFR的人表皮鳞状细胞癌A431细胞混合培养后,EGF的刺激可提高HUVECs的迁移能力,并且在EGF的刺激下,A431细胞通过旁分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)和IL-8这两种正向调节血管生成因子来刺激内皮细胞增殖[8]。另一体外研究发现当肿瘤细胞分泌大量转化生长因子(TGF)-α和EGF时会发生肿瘤血管生成作用,此时在血管内皮细胞上可发现正常时并不表达的EGFR[9],但是肿瘤血管内皮细胞异常表达EGFR的机制仍不十分清楚。
exosomes是由细胞内多泡体(multivesicular body,MVB)与质膜融合后释放到细胞外的一种直径为30~100 nm的膜性小囊泡。当细胞经内吞途径将外来内吞物质转变成早期核内体(early endosome,EEs)时,其内可包含外来抗原物质,随后EEs的膜囊内陷、突入,形成多个囊泡状结构,并选择性接受细胞质内的蛋白成分及脂类,此时的EEs被称为晚期核内体(late endosomes,LEs),即多泡体(MVB),囊泡状结构称为exosomes。MVB移向质膜并与质膜融合后将exosomes释放至细胞外。exosomes通常是从细胞培养的上清液或肿瘤组织的各种渗出液中分离,在电镜下显示为脂质双分子的扁平或球形小体,可以悬浮于蔗糖密度梯度溶液中,因此,通过超速离心及蔗糖密度梯度离心即可将其他杂质与exosomes分离开,本课题组在前期实验中采用此法分离并已成功鉴定肿瘤细胞来源的exosomes[4]。exosomes主要是由蛋白质和脂质构成,目前通过蛋白质组学方法对不同细胞来源的exosomes的研究发现,不同来源的exosomes中蛋白质不同,主要分为普通蛋白质和细胞特异性蛋白质[10]。其中特异性蛋白质牵涉到来源细胞的功能,而exosomes的功能亦取决于来源细胞[11]。在本实验中,用Western blot法检测高表达EGFR的乳腺癌MDA-MB-231细胞来源的exosomes也同时表达EGFR。exosomes被释放至细胞外后选择性地与受体细胞结合。目前exosomes与受体细胞结合的方式仍不十分清楚,国外研究者提出3种假设[12-14]:(1)exosomes的膜蛋白与细胞表面的特异性受体结合从而激活细胞内信号;exosomes膜蛋白被蛋白酶水解后的蛋白片段亦可作为可溶性配体与受体细胞表面的受体结合。(2)与受体细胞膜直接融合并将内容物释放至受体细胞的细胞液中,蛋白质组学研究发现exosomes含有大量的促融合蛋白——CD9[15]。与受体细胞膜融合后可改变受体细胞的膜蛋白表达和脂质成分,从而影响和改变其生物学功能,释放内容物(如蛋白、mRNA或miRNA)至受体细胞,可激活多种细胞信号。(3)被受体细胞内吞并再次释放至邻近细胞发挥其生物学效应。
细胞间的相互作用在肿瘤进展、血管生成和侵袭中起至关重要的作用[16]。为了探讨exosomes在肿瘤微环境中的作用,在实验中将MDA-MB-231细胞来源的exosomes与HUVECs共培养,观察exosomes携带的EGFR在二者之间的传递。结果发现,浓度为200 μg/mL的exosomes与HUVECs共培养24 h后,免疫细胞化学显示部分HUVECs细胞胞质有淡黄色或棕黄色颗粒,EGFR阳性表达率为(21.4±3.1)%。提示原本不表达EGFR的正常HUVECs已经开始异常表达EGFR。随后,采用RT-PCR法分别检测MDA-MB-231细胞与HUVECs EGFR的mRNA表达,结果发现MDA-MB-231细胞的EGFR mRNA表达为阳性,经exosomes处理24 h后HUVECs的EGFR mRNA表达仍然为阴性,进一步证实EGFR是由exosomes介导传递至HUVECs,而不是其内源性基因表达。
综上所述,本研究结果显示MDA-MB-231细胞源exosomes携带癌基因EGFR,并可介导其向周围血管内皮细胞转移,这可能是乳腺癌组织中血管内皮细胞异常表达EGFR的一种方式,将为今后的乳腺癌生物诊断和治疗提供新的靶点。
[1]De Luca A,Carotenuto A,Rachiglio A,et al.The role of the EGFR signaling in tumor microenviroment[J].J Cell Physiol,2008,214(3):559-567.
[2]Kuwai T,Nakamura T,Sasaki T,et al.Phosphorylated epidermal growth factor receptor on tumor-associated endothelial cells is a primary target for therapy with tyrosine kinase inhibitors[J].Neoplasia,2008,10(5):489-500.
[3]Amin DN,Hida K,Bielenberg DR,et al.Tumor endothelial cells expression epidermal growth factor receptor(EGFR) but not erbB3 and are responsive to EGF and to EGFR kinase inhibitors[J].Cancer Res,2006,66(4):2173-2180.
[4]李静,沈宜,汤为学,等.小鼠肝癌细胞H22源exosomes的制备及其免疫相关蛋白的初步研究[J].中华肝脏病杂志,2007,15(6):437-440.
[5]Wells A.EGF receptor[J].Int J Biochem Cell Biol,1999,31(6):637-643.
[6]Klapper LN,Kirschbanm MH,Sela M,et al.Biochemical and clincal implications of the Erb/HER signaling network of growth factor receptors[J].Adv Cancer Res,2000(77):25-79.
[7]Qu JL,Qu XJ,Zhao MF,et al.Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation[J].Dig Liver Dis,2009,41(12):875-880.
[8]Hirata A,Ogawa S,Kometani T,et al.ZD1839(Iressa) induces antiangiogenic effects through inhibition of epidermal growth factor receptor tyrosine kinase[J].Cancer Res,2002(62):2554-2560.
[9]Sasaki T,Kitadai Y,Nakamura T,et al. Inhibition of epidermal growth factor receptor and vascular endothelial growth factor receptor phosphorylation on tumor-associated endothelial cells leads to treatment of orthotopic human colon cancer in nude mice[J].Neoplasia,2007,9(12):1066-1077.
[10]Thery C,Zitvoge L,Amigorena S.Exosome:composition,biogenesis and function[J].Nat Rev Immunol,2002,2(8):569-579.
[11]Jeffrey SS,Sanchita B.Exosome fuction:from tumor immunology to pathogen biology[J].Traffic,2008,9(6):871-881.
[12]Cocucci E,Racchetti G,Meldolesi J.Shedding microvesicles:artefacts no more[J].Trends Biol,2008,19(2):43-51.
[13]Simons M,Raposo G.Exosomes-vesicular carriers for intercellular communication[J].Curr Opin Cell Biol,2009,21(4):575-581.
[14]Mathivanan S,Ji H,Simpson RJ.Exosomes:extracellular organelles important in intercellular communication[J].J Proteomics,2010,73(10):1907-1920.
[15]Thery C,Regnault A,Garin J,et al.Molecular chatacterization of dendritic cell- derived exosomes.Selective accumulation of the heat shock protein hsc73[J].J Cell Biol,1999,147(3):599-610.
[16]Al-Nedawi K,Meehan B,Rak J.Microvesicles:messengers and mediators of tumor progression[J].Cell Cycle,2009,8(13):2014-2018.
