非水相介质杂醇油酶法转化天然酯类香料的研究
2011-12-28王成涛丁晓英张佳婵孙宝国
王成涛 丁晓英 张佳婵 赵 磊 孙宝国
(1.北京工商大学食品添加剂与配料北京高校工程研究中心,北京 100048;2.北京市食品风味化学重点实验室,北京 100048)
非水相介质杂醇油酶法转化天然酯类香料的研究
王成涛 丁晓英 张佳婵 赵 磊 孙宝国
(1.北京工商大学食品添加剂与配料北京高校工程研究中心,北京 100048;2.北京市食品风味化学重点实验室,北京 100048)
为提高杂醇油的利用率和附加值,研究非水相条件下杂醇油的脂肪酶催化酯化反应,优化其转化为天然酯类香料的工艺条件。结果表明,酶用量、分子筛用量、乙酸加入次数及间隔时间、摇床转速、反应温度、反应时间等因素条件对产物酯的生成有重要影响,采用间歇式加酸、加入适量分子筛吸水剂可明显提高混合酯得率。在正己烷10mL、杂醇油3mL、乙酸1.5mL的反应体系中,正交试验设计优化后的工艺条件(乙酸异戊酯产率最高时):脂肪酶Novozym 435FG用量70mg、乙酸分6次加入、加入乙酸间隔时间3h、分子筛用量2g、摇床转速140r/min、反应温度45℃、反应时间36h。该条件下,乙酸异戊酯、乙酸异丁酯和乙酸丙酯的产率分别为90.1%,91.3%,78.1%。
杂醇油;脂肪酶;非水相;酶法转化;天然酯类香料
杂醇油是以生物质原料发酵生产酒精的副产物,主要成分为异戊醇(约含45%)、异丁醇、丙醇等[1]。目前,中国对杂醇油的利用主要有两条途径[2]:① 杂醇油经精制分馏得到C2~C3低碳混合醇、C4醇和异戊醇,作为燃料或溶剂等。② 硫酸催化酯化杂醇油制备混合酯。利用相转移催化剂、浓硫酸进行酯化反应,需要在80℃以上,浓硫酸具有强烈腐蚀性,易腐蚀生产设备,不符合环境友好生产的要求。
非水相酶催化是指生物酶在非水介质中进行的催化反应。1986年Klibanov[3]发表了关于有机介质中酶催化的条件和特点。近30年来,非水相酶催化研究取得较大进展,非水相体系中生物酶催化合成短链酯、糖酯、肽、手性醇、葡萄糖苷、生物柴油等研究[4-11]都取得了重大突破。本试验以杂醇油和发酵乙酸为主要原料,以筛选出的脂肪酶Novozym 435FG为催化剂,研究正己烷反应体系中反应因素条件对产物酯产率的影响,优化其转化工艺条件,为杂醇油的综合利用,提高其附加值提供指导。
1 材料与方法
1.1 试剂与仪器
乙酸异戊酯、乙酸异丁酯、乙酸丙酯、乙酸、正己烷:AR级,国药化学试剂公司;
脂肪酶 Novozym 435FG:来源于 Candida Antarctica B型脂肪酶;
有机相滤膜:孔径0.45μm,天津市津腾实验设备有限公司;
杂醇油:山东裕方生物化工有限公司;
去离子水、高纯水:本实验室自制;
高速台式离心机:TGL-10C,上海安亭科学仪器厂;
恒温摇床:HQ45,中国科学院武汉科学仪器厂;
集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司;
气相色谱-质谱仪:6890N-5975C,安捷伦公司。
1.2 方法
1.2.1 酯类香料的生成条件 在正己烷10mL、杂醇油3mL、乙酸1.5mL的反应体系中,研究脂肪酶Novozym 435FG用量、乙酸加入次数、乙酸加入间隔时间、分子筛用量、摇床转速、反应温度、反应时间等反应条件对混合酯产率的影响。一次性注射器吸取1.5mL反应体系上清液,0.45μm滤膜过滤,吸取100μL、正己烷定容至5mL容量瓶,气-质联机测定产物酯含量[4]。
1.2.2 气-质联机测定产物酯的色谱条件 DB-WAX毛细管色谱柱(60×0.320×0.25),进样器温度250℃,进样量1.0μL,检测器温度250℃;柱温在60℃保持3min,以3℃/min升至90℃,以20℃/min上升到230℃,保持3min,共计23.5min;载气为氦气,总流量4.6mL/min,压力为1.101×105Pa。
1.2.3 酯类香料的产率 以乙酸异戊酯、乙酸异丁酯、乙酸丙酯为对照品(为外标物),气-质联机测定酯含量,绘制标准曲线;气-质联机测定各反应条件下产物酯含量,计算其产率[4]。
式中:
R——酯类香料的产率,%;
C1——产物乙酸异戊酯(或乙酸异丁酯或乙酸丙酯)的浓度,mg/mL;
M1——异戊醇(或异丁醇或正丙醇)的摩尔质量,g/mol;
M2——乙酸异戊酯(或乙酸异丁酯或乙酸丙酯)的摩尔质量,g/mol;
a——异戊醇(或异丁醇或正丙醇)所占比例;
b——正己烷反应体系体积,b=14.5mL。
1.2.4 固定化脂肪酶的回收 将含脂肪酶的反应液进行常压过滤,取出脂肪酶,用正己烷冲洗并且常温干燥。如此反复2次,置于冰箱内冷藏保存。
2 结果与讨论
2.1 杂醇油转化酯类香料工艺条件的单因素试验
在正己烷10mL、杂醇油3mL、乙酸1.5mL的反应体系中,选择Novozym 435FG用量70mg、乙酸分5次加入,乙酸加入间隔时间3h、分子筛用量2g、摇床转速140r/min、反应温度45℃、反应时间30h等7种因素条件,分别以其中之一为变量,固定其它参数,研究反应因素条件对混合酯产率的影响,其结果见图1~7。

图1 正己烷反应体系中脂肪酶用量对酯产率的影响Figure 1 Effect of lipase content on the ester yield rates in hexane reaction system
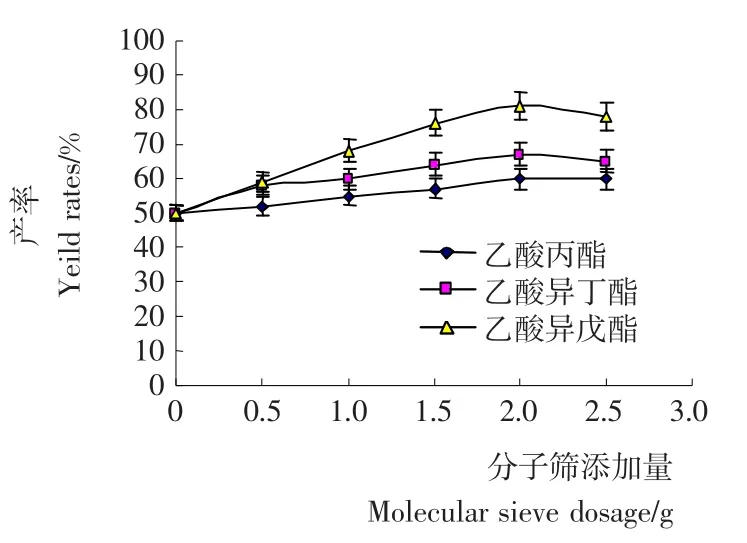
图2 正己烷反应体系中分子筛用量对酯产率的影响Figure 2 Effect of molecular sieve dosage on the ester yield rates in hexane reaction system.
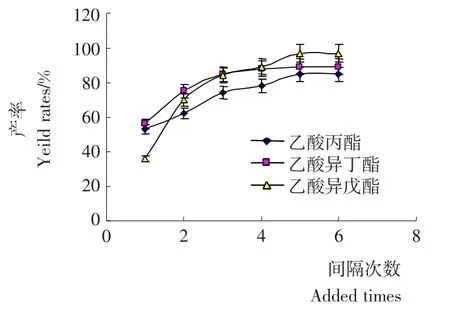
图3 正己烷反应体系中乙酸加入次数对酯产率的影响Figure 3 Effect of added times of acetic acid on the ester yield rates in hexane reaction system.
2.1.1 脂肪酶用量对混合酯产率的影响 由图1可知,当反应体系中脂肪酶用量为70mg,乙酸丙酯、乙酸异丁酯、乙酸异戊酯的产率达到峰值;在较低脂肪酶用量时,杂醇油与乙酸反应的速率和产率是随着脂肪酶Novozym 435FG的增加而不断增加,超过一定范围后继续增加酶用量,产率提高并不明显,这与常见水相的酶促反应体系中表现是一致的。但研究也发现,非水相脂肪酶酯化反应体系中,适当的含水量是维持脂肪酶空间构想、反应活性所必需的;过量增加酶用量,由于酶本身之间争夺必需水的竞争作用增强,会影响非水相催化反应的速率和酶催化活性。Sabeder等[5]研究果糖酯合成时也发现,非水相中脂肪酶过量增加,反而会使产物生成量下降,甚至反应停止。因此选择70mg脂肪酶作为后续试验的反应条件。
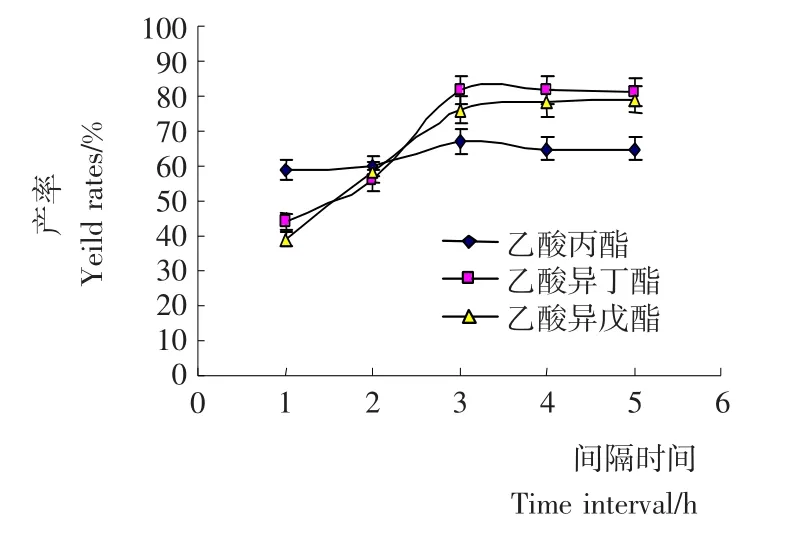
图4 正己烷反应体系中乙酸加入间隔时间对酯产率的影响Figure 4 Effect of time interval of acetic acid on the ester yield rates in hexane reaction system
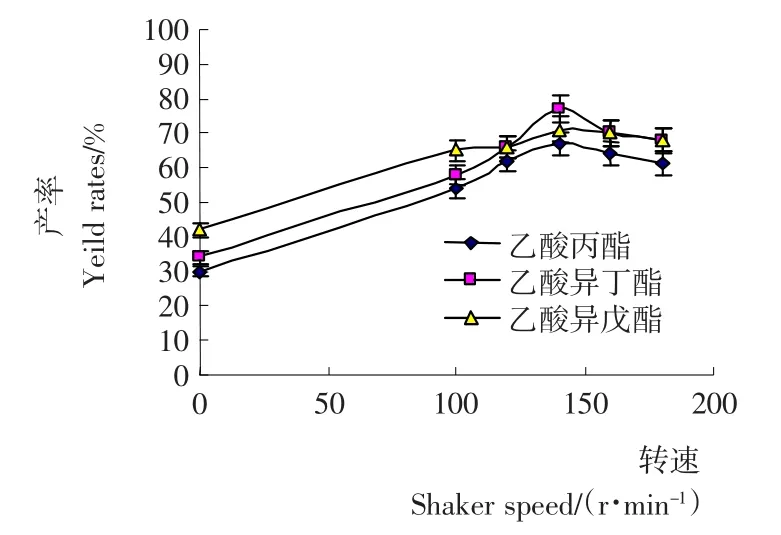
图5 正己烷反应体系中摇床转速对酯产率的影响Figure 5 Effect of shaker speed on the ester yield rates in hexane reaction system
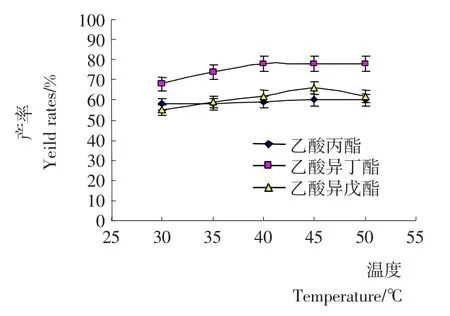
图6 正己烷反应体系中反应温度对酯产率的影响Figure 6 Effect of reaction temperature on the ester yield rates in hexane reaction system
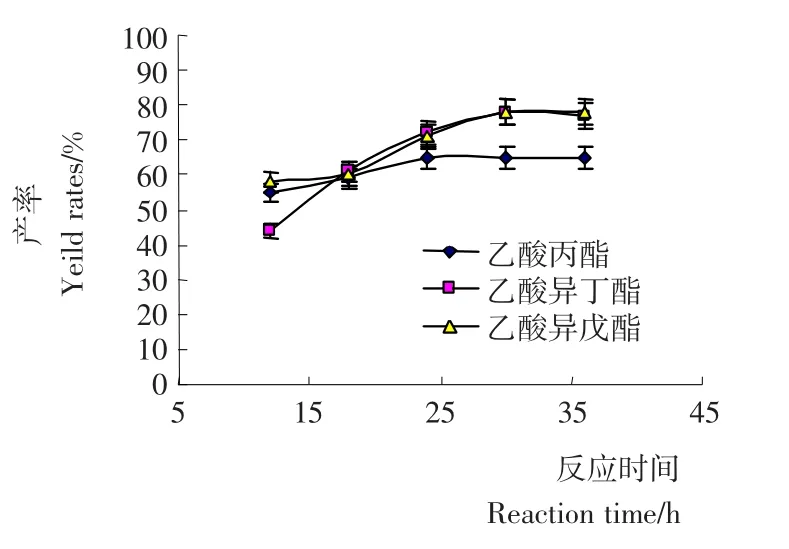
图7 正己烷反应体系中反应时间对酯产率的影响Figure 7 Effect of reaction time on the ester yield rates in hexane reaction system
2.1.2 分子筛用量对混合酯产率的影响 酯化反应是有水生成的可逆反应,且适当水量是非水相环境下脂肪酶保持活力所需。如果生成水不能有效移除,不仅会影响酯化反应进程,而且还会改变非水相条件下脂肪酶微环境,酶活性会降低甚至完全失活,降低酯得率[6]。分子筛是一种良好除水剂。由图2可知,随着分子筛用量的增加,混合酯产率逐渐增加,当分子筛用量为2g时,其酯产率达到最大值;添加分子筛过量时,反应体系中水分基本完全除去,会降低酶的柔性,导致酶活力降低、丧失。因此,分子筛用量2g作为后续反应条件。
2.1.3 乙酸加入次数对混合酯产率的影响 非水相脂肪酶催化反应体系中需要适当的水,由于底物乙酸的pH值低,过多的乙酸会降低脂肪酶的活性。图3比较了恒定乙酸用量、一次性或间歇分批加入乙酸对混合酯生成率的影响。乙酸一次性加入时,3种产物酯的生成量基本维持在40%~55%,即使延长反应时间至48h,产物生成量的增加也不明显;分批次慢慢向系统中加入乙酸,混合酯产率有明显上升,当乙酸分5次以上加入时产率基本达到峰值。由此可见,在低pH环境下,乙酸的强酸性及pH值影响了反应体系的微环境,进而影响和改变了脂肪酶的空间结构与酶活性,使酶的活性位点被“盖”起来,导致酶活性降低[7]。分批加入底物乙酸,有利于缓解低pH值作用,最大限度的提高酯产率。Romeroa等[4]在研究酶法合成乙酸异戊酯时发现过多乙酸或者乙酸酐用量会降低脂肪酶活性,采用过量异戊醇可缓解此类问题。因此,选择乙酸加入量为5次作为后续的反应条件。
2.1.4 乙酸加入间隔时间对混合酯产率的影响 在恒定乙酸用量、乙酸分5次加入的基础上,试验研究了乙酸加入间隔时间对酯产率的影响(图4)。结果表明随着乙酸加入间隔时间的增加,混合酯产率也是呈线性增加,当间隔时间≥3h,产率基本保持不变,因此选择乙酸加入间隔时间为3h。
2.1.5 摇床转速对产率的影响 在酶促酯化反应中底物的传质会对反应有一定影响,摇床转速表现出对产率有重要影响,随着摇床转速的提高,固定化酶在体系中充分散开,可以使酶分子与反应底物充分接触,提高酶活性位点[8]。由图5可知,摇床摇速为140r/min时,混合酯产率达到最大值,约为65%~80%。Romeroa[4]研究了外部传质、内部传质的不同酰基供体对酯合成影响及动力学,把转速从100r/min调高至300r/min(外部传质),产物生成量的提高;使用不同粒径、不同孔径的固定化酶(内部传质),增大转速也发现产物生成量有所提高,这与本试验得出的结果基本一致。因此,选择转速为140r/min。
2.1.6 反应温度对混合酯产率的影响 温度对酶活性的影响较大,一般固定化脂肪酶的热稳定性都较好,Novozym 435 FG脂肪酶在60℃下仍有很好热稳定性[9]。为防止温度过高使酶活降低、提高酶使用次数,研究了30~50℃的反应温度范围内,由图6可知,在此温度范围内,混合酯产率曲线较为平缓,约为60%~80%,因此选定正己烷反应体系中45℃是较适宜反应温度。
2.1.7 反应时间对混合酯产率的影响 在反应时间≤30h时(图7),随着反应时间的增加,混合酯产率持续增加,因此选择反应时间为30h,其产率为65%~80%。Chowdary等[10]利用异丁酸、异戊醇和Nov435脂肪酶合成异丁酸异戊酯的优化条件后的反应时间为144h,产率为85%;Macedo等[11]利用产自Geotrichum sp.和Rhizopus sp.的脂肪酶合成丁酸异戊酯的优化条件后反应时间为48h,产率为75%。
2.2 杂醇油转化酯类香料工艺条件的正交试验设计优化
根据以上单因素试验结果,在正己烷10mL、杂醇油3mL、乙酸1.5mL、脂肪酶用量70mg、摇床转速140r/min、反应温度45℃的反应体系中,选择对酯产率影响较大的乙酸加入次数、乙酸加入间隔时间、反应温度、分子筛用量进行4因素3水平正交试验设计,进一步优化其正己烷反应体系中工艺条件。正交试验的因素与水平见表1,试验设计及结果见表2。
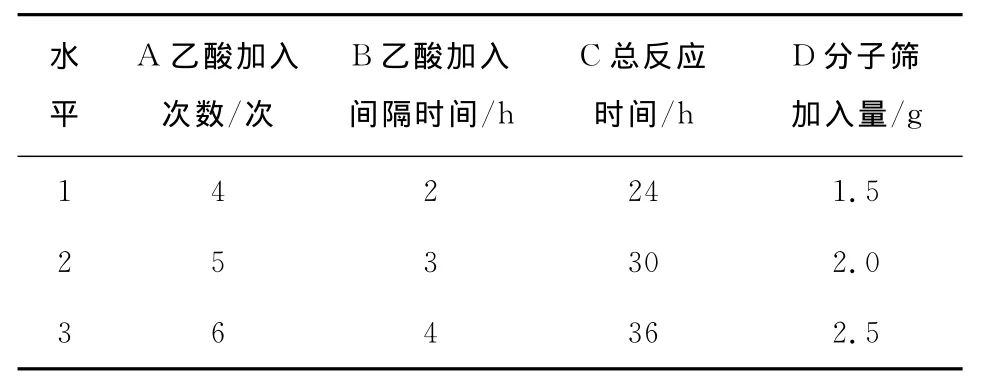
表1 试验因素与水平Table 1 Experimental factors and levels
由表2可知,4因素对产物酯产率的影响主次顺序为反应时间(C)>乙酸加入次数(A)>乙酸加入间隔时间(B)>分子筛添加量(D);其最优条件:正己烷10mL、杂醇油3mL、乙酸1.5mL的反应体系中,脂肪酶用量70mg(2.69g/mol乙酸)、乙酸分6次、间隔时间3h、分子筛2g、摇床转速140r/min、反应温度45℃、时间36h。此条件下实验验证产物乙酸异戊酯、乙酸异丁酯和乙酸丙酯的产率分别为90.1%、91.3%和78.1%。
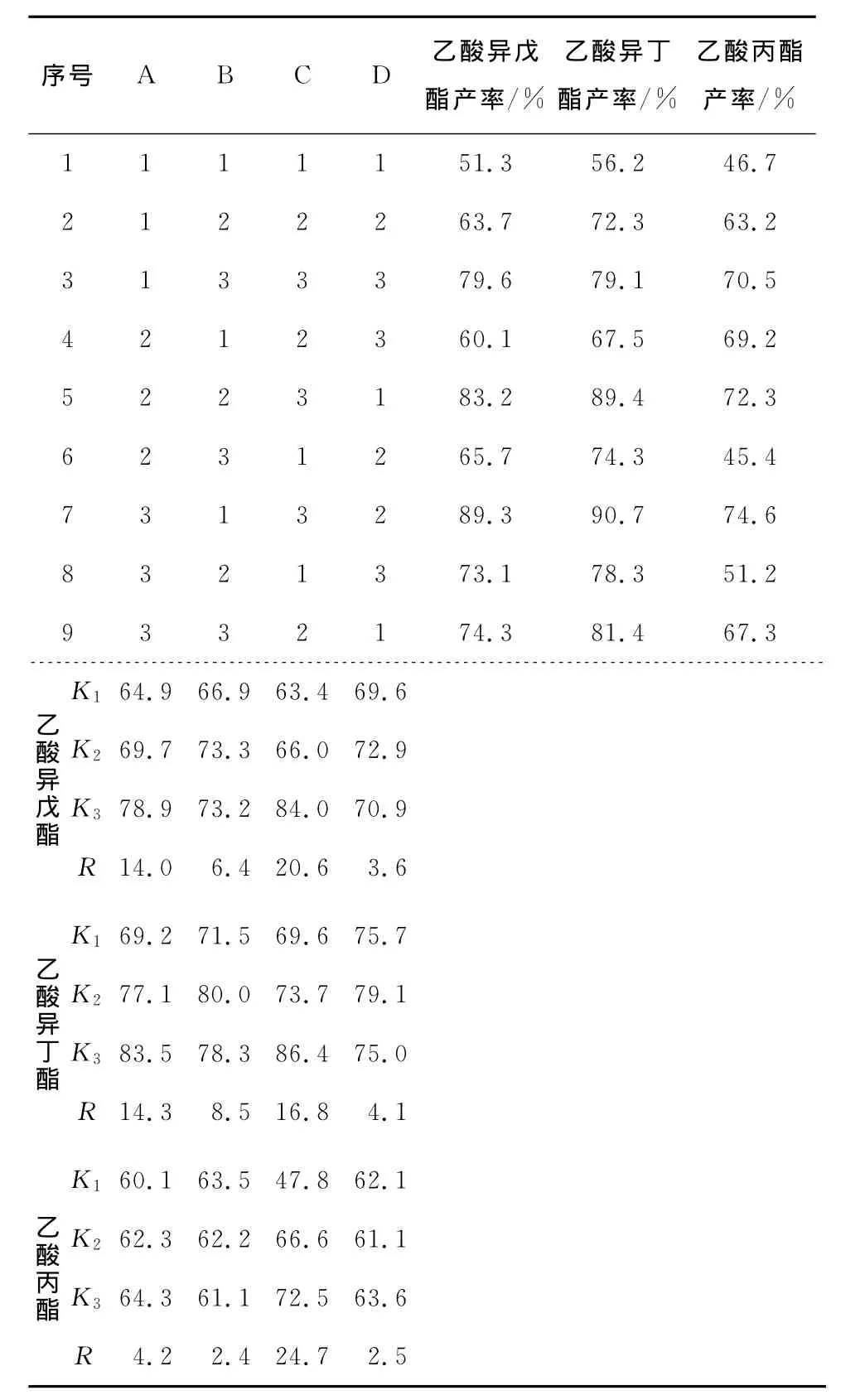
表2 杂醇油转化酯类香料工艺条件的正交试验设计与结果Table 2 The results and analysis of orthogonal experiment design
表2的K值和R值也表明,优化后的乙酸异戊酯、乙酸异丁酯、乙酸丙酯达到最高产率的试验因素、水平等条件并不完全一致,这可能与杂醇油中异戊醇、异丁醇、丙醇的极性差异,导致非水相条件下底物与脂肪酶作用的最佳催化活性的差异有关。考虑到杂醇油中含量最高的是异戊醇,因此选择乙酸异戊酯产率为最高的条件作为优化反应条件。
3 结论
采用间歇式加酸、加入适量分子筛吸水剂可明显提高混合酯得率;在正己烷10mL、杂醇油3mL、乙酸1.5mL的反应体系中,以乙酸异戊酯产率最高为目标,正交试验设计优化后的工艺条件:脂肪酶Novozym 435FG用量70mg、乙酸分6次加入、乙酸加入间隔时间3h、分子筛用量2g、摇床转速140r/min、反应温度45℃、反应时间36h。在以上条件下,其乙酸异戊酯、乙酸异丁酯和乙酸丙酯的产率分别为90.1%、91.3%和78.1%。
1 谢文化.杂醇油的综合开发利用研究进展[J].甘蔗糖业,2003(6):27~29.
2 熊道陵,李金辉,钟洪鸣.杂醇油提纯分离技术及应用[J].酿酒科技,2008(4):65~68.
3 Klibanov AM.Enzymes that work in organic solvents[J].Chemistry Technology,1986,16:354~359.
4 Romeroa M D,Calvo L,Alba C,Daneshfar A.Enzymatic synthesis of isoamyl acetate with immobilized Candida antarctica lipase in n-hexane[J].Enzyme and Microbial Technology,2005,37(1):42~48.
5 Sabeder S,Habulin M,Knez A.Lipase-catalyzed synthesis of fatty acid fructose ester[J].Journal of Food Engineering,2006,77(4):880~885.
6 Ghamgui H,Maha K C,Bezzine S.Production of isoamyl acetate with immobilized Staphylococcus simulans lipase in a solvent-free system[J].Enzyme and Microbial Technology,2006,38(6):788~794.
7 Yadav G D,Trivedi A H.Kinetic modeling of immobilized-lipase catalyzed transesterificatin of n-octanol with vinyl acetate in nonaqueous media[J].Enzyme and Microbial Technology,2003,32(7):783~789.
8 Knez Z,Habulin M.Compressed gases as alternative enzymaticreaction solvent:a short review[J].Journal Supercrit Fluids,2002,23(1):29~42.
9 Chen H C,Kuo C H,Twu Y K.A continuous ultrasound-assisted packed-bed bioreactor for the lipase-catalyzed synthesis of caffeic acid phenethyl ester[J].J.Chem.Techno.Biotech.,2011,86(10):1 289~1 294.
10 Chowdary G V,Ramesh M N,Prapulla S G.Enzymic synthesis of isoamyl isovalerate using immobilized lipase from Rhizomucor miehei:a multivariate analysis[J].Process Biochemistry,2000,36(4):331~339.
11 Macedo G A,Pastore G M,Rodrigues M I.Optimising the synthesis of isoamyl butyrate using Rhizopus sp.lipase with a central composite rotatable design[J].Process Biochemistry,2004,39(6):687~692.
Preparation of natural ester aromas with lipase-catalyzed synthesis in non-aqueous media
WANG Cheng-tao DING Xiao-ying ZHANG Jia-chan ZHAO LeiSUN Bao-guo
(1.Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing100048,China;2.Beijing Key Laboratory of Flavor Chemistry,Beijing Technology and Business University(BTBU),Beijing100048,China)
In order to improve the utilization ratio and added value of fusel oil,enzymic synthesis was studied of fusel oil into natural ester aromas using immobilized lipase Novozym 435FG.The results showed that ester yield rates were affected on the dosage of Novozym 435FG and molecular sieve,added times and time interval of acetic acid,shaker speed,reaction temperature and reaction time.And the ester yield rates were obviously increased using defined amount of molecular sieve and batch-added of acetic acid.In the reaction system of hexane 10mL,fusel oil 3mL,and acetic acid 1.5mL,the optimized conditions by orthogonal experiment design were that Novozym 435FG was 70mg,acetic acid was added six times and interval time 3h, molecular sieve was 2.0g,shaker speed was 140r/min,reaction temperature was 45 ℃,and reaction time was 36h.Under the optimization conditions,the yield rates of isopentyl acetate,isobutyl acetate,propyl acetate were 90.1%,91.3%and 78.1%,respectively.
fusel oil;lipase;non-aqueous media;lipase-catalyzed synthesis;natural ester aromas.
10.3969 /j.issn.1003-5788.2011.06.004
国家自然科学基金项目(编号:31071593);北京市属高等学校人才强教计划项目(编号:PHR201008237);北京工商大学研究生科研学术创新基金项目(编号:19000101026)
王成涛(1969-),男,北京工商大学教授,博士。E-mail:wct5566@163.com
2011-08-01
