VC纳米脂质体的制备研究
2011-12-28杨水兵刘成梅童桂鸿
杨水兵 刘 伟 刘成梅 童桂鸿
刘玮琳 郑会娟 周 伟
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
VC纳米脂质体的制备研究
杨水兵 刘 伟 刘成梅 童桂鸿
刘玮琳 郑会娟 周 伟
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
以大豆卵磷脂和胆固醇为膜材,采用薄膜蒸发-动态高压法制备VC纳米脂质体。通过单因素考察处方工艺对包封率的影响以及正交设计法进行处方工艺优化。结果表明,制备VC纳米脂质体的最优条件:制备温度60℃,VC浓度5mg/mL,VC和总脂材质量比为1∶10,大豆卵磷脂和胆固醇质量比为4∶1,表面活性剂和总脂材质量比为4∶10,动态高压处理压力为140MPa,处理2次。该条件下包封率可达(47.16±6.28)%,平均粒度为(73.9±4.4)nm。
VC;纳米脂质体;稳定性;动态高压法
VC是一种水溶性的维生素,水果和蔬菜中含量丰富。VC性质不稳定,在储藏和加工过程中受热、见光易氧化、分解,导致其利用率显著降低[1,2]。
脂质体又称人工生物膜,在水中平衡后具有亲水性和疏水性两性性质,并能有效提高药物的吸收率和渗透性[3]。纳米脂质体具有和脂质体类似的物理性质和热力学性质[4],且有报道[5,6]认为非极性药物纳米脂质体的生物利用率比传统脂质体更高。本试验将VC包裹在纳米脂质体中,可以减少维生素的损失,而且能提高其在人体中的吸收利用率。
脂质体制备常用的方法有乙醇注入法[7]、薄膜蒸发法[8,9]、逆向蒸发法[10]、高压乳匀法[11]等。乙醇注入法药物包封率较低,残留的无水乙醇难以除去。逆向蒸发法制备条件不温和,其中的有机溶剂容易使包封药物变性。薄膜蒸发法制备的脂质体包封率较高,但一般粒径较大。动态高压微射流技术(DHPM)是一种集输送、混合、超微细化、加压、高速撞击、均质等单元操作于一体的新型连续化处理技术,它可将液体在极小空间进行强烈的垂直撞击,形成持续高速的剪切力,从而将液体粒径有效减小到分布均匀的纳米级[12,13]。将DHPM法和传统的薄膜法结合成为薄膜分散-DHPM法来制备VC纳米目前还未见报道。在前期研究基础上,本试验首次用薄膜分散-DHPM制备包封率高、稳定性好的VC纳米脂质体,旨在增强VC的稳定性,提高VC的利用度。
1 材料与方法
1.1 材料与试剂
VC:分析纯,国药集团化学试剂有限公司;
胆固醇:25g装,国药集团化学试剂有限公司;
卵磷脂:PC,北京美亚思磷脂技术有限公司;
无水乙醇:分析纯,天津大茂化学试剂厂;
吐温-80:分析纯,天津大茂化学试剂厂;
甲醇:分析纯,天津市大茂化学试剂厂;
冰乙酸:分析纯,天津市大茂化学试剂厂;
固蓝B盐:分析纯,国药集团化学试剂有限公司;
EDTA:分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
旋转蒸发器:RE52-05,上海亚荣生化仪器厂;
超细微粒粒度分析仪:Nicomp380ZLS,Santa barbara,California,USA;
紫外可见分光光度计:T6,北京普析通用仪器有限责任公司;
超声波震荡仪:JAC-300,山东奥波超声电器有限公司;
循环水真空泵:SHZ-Ⅲ型,上海亚荣生化仪器厂;
六联磁力加热搅拌器:CJJ-931,江苏金坛市金城国胜实验仪器厂;
超声波清洗器:KQ-50E型,昆山市超声仪器有限公司;
微 射 流 仪:Microfluidizer Processor M-700,美 国 Microfluidics公司。
1.3 方法
1.3.1 薄膜分散-DHPM法制备VC纳米脂质体 精确称取配方量的卵磷脂、胆固醇与适量无水乙醇混合后,置于250mL圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。然后加入一定量的VC双蒸水溶液,旋转洗膜30min左右,得到脂质体悬液;最后将悬液水浴超声一段时间即制得较均匀的乳白色VC脂质体悬浮液。将上述制得的脂质体悬液在140MPa下,用微射流均质机处理两次,即得VC纳米脂质体。
1.3.2 单因素试验 本试验以VC纳米脂质体的包封率为指标,考察各因素(制备温度、卵磷脂和胆固醇的质量比、VC和总脂材的质量比、总脂材和表面活性剂的质量比、处理压力)对脂质体包封率的影响。
(1)制备温度:本试验保持VC浓度为5mg/mL,卵磷脂和胆固醇的质量比4∶1,VC和总脂材为1∶10,表面活性剂∶总脂材为3∶10,卵磷脂∶无水乙醇为1∶10(m∶V),处理压力140MPa,处理次数2次。选择制备温度分别为:50,55,60,65,70℃,通过测定脂质体的包封率,确定较适宜的制备温度。
(2)卵磷脂和胆固醇的质量比(卵胆比):保持制备温度55℃,VC浓度为5mg/mL,VC和总脂材为1∶10,表面活性剂∶总脂材为3∶10,卵磷脂∶无水乙醇为1∶10(m∶V),处理压力140MPa,处理次数2次。本试验中选取卵磷脂和胆固醇的质量比为2∶1,3∶1,4∶1,5∶1,6∶1,确定合适的卵胆比。
(3)VC和总脂材的质量比(药脂比):保持制备温度55℃,VC浓度为5mg/mL,卵胆比4∶1,表面活性剂∶总脂材为3∶10,卵磷脂∶无水乙醇为1∶10(m∶V),处理压力120MPa,处理次数2次。本试验选用VC和总脂材质量比为1∶10,2∶10,3∶10,4∶10,5∶10,通过测定脂质体的包封率,确定合适的药脂比。
(4)总脂材和表面活性剂的质量比:保持制备温度55℃,药脂比为2∶10,卵胆比4∶1,卵磷脂∶无水乙醇为1∶10(m/V),处理压力120MPa,处理次数2次。本试验采用总脂材∶表面活性剂(质量比)为10∶1,10∶2,10∶3,10∶4,10∶5,通过测定脂质体的包封率,确定表面活性剂的用量。
(3)交通载荷作用的量化存在很多理论问题的解释,但鉴于目前关于交通载荷作用没有一个确定的计算标准,笔者的计算方法旨在引起工程设计人员对交通荷载作用的重视。希望今后的研究人员能够对交通荷载作用在顶力计算中能有更大突破。
(5)制备压力大小的影响:保持制备温度55℃,药脂比为2∶10,卵胆比4∶1,表面活性剂∶总脂材为3∶10,卵磷脂∶无水乙醇为1∶10(m/V),处理次数2次。制备压力的大小会影响所得VC脂质体的包封率和粒度的大小,本试验选择制备压力为80,100,120,140,160MPa,通过对制备的脂质体包封率测定,确定较适宜的制备压力。
1.3.3 正交试验 根据上述单因素试验的结果,本试验选择对VC脂质体包封率影响较大的三个因素:制备温度、VC和总脂材质量比(药脂比)、Tween-80与总脂材之比。采用L9(34)表正交试验设计法进行试验,确定VC脂质体的最佳配方。
1.3.4 VC纳米脂质体的性质测定
(1)VC包封率测定(透析-分光光度法):参照文献[14]。取出1mL透析内液,测定波长420nm处的吸光度,代入标准曲线计算出包封的VC含量,再按式(1)计算出VC的包封率(entrapment efficiency,EE)。

式中:
EE——VC的包封率,%;
W包——包封于脂质体的药量,g;
(2)脂质体的粒径测定:参照文献[15]。测试角度90°,测试温度为(25±0.1)℃,测试光波长为632.8nm。
2 结果与讨论
2.1 制备温度的影响
由图1可知,当温度低于55℃时,包封率随温度升高而增大;当温度高于55℃时,包封率下降。温度为55℃时,此时脂质体的包封率达到最大。可能是当温度过低时,脂质材料的成膜速度过慢,导致脂质材料一直处于溶剂浸泡的状态,形成不了良好致密性的薄膜。而当温度过高时,脂质材料的成膜速度过快,这时磷脂和胆固醇之间并没有紧密结合,由于脂质膜较松散,得到的脂质体包封率不高,所以,确定适宜的制备温度为55℃。
2.2 卵磷脂和胆固醇的质量比(卵胆比)的影响
由图2可知,当卵胆比小于4∶1时,包封率随着卵胆比的增大而增加,但变化不大,可能是因为胆固醇具有调节膜流动性、稳定脂质双分子层膜的功能。当卵胆比为4∶1时,包封率达到最大;之后随着卵胆比的增大,包封率又有所下降,这是因为胆固醇过多时,脂质体膜形成困难,且不牢固,形成的脂质体膜亲水性太强,膜也容易破坏。因此,确定适宜的卵胆比为4∶1。
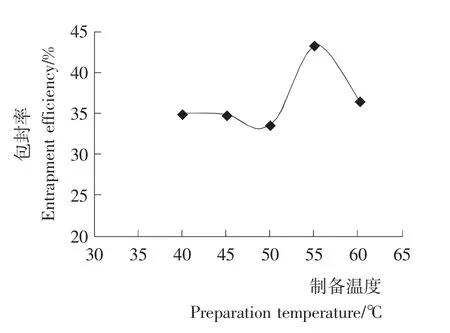
图1 制备温度对VC纳米脂质体包封率的影响Figure 1 The effect of vitamin C nanoliposomes on preparation temperature
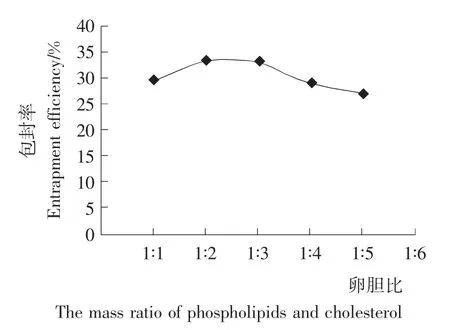
图2 卵胆比对VC纳米脂质体包封率的影响Figure 2 The effect of ratio of phospholipids and cholesterol on vitamin C nanoliposomes entrapment efficiency
2.3 药脂比的影响
由图3可知,当药脂比小于2∶10时,药物用量较少,脂质膜没有达到饱和,包封率随药脂比增大而增加。当药脂比为2∶10时,此时的包封率达到最高。之后包封率随药脂比增大而减小,药物用量超过了脂质膜的饱和限度。因此,适宜的药脂比为2∶10。

图3 药脂比对VC纳米脂质体包封率的影响Figure 3 The effect of the mass ratio of drug and total lipids on vitamin C nanoliposomes entrapment efficiency
2.4 表面活性剂用量的影响
由表4可知,Tween-80的用量对包封率的影响较大。随着Tween-80用量的增加,包封率先升高后降低。当Tween-80:总脂材为3∶10时,包封率达到最大。Tween-80是一种非离子表面活性剂,在脂质体的形成过程中起到空间位阻作用,使包封率增大。但随着表面活性剂的增加,其又与脂质体微球产生一定的物理结合,连接在脂质体微球上,从而使包封率下降。因此,选取Tween-80∶总脂材为3∶10。
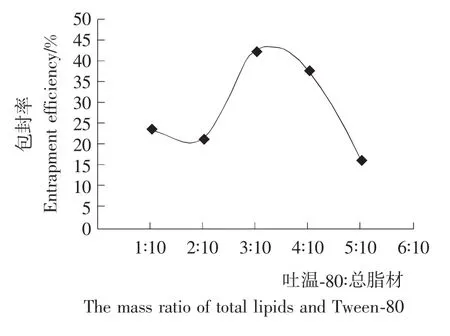
图4 Tween-80与总脂材的比对VC纳米脂质体包封率的影响Figure 4 The effect of the mass ratio of total lipids and Tween-80on vitamin C nanoliposomes entrapment efficiency
2.5 制备压力对VC纳米脂质体包封率的影响
由图5可知,压力低于140MPa时,随着压力的增大,包封率逐渐增大;当压力为140MPa时,包封率达到最大;但当压力高于140MPa时,随着压力增大,包封率反而减小,其原因可能是压力过大,迫使脂质体内包封的VC渗漏出来,从而使包封率减小。因此,采用制备压力为140MPa。
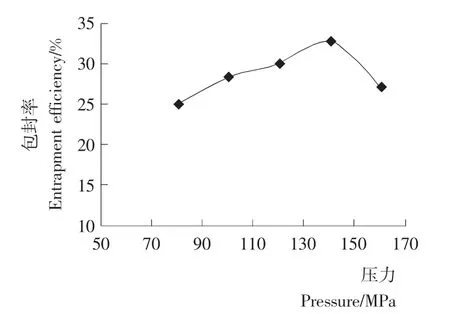
图5 处理压力大小对VC纳米脂质体包封率的影响Figure 5 The effect of treatment pressure on vitamin C nanoliposomes entrapment efficiency
2.6 正交试验结果
根据上述单因素试验的结果确定的试验因素及水平见表,试验设计及结果见表2。
由表2和表3可知,用薄膜分散-动态高压法制备VC纳米脂质体时,对包封率影响最大的因素是B(药脂比);其次是C(Tween-80与总脂材比);影响最小的是因素A(制备温度),最优水平组合为 A3B1C3,即制备温度为60℃,Tween-80:总脂材为4∶10,药脂比为1∶10,这与最优试验组(试验7)的条件重合。
因此,用薄膜分散-高压法制备VC纳米脂质体的最优制备配方为:保持VC浓度5mg/mL,当制备温度60℃、药脂比为1∶10、卵胆比(质量比)4∶1、卵磷脂∶无水乙醇=1∶10(m∶V)、Tween-80∶总脂材为4∶10、处理压力为140MPa、处理2次。在最优条件下,包封率可达(47.16±6.28)%,平均粒度为(73.9±4.4)nm。
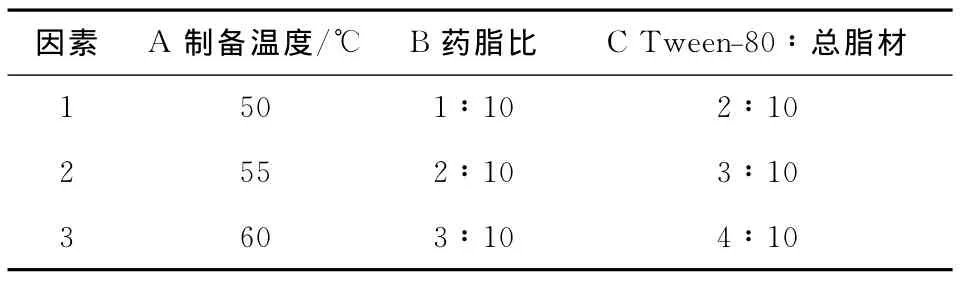
表1 正交试验设计Table 1 Orthogonal experimental design

表2 正交试验结果及分析Table 2 Orthogonal experimental results
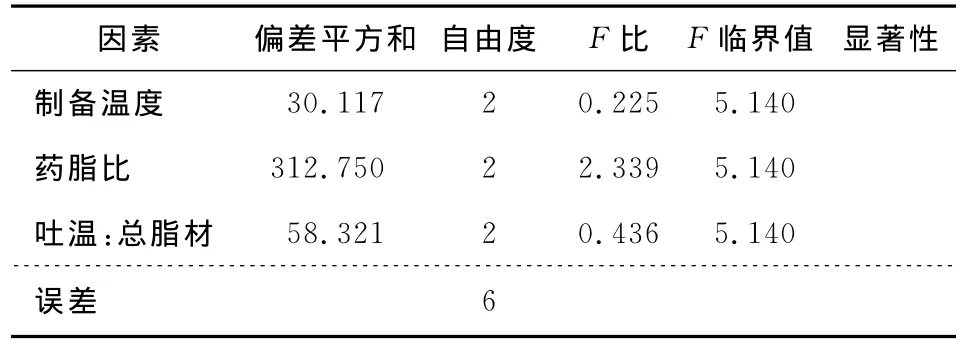
表3 方差分析表Table 3 Analysis of variance table
3 结论
在前期研究中笔者也采用了薄膜分散法制备出了VC脂质体,但获得的粒径较大,包封率也不是很理想。本试验以卵磷脂、胆固醇为膜材,VC为芯材,尝试采用薄膜分散结合动态高压的方法制备VC纳米脂质体,并通过单因素实验和正交设计对VC纳米脂质体制备工艺进行优化。得到的最佳工艺条件:VC浓度5mg/mL,当制备温度60℃、药脂比为1∶10、卵胆比(质量比)4∶1、卵磷脂∶无水乙醇=1∶10、Tween-80∶总脂材为4∶10、处理压力为140MPa、处理2次。在此条件下包封率可达(47.16±6.28)%,平均粒度为(73.9±4.4)nm。结果表明薄膜分散-动态高压法能较成功的制备出包封率高、粒径小的VC纳米脂质体。但纳米脂质体的其它性质,如稳定性、生理功能等,还有待进一步研究。
1 彭景.烹饪营养学 [M].北京:中国纺织出版社,2008.
2 张文晔,宋树豪.VC的代谢与功能及其在家禽生产上的应用[J].饲料工业,2010,31(6):4~6.
3 Gamez-Hens A,Fernadez-Romero J M.Analytical methods for the control of liposomal delivery system [J].Trends Anal.Chem.,2006,25(2):167~178.
4 Mozafari M R,Mortaz S M.Nanoliposomes:from fundamentals to recent developments[M].Trafford Publishing Ltd,Oxford,UK,2005:91~98.
5 Acosta E.Bioavailability of nanoparticles in nutrient and nutraceutical delivery[J].Curr.Opin.Colloid In.,2009,14:3~15.
6 Huang Q R.,Yu H L,Ru Q M.Bioavailability and delivery of nutraceuticals using nanotechnology [J].J.Food Sci.,2010,75:50~57.
7 吴亚妮,徐云龙,孙文晓.木瓜蛋白酶纳米脂质体的制备及其粒度控制 [J].上海交通大学学报(农业科学版),2007,25(2):1 052~1 091.
8 Pupo E,Padron A,Santana E,et al.Preparation of plasmid DNA-containing liposomes using a high-pressure homogenizationextrusion technique[J].J.Control.Release,2005,104 (2):379~396.
9 朱斌,许时婴,夏书芹.薄膜水化法制备辅酶Q10脂质体[J].食品与机械,2006,22(6):39~42.
10 李凌冰,刘华强.阿替洛尔脂质体制备工艺及处方优化研究[J].中南药学,2005,3(4):201~203.
11 张小宁,张郁,姬海红,等.微射流法制备莪术油纳米脂质体的研究 [J].中国药学杂志,2004,39(5):356~358.
12 王倩,刘伟,刘成梅,等.苹果POD酶学性质及动态高压微射流对POD的影响 [J].食品与机械,2011,27(2):4~7.
13 刘成梅,刘伟,高荫榆,等.微射流均质机的流体动力学行为分析 [J].食品科学,2004,25(4):58~62.
14 Liu W,Liu W L,Liu C M,et al.Medium-chain fatty acid nanoliposomes for easy energy supply [J].Nutrition,2011,27:700~706.
15 杨水兵,刘成梅,刘伟.VC脂质体的制备与稳定性测定 [J].食品科学,2010,31(20):230~234.
Preparation and characteristics of vitamin C nanoliposomes
YANG Shui-bing LIU Wei LIU Cheng-mei TONG Gui-hong
LIUWei-lin ZHENG Hui-juanZHOU Wei
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang,Jiangxi330047,China)
The thin film evaporation-dynamic high pressure microfluidization was used to prepare vitamin C nanoliposomes with soybean lecithin and cholesterol as the membrane materials.Based on the single factor experiments,the optimum conditions of preparing vitamin C nanoliposomes determined by orthogonal experiments with entrapment efficiency as the main index were as follows:the preparation temperature was 60 ℃,the concentration of vitamin C 5mg/mL,the mass ratio of vitamin C to total lipids 1∶10,the mass ratio of phospholipids to cholesterol 4:1,the mass ratio of Tween-80to total lipids 4∶10,under dynamic high pressure microfluidization treatment of 140MPa for 2times,respectively.Under these conditions,the vitamin C nanoliposomes had a small particle size (73.9±4.4)nm and high encapsulation efficiency(47.16±6.28)%.
vitamin C;nanoliposomes;stability;dynamic high pressure microfluidization
10.3969 /j.issn.1003-5788.2011.06.060
国家重点实验室目标导向项目(编号:SKLF-MB-201004)
杨水兵(1984-),男,南昌大学在读博士研究生。E-mail:shuibingyang1984@126.com
刘伟
2011-08-01
