清胰汤对L-精氨酸诱发的重症急性胰腺炎小鼠胰腺p-STAT3 表达的影响*
2011-12-23张晓芹贾晓云李保兰史迎莉
张晓芹, 贾晓云, 李 涛, 李保兰, 史迎莉, 张 红△
(1 陕西中医学院基础医学院 病理生理学教研室,陕西 咸阳712046;2 敦化市医院病理科,吉林 敦化133700)
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种危重疾病,病死率可高达20% ~30%。近年来的研究提示:细胞因子和炎症介质在SAP 发生、发展中起着重要作用[1],尤其是白细胞介素6(interleukin-6,IL-6)在轻症急性胰腺炎和重症急性胰腺炎患者血清水平存在明显差异,因此,IL -6 的血清水平已经作为反映SAP 严重程度的重要指标[2,3]。近来研究显示IL-6 等细胞因子通过诱发其下游信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)的活化促进炎症的进一步发展[4]。而急性胰腺炎时STAT3 通路是否活化、抑制STAT3 活化是否可以有效减轻急性胰腺炎的炎症损伤值得深入研究。
腹腔内注射大剂量L-精氨酸(L-arginine,LArg)是近年来开始使用的一种小鼠急性胰腺炎造膜方法,此法所诱导模型胰腺病变的程度在不同部位比较一致,与人类急性胰腺炎的病程及组织学改变相似,是研究急性胰腺炎及其防治措施的理想动物模型[5]。本课题采用20% L -Arg 复制小鼠急性胰腺炎模型,观察急性坏死性胰腺炎模型胰腺STAT3活化程度的变化,及与SAP 进展密切相关的炎症细胞因子单核细胞趋化蛋白-1[6](monocyte chemoattractant protein-1,MCP -1)的变化,并观察清胰汤(Qingyi decoction,QYD)对急性坏死性胰腺炎小鼠胰腺STAT3 活性的影响及对胰腺、肺损伤的治疗作用,从而探讨STAT3 在急性胰腺炎中的作用和清胰汤治疗SAP 的分子机制。为早期预测SAP 提供有临床价值的指标,为清胰汤用于临床治疗急性胰腺炎提供理论依据。
材 料 和 方 法
1 动物
健康昆明小鼠(雄性)30 只,6 ~8 周龄,体重18~25 g,购自第四军医大学实验动物中心(合格证书号0001442),各组小鼠分笼饲养,术前12 h 禁食,不禁水,室温饲养。
2 药品、试剂和仪器
L-Arg 购于Sigma -Aldrich(A8094);清胰汤由柴胡15 g、黄芩10 g、黄连10 g、白芍15 g、木香10 g、芒硝10 g、生大黄15 g(后下)组成,加水煎煮浓缩成85 mL(1.0 kg 生药/L),分装后置4 ℃保存备用。兔抗小鼠STAT3 单克隆抗体购于Santa Cruz(sc -21876 -R);HRP 标记的羊抗兔IgG 购于博士德试剂公司(BA1054);兔抗小鼠β-actin 单克隆抗体购于博奥森公司(bs-0061R);ECL 发光试剂盒购于博士德试剂公司(AR1170);淀粉酶试剂盒购于南京建成生物研究所;RNA 提取试剂、反转录及实时荧光定量PCR 试剂为天根公司产品;其它为当地试剂公司提供的分析纯化学试剂;酶标仪(Bio-Tek ELX808IU);Western blotting 电泳转膜及凝胶成像分析系统(Bio -Rad);7300型荧光定量PCR 仪(ABI)。
3 动物分组及造模
健康雄性昆明小鼠30 只(6 ~8 周龄,体重18 ~25 g),随机分为3 组(n=10):对照组(control);模型组(SAP);清胰汤组(SAP +QYD)。除对照组外,模型组和清胰汤治疗组给予腹腔注射20% L -Arg[5](3 g/kg,间隔1 h 再注射1 次);清胰汤治疗组在第2 次腹腔注射20% L -Arg 30 min 后给予清胰汤浓缩液灌胃(10 mL/kg),之后每天灌胃2 次。
4 标本采集与检测
造模后72 h 麻醉处死动物,经下腔静脉取血,分离血清;完整摘除胰腺、称重,将一部分胰腺置于10%甲醛溶液浸泡固定,另一部分胰腺迅速置入液氮中,再转入-80 ℃冰箱,待提取蛋白行Western blotting 或提取RNA 行real - time PCR 检测。开胸取左肺组织,于10%甲醛溶液浸泡固定,右肺迅速置入液氮中,再转入-80 ℃冰箱,待测髓过氧化物酶(myeloperoxidase,MPO)的活性。
4.1 胰腺和肺组织的病理学变化 一部分胰腺及左肺组织经脱水、石蜡包埋、切片,进行HE 染色观察胰腺及肺病理学改变。
4.2 血清淀粉酶检测 采用化学比色法检测血清淀粉酶的活性。
4.3 记算胰腺湿重比 胰腺湿重比= 胰腺重量(g)/体重(g)。
4.4 肺组织MPO 检测 取整个右肺,加缓冲液制成肺组织匀浆,10 000 r/min 4 ℃离心10 min,提取上清液,加入邻联茴香胺,双氧水反应,分光光度计470 nm 波长下扫描,记录第30 s 和第90 s 的吸光度差值,以评价肺组织中性粒细胞浸润程度。
4.5 Western blotting 检测胰腺p -STAT3 的表达变化 取胰腺组织50 mg,加蛋白裂解液400 μL 匀浆,冰上放置30 min,10 000 r/min 4 ℃离心10 min,提取上清液,采用BCA 法进行蛋白定量后,用5 ×loading buffer 将样品稀释至4 g/L;以分子量18 ~94 kD 的marker 为参照,SDS - PAGE 胶蛋白电泳,电转移至PVDF 膜,封闭液(5%脱脂奶粉)中缓慢摇荡1 h ,用TBST 洗脱,滴加Ⅰ抗[分别为β - actin(1 ∶2 000);p-STAT3(1∶500)]至PVDF 膜,4 ℃摇床上孵育过夜。TBST 漂洗3 次,每次5 min。HRP 标记的羊抗兔IgG Ⅱ抗(1∶1 000 稀释),室温孵育1 h。TBST 漂洗3 次,每次10 min。ECL 滴加于PVDF 膜上,在暗盒中将X 光片曝光,显影、定影后,根据marker,进行扫描。图像经GelDoc XR 软件进行吸光度值分析,并与内参照β -actin 比较,以相对吸光度值代表蛋白表达量。
4.6 实时荧光定量PCR(real-time PCR)法检测胰腺MCP-1 mRNA 的表达变化 应用PrimerExpress软件(PE Biosystems)设计基因特异性PCR 引物序列,MCP-1 上游引物为5' -GTTGGCTCAGCCAGATGCA -3',下游引物5' - AGCGTACTCATTGGGATCATCTTG -3';β -actin 上游引物为5' -CATCCTGCGTCTGGACCT - 3',下游引物5' - TCAGGAGGAGCAATGATCTTG-3'。按试剂的操作步骤提取胰腺组织中总RNA、逆转录成cDNA。以cDNA 为模板进行PCR,反应条件(20 μL 体系):SYBR Green Mix 9 μL,cDNA(20 mg/L)4 μL,上、下游引物(10 μmol/L)各0.5 μL,H2O 6 μL。扩增条件:预热50℃2 min,预变性95 ℃10 min,95 ℃15 s,60 ℃30 s,72 ℃30 s,共40 个循环;以ΔCt 值表示目的基因MCP-1 相对表达量。
5 统计学处理
结 果
1 胰腺和肺组织的病理学变化
如图1 所示,对照组小鼠胰腺及肺组织光镜下未见病变;SAP 72 h 组胰腺腺泡细胞肿胀,可见多处不同程度片状坏死,间质有大量炎症细胞浸润及出血。肺组织表现为肺泡间隔水肿、增宽,大量炎症细胞浸润;清胰汤治疗组胰腺和肺组织病变明显减轻,主要表现为胰腺腺泡轻度肿胀,间质小血管扩张、充血,有少量炎症细胞浸润。肺泡间隔轻度水肿、增宽,仅见少量炎症细胞浸润。
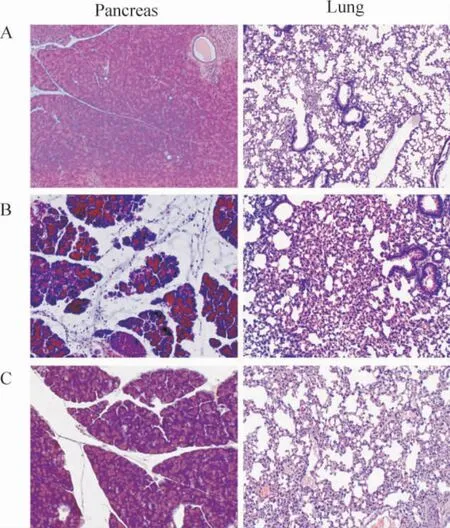
Figure 1. The effect of Qingyi decoction(QYD)on the pancreatic and lung morphology of mice with severe acute pancreatitis (ASP)at 72 h. A:control group;B:SAP group;C:SAP+QYD group.图1 各组胰腺和肺组织的病理学变化
2 血清淀粉酶活性变化
如图2 所示,SAP 诱发后,各组血清淀粉酶活性升高,与对照组相比较差异显著(P <0.01);而清胰汤治疗组淀粉酶的活性明显降低,与SAP 组相比差异显著(P <0.05)。
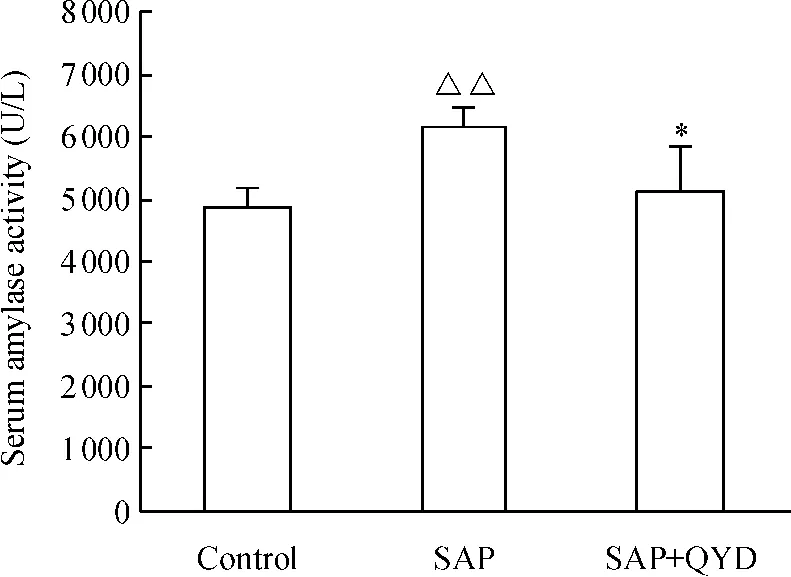
Figure 2. The effect of QYD on the amylase activity in serum of mice with acute pancreatitis. ±s.n=10. △△P <0.01 vs control group;* P <0.05 vs SAP group.图2 各组血清淀粉酶活性变化
3 胰腺湿重比变化
如图3 所示,SAP 诱发后,胰腺湿重比增加,与对照组相比较,差异显著(P <0.05);清胰汤治疗组胰腺湿重比降低,与SAP 组相比,显著差异(P <0.05)。
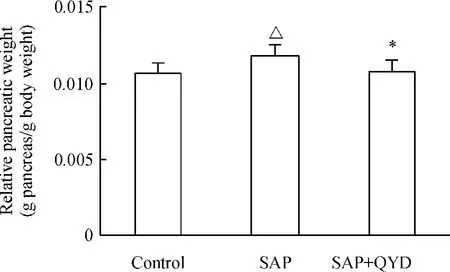
Figure 3. The effect of QYD on the relative pancreatic weight of mice with acute pancreatitis. ±s.n=10. △P <0.05 vs control group;* P <0.05 vs SAP group.图3 各组胰腺湿重比变化
4 肺组织MPO 变化
如图4 所示,SAP 诱发后,肺组织匀浆MPO 水平明显升高,与对照组相比,差异显著(P <0.01);清胰汤治疗组MPO 水平明显降低,与SAP 组相比,差异显著(P <0.01)。
5 胰腺p-STAT3 的表达变化
如图5 所示,对照组小鼠胰腺未见p -STAT3 的活性表达;SAP 组小鼠在胰腺炎诱发后72 h 胰腺p-STAT3 的活性表达明显增强;而清胰汤治疗组72 h胰腺p-STAT3 的活性表达明显少于SAP 组(n =3,P <0.01)。
6 胰腺组织MCP-1 mRNA 的表达变化
如图6 所示,SAP 诱发72 h,胰腺MCP -1 mRNA 的表达明显升高,与对照组相比较,差异显著(P <0.01);而清胰汤治疗组胰腺MCP-1 mRNA 的表达明显降低,与SAP 组相比差异显著(P <0.05)。
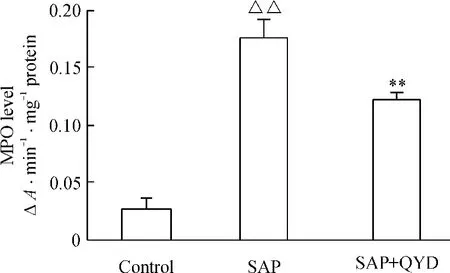
Figure 4. The effect of QYD on the MPO level in lung of mice with acute pancreatitis. ±s. n =10. △△P <0.01 vs control group;**P <0.01 vs SAP group.图4 各组肺组织MPO 水平变化
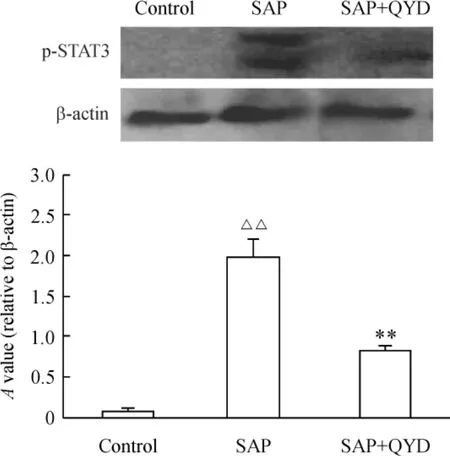
Figure 5. Expression of p-STAT3 protein in pancreas following the development of acute pancreatitis. Pancreas protein extracts (20 μg)at the indicated time point (72 h)were analyzed by Western blotting using antibody against p-STAT3 and β -actin. ±s. n =3. △△P <0.01 vs control group;**P <0.01 vs SAP group.图5 各组p-STAT3 蛋白表达比较
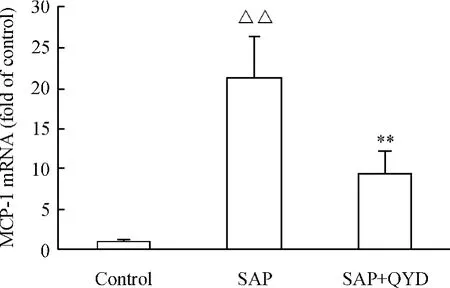
Figure 6. The effect of QYD on the MCP -1 mRNA expression in pancreas of mice with acute pancreatitis. The total RNA in pancreas was abstracted and reversibly transcribed into cDNA. The cDNA was further analyzed by real-time PCR. ΔCt was used to calculate the level of MCP -1 mRNA. ±s.n =10. △△P <0.01 vs control group;**P <0.01 vs SAP group.图6 各组胰腺组织MCP-1 mRNA 表达变化
讨 论
腹腔内注射大剂量L -Arg 复制小鼠急性胰腺炎,是研究急性胰腺炎及防治措施较为理想的动物模型。我们曾给小鼠腹腔注射不同剂量(2 g/kg、3 g/kg、4 g/kg)的20% L -Arg,发现小鼠死亡率及造模的成功率与剂量明显相关。采用20% L -Arg 以2 g/kg 的剂量给小鼠进行腹腔注射,发现72 h 模型的成功率仅为60%,而4 g/kg 的剂量造膜后72 h 小鼠的死亡率超过了40%。因此我们选用了20% LArg 以3 g/kg 的剂量造模,72 h 后模型组动物可见胰腺腺泡细胞肿胀,及多处片状坏死,间质有大量炎症细胞浸润及出血;肺组织表现为肺泡间隔水肿、增宽,大量炎症细胞浸润;血浆淀粉酶活性、胰腺重量、肺组织匀浆MPO 水平明显增加,提示腹腔内注射大剂量L- Arg(3 g/kg)成功复制了小鼠急性胰腺炎模型。此法操作简便,成本低,重复性好,病变的程度在不同胰腺部位比较一致,克服了其它模型需行剖腹术等缺点,再次证明L -Arg 腹腔注射是复制急性胰腺炎较为理想的方法[5]。
STAT3 是一种多功能的转录因子,广泛表达于多种类型的细胞和组织中,可被JAKs(Janus kinases)通过酪氨酸磷酸化激活成为p - STAT3,p -STAT3 表达水平是STAT3 活化程度的指征[7]。对结肠炎的信号通路研究发现[8],过度生成的IL -6 首先与IL -6 受体结合,引发JAKs 磷酸化活化,继而导致其下游的STAT3 磷酸化,磷酸化的STAT3(p -STAT3)分子形成二聚体,进入细胞核与特异的DNA序列结合,调节下游相关靶基因如炎症细胞因子的转录和表达。而采用caerulein 联合脂多糖诱发的小鼠SAP 模型[9]也发现:胰腺中STAT3 表达明显增强,而IL-6 中和抗体可以抑制胰腺STAT3 的活化、减轻SAP 的损伤,提示胰腺STAT3 的活化可能与胰腺炎的病变程度存在着一定的因果关系。但是STAT3 在AP 发展中的作用尚不清楚。本课题采用20% L-Arg 复制小鼠急性胰腺炎模型,观察SAP 模型胰腺STAT3 活化程度的变化,发现20% L - Arg注射后72 h,胰腺和肺组织可见明显的病理损伤,胰腺p-STAT3 表达明显增强,炎性细胞因子MCP -1 mRNA 表达增多,提示胰腺STAT3 活化可能参与SAP 的重症化。由于在SAP 的动物实验和临床研究中均发现MCP-1 上调,MCP-1 在急性胰腺炎的炎症损伤尤其在急性胰腺炎并发肺损伤的发病机制中起着重要的作用[10]。本实验结果提示STAT3 活化后进入细胞核可能与特异性的DNA 序列结合,促进其下游MCP-1 基因的转录和表达。
清胰汤是大承气汤的加减方,其功效主要为通里攻下,活血化瘀,在临床上已广泛应用于急性胰腺炎。研究发现,清胰汤除了能促使肠道功能恢复外,同时可以阻止炎症介质IL-6 的释放[11]。清胰汤是否对IL-6 下游的STAT3 有抑制作用及其机制尚不清楚。我们采用清胰汤对L -精氨酸所诱发的SAP小鼠进行治疗发现:清胰汤治疗组p-STAT3 的表达明显减少,提示清胰汤可以抑制胰腺STAT3 的活化。另外清胰汤治疗组的胰腺重量、血清淀粉酶活性、MPO 水平明显降低,胰腺、肺组织学损伤程度明显减轻,胰腺MCP-1 mRNA 的表达明显减少,提示抑制STAT3 的活化可以减轻AP 的胰腺、肺的炎症性损伤。本研究结果为SAP 的治疗提供有价值的靶点,并为阐明清胰汤治疗急性胰腺炎的作用和机制提供理论依据。
[1] Mayer J,Rau B,Gansauge F,et al. Inflammatory mediators in human acute pancreatitis:clinical and pathophysiological implications[J]. Gut,2000,47(4):546 -552.
[2] Štimac D,Fiši E,Mili S,et al. Prognostic values of IL-6,IL-8,and IL-10 in acute pancreatitis[J]. J Clin Gastroenterol,2006,40(3):209 -212.
[3] 张晓云,汪东剑,余维涛.血清IL -6、IL -8 和TNF -α在重症急性胰腺炎早期诊断中的临床意义[J].胰腺病学,2004,4(1):26 -28.
[4] Atreya R ,Mudter J ,Finotto S ,et al . Blockade of interleukin 6 trans -signaling suppresses T -cell resistance against apoptosis in chronic intestinal inflammation:evidence in crohn disease and experimental colitis in vivo[J]. Nat Med,2000,6(5):583 -588.
[5] 刘君君,陈 垦,龙友明,等. L -精氨酸诱导大鼠急性坏死性胰腺炎模型的建立[J].中国药理学通报,2009,25(10):1392 -1394.
[6] 林旭红,李永渝. 急性胰腺炎发病机制及相关治疗的研究进展[J]. 中国病理生理杂志,2010,26(5):1029-1032,1040.
[7] 钟敦璟,郭 红,郝 嘉,等. STAT3 对大鼠重症急性胰腺炎血清体外作用AT -II SP -C 的影响[J]. 第三军医大学学报,2008,30(19):1807 -1809.
[8] Mitsuyama K,Sata M,Rose-John S. Interleukin-6 trans-signaling in inflammatory bowel disease[J]. Cytokine Growth Factor Rev,2006,17(6):451 -461.
[9] Chao KC,Chao KF,Chuang CC,et al. Blockade of interleukin 6 accelerate acinar cell apoptosis and attenuates experimental acute pancreatitis in vivo[J]. Br J Surg,2006,93(3):332 -338.
[10] Zhou GX,Zhu XJ,Ding XL,et al. Protective effects of MCP-1 inhibitor on a rat model of severe acute pancreatitis[J].Hepatobiliary Pancreat Dis Int,2010,9(2):201-207.
[11] 闻庆平,陈海龙,关风林.清胰汤对大鼠重症急性胰腺炎时急性肺损伤治疗作用的观察[J].中国中西医结合外科杂志,2003,9(4):302 -306.
