2-脱氧-D-葡萄糖与奥沙利铂对人肝癌SMMC-7721 细胞增殖及凋亡的影响*
2011-12-23庞志刚
耿 翔, 周 奇, 刘 超, 尚 闯, 庞志刚△
(1 郑州大学第二附属医院普外科,河南 郑州450003;2 中山大学附属第一医院肝胆外科,广东 广州510080)
肝癌作为一种常见的恶性肿瘤,严重危及人类的身心健康。全身化疗作为肝癌综合治疗的重要组成部分,目前的临床治疗效果却并不理想。这其中的原因既包括现有化疗药物药效不佳、毒副作用大,又包括肝癌细胞易被诱导产生耐药性等。因此寻求新的治疗药物、制定新的化疗方案已成为当前肝癌治疗的研究热点[1]。研究发现2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)作为一种糖酵解抑制剂,能够通过影响肿瘤细胞能量的合成,达到抑制肿瘤细胞生长的作用[2]。本实验中,我们观察了2-DG与奥沙利铂(oxaliplatin,L-OHP)单药及联合应用对人肝癌细胞SMMC-7721 增殖及凋亡的影响,以期能够为肝癌的治疗提供新的思路和实验依据。
材 料 和 方 法
1 材料
人肝癌细胞SMMC-7721 由河南省肿瘤医院中心实验室赠与。四甲基偶氮唑蓝(methyl thiazolyl terazolium,MTT)、二甲基亚砜(dimethlsulfoxide,DMSO)和2-DG 均购自Sigma,L-OHP 为南京制药厂出产,细胞凋亡检测试剂盒Annexin V-FITC/PI 购于联科生物工程有限公司,caspase-3 试剂盒购于碧云天生物技术研究所。
2 方法
2.1 实验分组 实验分为空白对照组、2-DG 组、L-OHP 组及2-DG 联合L-OHP 组。各实验组除药物剂量不同外培养环境相同。在检测药物对细胞的增殖抑制率时,将2-DG 按浓度分为6 mmol/L、12 mmol/L 和24 mmol/L 3 组;将L-OHP 按浓度分为10 μmol/L、20 μmol/L 和40 μmol/L 3 组;联合用药组也按浓度分为6 mmol/L 2-DG 联合10 μmol/L L-OHP、12 mmol/L 2-DG 联 合 20 μmol/L L-OHP、24 mmol/L 2-DG 联合40 μmol/L L-OHP 3 组。在检测细胞周期和凋亡率以及caspase-3 活性时,药物浓度2-DG 均为12 mmol/L,L-OHP 均为20 μmol/L。
2.2 细胞培养 SMMC-7721 细胞常规培养于含10%胎牛血清的DMEM 培养液中,置于5%CO2、37℃恒温培养箱内培养。取对数生长期的细胞,调整细胞浓度进行实验。
2.3 MTT 法检测细胞增殖抑制率 将SMMC-7721 细胞以3 ×104/well 密度接种于96 孔板中,培养细胞至对数生长期后加入各组药物,每组设5 个复孔。加药后分别培养24 h、48 h、72 h,然后每孔加MTT(5 g/L)20 μL,继续培养4 h,随后加入150 μL DMSO,振荡10 min 后用酶标仪在490 nm 处测定各孔的吸光度(A)值,以计算细胞增殖抑制率。抑制率(%)=[(空白对照组A 值-实验组A 值)/空白对照组A 值]× 100%。采用协同作用q 值[3]判断2-DG和L-OHP 联合应用的性质:q =EAB/(EA+EB-EA×EB)。式中EAB为两药合用抑制率,EA和EB为各药单用抑制率,q >1.15 示两药有协同作用,0.85≤q≤1.15 示两药有相加作用,q <0.85 示两药有拮抗作用。
2.4 流式细胞仪检测细胞周期及凋亡率 调整细胞浓度为5 ×108/L,种植于6 孔板中。药物处理48 h 后采用PI 染色法行细胞周期检测:胰酶消化6 孔板中细胞后将其移至离心管中,加入PBS 液,1 000 r/min 离心10 min,前后离心2 次。室温避光PI 染色30 min 后通过流式细胞仪检测细胞周期。给药48 h后采用Annexin V-FITC/PI 双染色法行细胞凋亡率检测:药物作用48 h 后,消化、离心方法同前,加入1 mL binding buffer 后再加入10 μL Annexin V-FITC和5 μL PI,避光室温反应15 min,应用流式细胞仪检测细胞凋亡率。
2.5 Caspase-3 活性测定 给药处理24 h 后,收集各组细胞3 ×106个,600 r/min 于4 ℃离心5 min,收集细胞,吸除上清,PBS 洗涤1 次。加入裂解液,重悬沉淀,冰浴裂解15 min,4 ℃离心10 min 后把上清转移到预冷的离心管中。加缓冲液混匀,加10μL Ac-DEVD-pNA (2 mmol/L)后混匀。37 ℃孵育100 min,酶联免疫检测仪在405 nm 处测定A 值。结果以吸光度(A)值的比值(实验组A 值/空白对照组A 值)表示。
3 统计学处理
结 果
1 MTT 检测药物对SMMC-7721 细胞生长的抑制作用
2-DG 和L-OHP 单药及联合用药对肝癌细胞均具有增殖抑制作用。同一浓度不同时间,或同一时间不同药物浓度,各组间抑制率相比较差异均显著(P <0.05),呈时间剂量依赖性;联合用药后3 个时段的协同作用q 值均>0.85,提示两药具有协同、相加作用,见表1。
表1 2-DG 与L-OHP 对肝癌SMMC-7721 细胞的生长抑制率Table 1. The inhibitory rates of 2-DG and/or L-OHP on the growth of SMMC-7721 cells at different time points(%. ±s.n=6)
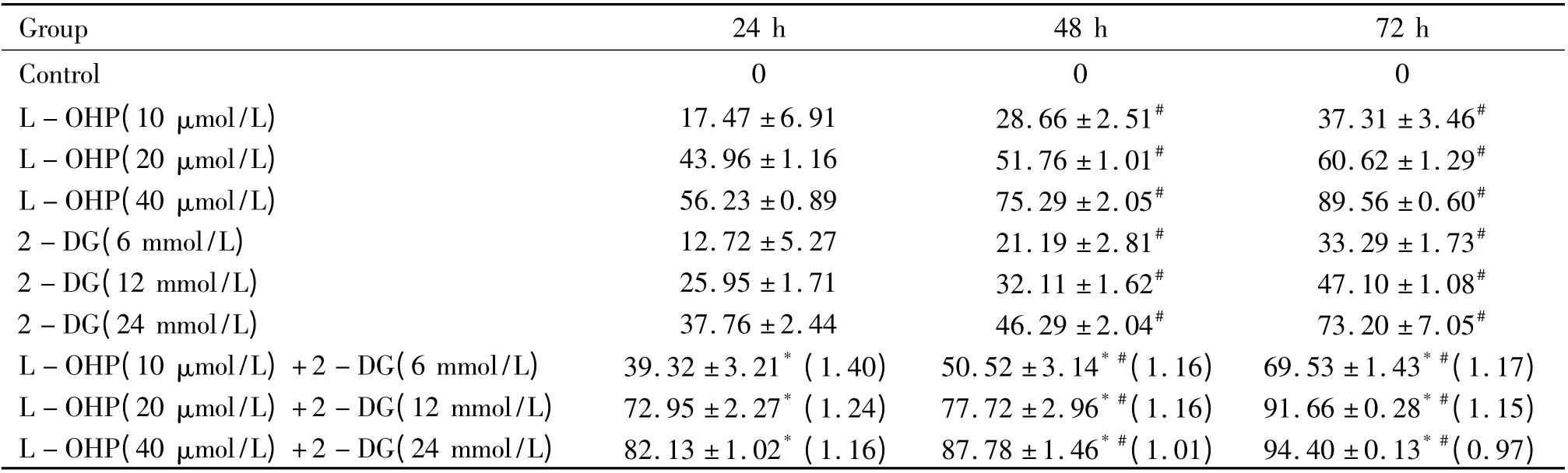
表1 2-DG 与L-OHP 对肝癌SMMC-7721 细胞的生长抑制率Table 1. The inhibitory rates of 2-DG and/or L-OHP on the growth of SMMC-7721 cells at different time points(%. ±s.n=6)
* P <0.05 vs other groups at the same time point;#P <0.05 vs the same group at 24 h.The numbers in the parentheses of combination group are q values.
Group 24 h 48 h 72 h Control 0 0 0 L-OHP(10 μmol/L) 17.47 ±6.91 28.66 ±2.51# 37.31 ±3.46#L-OHP(20 μmol/L) 43.96 ±1.16 51.76 ±1.01# 60.62 ±1.29#L-OHP(40 μmol/L) 56.23 ±0.89 75.29 ±2.05# 89.56 ±0.60#2-DG(6 mmol/L) 12.72 ±5.27 21.19 ±2.81# 33.29 ±1.73#2-DG(12 mmol/L) 25.95 ±1.71 32.11 ±1.62# 47.10 ±1.08#2-DG(24 mmol/L) 37.76 ±2.44 46.29 ±2.04# 73.20 ±7.05#L-OHP(10 μmol/L)+2-DG(6 mmol/L) 39.32 ±3.21* (1.40) 50.52 ±3.14* #(1.16) 69.53 ±1.43* #(1.17)L-OHP(20 μmol/L)+2-DG(12 mmol/L) 72.95 ±2.27* (1.24) 77.72 ±2.96* #(1.16) 91.66 ±0.28* #(1.15)L-OHP(40 μmol/L)+2-DG(24 mmol/L) 82.13 ±1.02* (1.16) 87.78 ±1.46* #(1.01) 94.40 ±0.13* #(0.97)
2 2-DG 和L-OHP 单药及联合用药对SMMC-7721 细胞周期的影响
2-DG 单药作用可使细胞周期阻滞于G2/M期。L-OHP 单药应用主要使细胞阻滞于S 期。联合用药后,细胞被阻滞于S 及G2/M 期(P <0.05),见表2、图1。

Figure 1. Cell cycle determined by flow cytometry. A:control group;B:2-DG group;C:L-OHP group;D:2-DC + L-OHP group.图1 流式细胞术检测细胞周期
表2 2-DG 与L-OHP 对SMMC-7721 细胞周期及细胞凋亡的影响Table 2. The effects of 2-DG and/or L-OHP on the cell cycle and apoptotic rate of SMMC-7721 cells(%.±s.n=6)
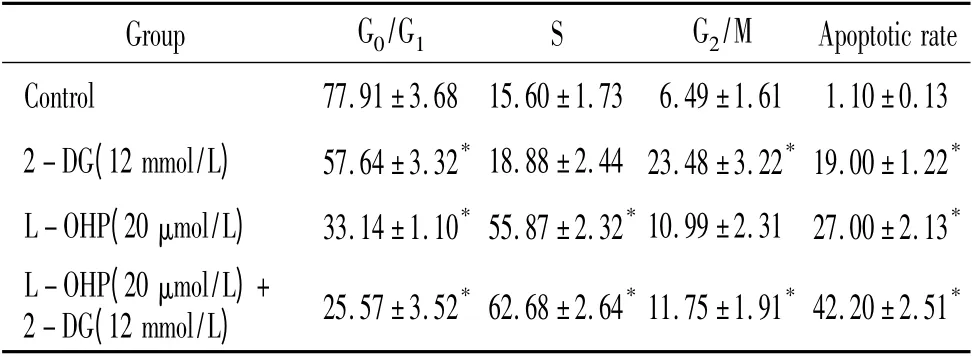
表2 2-DG 与L-OHP 对SMMC-7721 细胞周期及细胞凋亡的影响Table 2. The effects of 2-DG and/or L-OHP on the cell cycle and apoptotic rate of SMMC-7721 cells(%.±s.n=6)
* P <0.05 vs control group.
Group G0/G1 S G2/M Apoptotic rate Control 77.91±3.68 15.60±1.73 6.49±1.61 1.10±0.13 2-DG(12 mmol/L) 57.64±3.32* 18.88±2.44 23.48±3.22* 19.00±1.22*L-OHP(20 μmol/L) 33.14±1.10* 55.87±2.32* 10.99±2.31 27.00±2.13*L-OHP(20 μmol/L)+2-DG(12 mmol/L) 25.57±3.52* 62.68±2.64* 11.75±1.91* 42.20±2.51*
3 2-DG 和L-OHP 单药及联合用药对SMMC-7721 细胞凋亡的影响
2-DG 与L-OHP 单药组的凋亡率大于对照组;联合用药组凋亡率大于单药组,差异均显著(P<0.05),见表2、图2。
4 2-DG 及L-OHP 单药联合用药对SMMC-7721 细胞caspase-3 活性的影响
应用caspase-3 活性试剂盒检测caspase-3 活性,结果表明2-DG 作用于细胞后,caspase-3 的活性增加;而联合用药组则能够诱导肝癌细胞SMMC-7721 的caspase-3 活性明显增强,见表3。

Figure 2. Apoptosis detected by flow cytometry.A:control group;B:2-DG group;C:L-OHP group;D:2-DG+L-OHP group.图2 流式细胞术检测细胞凋亡
表3 Caspase-3 活性的变化Table 3. The changes in caspase-3 activity(±s.n=3)

表3 Caspase-3 活性的变化Table 3. The changes in caspase-3 activity(±s.n=3)
* P <0.05 vs other groups.
Group Caspase-3 activity Control 1.00 2-DG(12 mmol/L) 1.53 ±0.07 L-OHP(20μmol/L) 1.93 ±0.10 L-OHP(20μmol/L)+2-DG(12 mmol/L) 2.60 ±0.05*
讨 论
大多数正常细胞在有氧状态下是以糖的有氧分解作为获得能量的主要方式,只有在缺氧时才依靠无氧糖酵解供能。而肿瘤细胞却与之不同。1924年,德国生物化学家奥托·海因里希·瓦博格(Otto Heinrich Warburg)发现并描述了肿瘤细胞的能量代谢特点,即肿瘤细胞即使在有氧条件下也会更倾向于通过无氧糖酵解的途径来获取能量,这便是著名的瓦博格效应(Warburg effect)[4]。随着现代生物科学技术的发展,瓦博格效应的正确性以及在肿瘤细胞中的普遍性已经逐步得到了证实[5],尽管其确切的形成机制还未被阐明,但是它对肿瘤细胞的能量代谢特点的描述已经为针对糖酵解途径的靶向治疗提供了理论依据和治疗契机。
基于对瓦博格效应的理解,人们意识到如果对癌症病人施以糖酵解抑制治疗,则治疗用药将会更针对肿瘤细胞发挥作用,而对正常细胞影响较小。这样的治疗方式在突出靶向治疗理念的同时,也通过不同于常规化疗药物的作用途径达到治疗肿瘤的目的。作为糖酵解抑制剂的一种,2-DG 潜在的抗癌效果正逐步得到人们的重视。有关研究显示2-DG在进入细胞后,可被糖酵解的限速酶己糖激酶磷酸化为磷酸脱氧葡萄糖,从而竞争性地抑制己糖激酶与葡萄糖的反应,减少6-磷酸葡萄糖合成,限制糖酵解后续反应的发生,降低了糖酵解过程中的ATP 形成,通过影响细胞的能量代谢最终抑制细胞的生长[6]。已有研究显示2-DG 对乳腺癌、胰腺癌等癌细胞的生长增殖都能起到较好的抑制作用[7、8],其不仅可作为放射治疗的辅助用药提高放疗的敏感性,而且在与顺铂、阿霉素、紫杉醇等常规化疗药物联合应用时均能够提高相关药物的抗肿瘤作用。为进一步了解2-DG 对肝癌细胞的抑制效果以及其与化疗药物联合应用对肝癌细胞增殖凋亡的影响,我们设计并开展了此次实验。
实验中我们发现不同浓度的2-DG 均对肝癌细胞SMMC-7721 的生长具有抑制作用,并且这种抑制作用随着药物浓度和用药时间的增加逐步提高。实验中2-DG 能够诱导SMMC-7721 细胞凋亡,并将细胞周期主要阻滞在DNA 合成的后期和有丝分裂期,我们考虑作为能量抑制剂的2-DG,其对肿瘤细胞的影响可能需要等到ATP 耗竭达到一定的程度时才会产生抑制作用,并诱导肿瘤细胞的凋亡。在实验中2-DG 与L-OHP 联合用药组表现了较好的肿瘤抑制效果,两药显示出了协同、相加效应。两药联合应用后能阻滞SMMC-7721 细胞于S 期及G2/M 期,并较单药组更好的诱导了肝癌细胞的凋亡。化疗药物对DNA 的破坏会造成与糖酵解有关的酶的合成减少,从而影响到肿瘤细胞自身的能量供应[9];而由此以及糖酵解抑制所导致的能量生成减少又势必会影响DNA 修复酶修复被破坏DNA 时对能量的需求。这样一个恶性循环过程的形成,使不同作用机制的两药最终加速了细胞的死亡。
Caspase 家族是一类半胱氨酸天冬氨酸蛋白酶。活化的caspase-3 作为该家族中的一员是凋亡过程中一个重要的执行蛋白,对细胞凋亡的发生与调节起重要作用,其活性的表达与细胞凋亡程度呈现出正相关性[10]。在本实验中,我们观察到2-DG 作用于SMMC-7721 细胞后caspase-3 活性明显高于对照组;同时2-DG 对L-OHP 诱导的细胞caspase-3 活性增加有明显的促进作用。据此我们认为caspase-3 参与了2-DG 和L-OHP 诱导SMMC-7721 细胞凋亡的调控,通过其活性的激活最终导致了凋亡的增加。有关这一过程的具体作用机制目前还不明确,尚有待进一步的研究。
综上所述,此次体外细胞实验我们验证了2-DG对肝癌细胞治疗的有效性,也了解到其与化疗药奥沙利铂合用应用所具有的协同效应,这些都让我们为2-DG 潜在的临床价值充满期待。由于缺氧是实体肿瘤在体内的常见状态,同时缺氧条件下的肝癌细胞将会比常氧条件的细胞更倾向、更依赖无氧糖酵解来获取能量,我们下一步的研究将会针对2-DG 单药及与奥沙利铂合用对缺氧状态的肝癌细胞的影响以及进一步的体内实验而展开。
[1] 赵志成,庄 莉,贾长库,等. EGCG 抑制肝癌细胞株HepG2 增殖及HIF-1α/VEGF 的表达[J].中国病理生理杂志,2010,26(4):713-720.
[2] Zhang XD,Deslande E,Villedieu M,et al. Effect of 2-deoxy-D-glucose on various malignant cell lines in vitro[J]. Anticancer Res,2006,26(5A):3561-3566.
[3] 金正均.合并用药中的相加[J].中国药理学报,1980,1(2):70-76.
[4] Vander Heiden MG,Cantley LC ,Thompson CB. Understanding the Warburg effect :the metabolic requirements of cell proliferation[J]. Science,2009,324(5930):1029-1033.
[5] Gambhir SS. Molecular imaging of cancer with positronemission tomography[J]. Nat Rev Cancer,2002,2 (9):683-693.
[6] 慕 容,胡 容,郭青龙.肿瘤细胞的糖酵解机制与基于糖酵解的肿瘤治疗策略[J].药物生物技术,2009,16(6):573-577.
[7] 程 秀,刘 浩,方 琳,等.2-DG 增强乳腺癌细胞对阿霉素化疗敏感性的作用[J]. 中国药理学通报,2010,26(10):1371-1376.
[8] 韩保卫,刘光辉,董帅军,等. 糖酵解抑制剂对低氧胰腺癌细胞增殖和凋亡的影响[J].中国普通外科杂志,2009,18(3):243-246.
[9] Zong WX,Ditsworth D,Bauer DE,et al.Alkylating DNA damage stimulates a regulated form of necrotic cell death[J].Genes Dev,2004,18(11):1272-1282.
[10] Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis[J].Acta Biochim Biophys Sin(Shanghai),2005,37(11):719-727.
