产木聚糖酶和纤维素酶真菌的酶学性质分析
2011-12-01麦国琴许晓萍余翠媚张立国王娟
麦国琴,许晓萍,余翠媚,张立国,王娟
(深圳大学 生命科学学院,广东 深圳 518060)
纤维素是地球上分布最广、蕴藏量最丰富的生物质,也是最廉价的可再生资源。纤维素酶是一类能够将纤维素降解为葡萄糖的多组分酶系的总称,它们协同作用,分解纤维素产生寡糖和纤维二糖,最终水解为葡萄糖[1]。纤维素酶可广泛用于食品、纺织、饲料、酿酒、石油勘探、中药成分提取等众多领域,特别是在纺织、洗涤、造纸和生物能源等工业应用上具有重要地位[2]。木聚糖是植物半纤维素的主要成分,是一种多聚五碳糖,且多以异质多糖形式存在,与纤维素分子之间存在氢键连接和物理混合。木聚糖酶是一类降解木聚糖分子的复杂酶系,包括内切β-1,4-木聚糖酶、β-D-木糖苷酶、α-L-呋喃型阿拉伯糖苷酶、乙酰木聚糖酯酶、酚酸酯酶等[3]。
南海沿岸红树林资源丰富,红树林(mangrove)是热带、亚热带海岸潮间带的木本植物群落[4]。其生态系统是一个特殊复杂的生境,植物凋落物极其丰富,其中含有大量的纤维素、半纤维素等,红树林区绝大多数真菌都能产生降解纤维素和其他植物成分的酶[5]。目前,研究人员对陆地环境中的真菌研究较多[6-8],而与红树林环境中真菌的分离鉴定、酶活及酶学性质分析等的相关研究相对较少。本研究从深圳福田红树林土壤环境中筛选高产纤维素酶、木聚糖酶的真菌菌株,并对其进行分子鉴定及酶学性质的研究。
1 材料与方法
1.1 样品来源
样品采自于深圳福田红树林表层0~15 cm的土壤,选择10个采集点,每点采集样品约10 g。
1.2 培养基
1)马丁氏琼脂培养基[9]:葡萄糖10 g,蛋白胨5 g,K2HPO41 g,MgSO4·H2O 0.5 g,琼脂20 g,海水750 mL,加去离子水至1 L,121℃灭菌30 min,温度降到50℃左右,加入青霉素、链霉素(其终浓度均为50μg/mL)。
2)液体种子培养基:mandels营养盐浓缩液100mL/L,mandels微量元素浓缩液1.0 mL/L,葡萄糖10 g/L,蛋白胨1 g/L,1 mol/L的柠檬酸缓冲液(pH 4.5)50 mL/L,吐温801.5 mL/L。
3)纤维素酶产酶培养基:微晶纤维素粉30 g/L,mandels营养盐浓缩液200 mL/L,mandels微量元素浓缩液1.0 mL/L,葡萄糖3 g/L,蛋白胨1 g/L,1 mol/L的柠檬酸缓冲液(pH 4.5)50 mL/L,吐温801.5 mL/L。
4)木聚糖酶产酶培养基:玉米芯粉30 g/L,mandels营养盐浓缩液200 mL/L,mandels微量元素浓缩液1.0 mL/L,葡萄糖3 g/L,蛋白胨1 g/L,1 mol/L的柠檬酸缓冲液(pH4.5)50 mL/L,吐温801.5 mL/L。
1.3 方法
1.3.1 红树林土壤真菌的分离与筛选
将采集的样品分别用无菌水适当稀释,涂布于马丁氏琼脂培养基平板,37℃培养2d,挑取单菌落在马丁氏琼脂培养基平板上划线纯化分离3次,得到纯种的真菌。
将纯化菌株(无菌水洗孢子3mL)接种于含有30mL液体种子培养基的三角摇瓶中,于28℃,250 r/min条件下振荡培养2d后,再取3 mL的液体种子接种于含有30 mL产酶培养基的三角摇瓶中于28℃,250 r/min条件下振荡培养4 d后分别检测其木聚糖酶及纤维素酶酶活。
1.3.2 木聚糖酶酶活测定
首先在试管中加入0.9 mL 0.5%的木聚糖溶液(由0.05 mol/L pH4.8的醋酸缓冲液配制)和0.1 mL适当稀释的酶液,50℃恒温水浴20 min后加入2 mL 3,5-二硝基水杨酸(DNS)试剂终止反应,煮沸5 min,冷却后测定其540 nm下的吸光值,以木糖作标准。酶活定义:1 mL酶液在50℃和pH 4.8条件下,每分钟水解木聚糖生成1 μmol木糖的量为1个酶活力单位,以IU表示。
1.3.3 纤维素酶活测定
在试管中加入0.9 mL 1%的微晶纤维素溶液(由0.05 mol/L pH4.8的柠檬酸缓冲液配制)和0.1 mL适当稀释的酶液,50℃恒温水浴20 min后加入2 mL DNS试剂终止反应,煮沸5 min,冷却后测定其540 nm下的吸光值,以葡萄糖作标准。酶活定义:1 mL酶液在50℃和pH4.8条件下,每分钟水解纤维素生成1 μmol葡萄糖的量为1个酶活力单位,以IU表示。
1.3.4 最适pH和最适温度的测定
最适pH测定:配制pH1~pH12的缓冲液,分别在pH1~pH12条件下按照1.3.2及1.3.3方法测定木聚糖酶和纤维素酶活性。
最适温度测定:用pH 4.8缓冲液配制底物,分别在10℃~80℃条件下按照1.3.2及1.3.3方法测定木聚糖酶和纤维素酶活性。
1.3.5 菌株的鉴定
形态观察方法参考乳酸石碳酸棉蓝染色液染色法[10]。
分子鉴定:提取真菌的基因组DNA,采用真菌5.8S rDNA通用引物ITS1及ITS4[11]扩增菌株的5.8S rDNAITS(内部转录间隔区,internal transcriber spacer)序列,对PCR产物进行切胶回收、测序,将所得序列与GenBank数据库中序列进行tblastx分析比对。
2 结果与分析
2.1 分离菌株概况
深圳福田红树林土壤样品经分离纯化,在含抗生素的马丁氏琼脂培养基上涂布、划线、纯化,共分离得到80株真菌。把这80株真菌分别接到液体种子培养基、产酶培养基上复筛,得到2株(菌株1和菌株2)同时具有较高木聚糖酶和纤维素酶活的真菌。经测定,菌株1的木聚糖酶和纤维素酶活分别为42.16 IU和3.05 IU,菌株2的木聚糖酶和纤维素酶活分别为39.01 IU和0.87 IU。
2.2 2株红树林土壤真菌的形态观察
菌株1和菌株2在马丁氏培养基上的菌落特征和分生孢子结构见图1。
图1a显示,菌株1在马丁氏培养基上28℃培养7 d,直径约60 mm,中间有脐状突起而其他部分平坦;质地绒状;分生孢子大量产生;分生孢子面先是粉红色,后来变成暗绿色,菌落反面为黄褐色。图1b显示,菌株2在马丁氏培养基上28℃培养7 d,直径约65 mm,平坦并具有辐射状沟纹;质地丝绒状,分生孢子大量产生,主要聚集在菌落的中部,为灰褐色,菌落反面呈淡黄色。
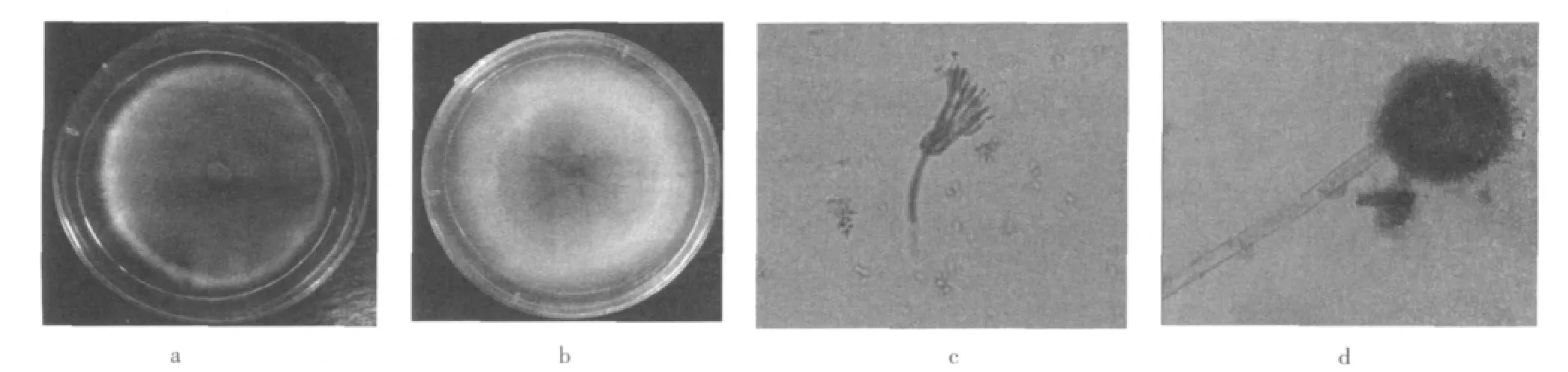
图1 菌株的菌落特征及分生孢子结构Fig.1 Characteristics of colony and conidia structure of two strains
经乳酸石碳酸棉蓝染色液染色后,在40 X光学显微镜下观察结果如下:图1c显示,菌株1其分生孢子梗茎壁平;帚状枝通常二轮生,偶有三轮生;梗基每轮2~4个,彼此较紧贴;分生孢子近似于椭圆形,分生孢子链近于圆柱状。图1d显示,菌株2其分生孢子囊为球形;分生孢子梗老时黄色或黄褐色,壁平滑;顶囊球形;分生孢子近似于球形。
2.3 2株红树林土壤真菌的分子鉴定
利用真菌5.8S rDNA通用引物ITS1及ITS4,分别从菌株1和菌株2的基因组DNA中扩增出一条特异性片段,序列大约600 bp。菌株1、2的基因组DNA及5.8S ITS PRC产物电泳图分别见图2、图3。
图2 两菌株的基因组DNAFig.2 Genome DNA of two strains
图3 两菌株的ITS序列Fig.3 ITS sequence of two strains
将扩增的ITS序列PCR产物进行切胶回收、测序,并把测序结果与GenBank数据库中序列进行tblastx比对分析,菌株1的ITS序列与Penicillium oxalicum strain XWSFJJ3(FJ977097)的相似性达到99.5%,同时结合形态观察,可确定菌株1为草酸青霉(Penicillium oxalicum);菌株2的ITS序列与Aspergillus piperis strain CBS 112811(FJ629352)的相似性达到99.6%,结合形态观察,可确定菌株2为曲霉属的Aspergillus piperis。
2.4 酶促反应最适温度的测定
在不同的温度条件下测定菌株1和菌株2的木聚糖酶活见图4。
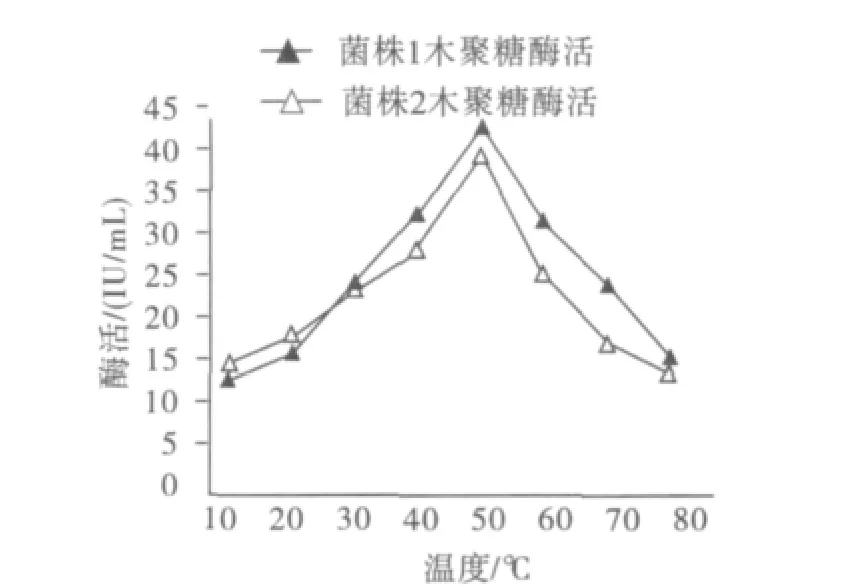
图4 木聚糖酶的最适温度Fig.4 Optimum temperature of xylanase
由图4可知,2种真菌的木聚糖酶活的最适温度均为50℃,酶活分别为42.16 IU和39.01 IU;并且在40℃~60℃范围内都能保持67.1%以上的酶活,尤其菌株1在70℃下仍保持64.3%的酶活,说明该菌产生的木聚糖酶具有一定的耐热性,有较好的应用潜能。
在不同的温度条件下测定菌株1和菌株2的纤维素酶活见图5。
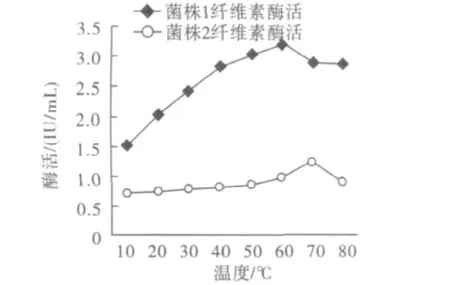
图5 纤维素酶的最适温度Fig.5 Optimum temperature of cellulase
同图5可以看出,菌株1的纤维素酶的最适温度是60℃,酶活为3.18 IU;菌株2的纤维素酶活的最适温度是70℃,酶活为1.22 IU,尽管菌株2的纤维素酶活较低,但其具有一定的耐热性,而且在30℃~80℃范围内酶活活性变化不明显,说明温度适用范围较广。
2.5 酶促反应最适pH的测定
在不同的pH条件下测定菌株1和菌株2的木聚糖酶酶活,见图6。
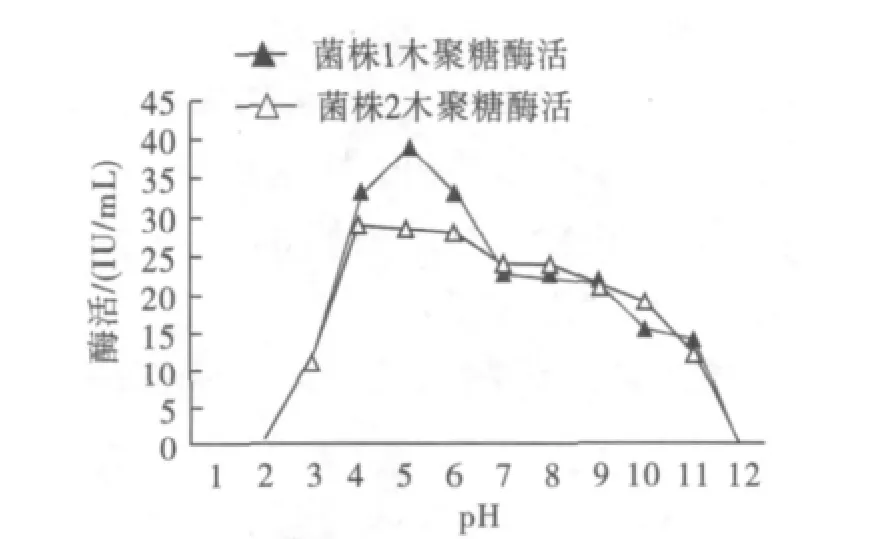
图6 木聚糖酶的最适pHFig.6 Optimum pH value of xylanase
由图6可知,菌株1木聚糖酶的最适pH为5.0,但在pH 4和pH 6时仍分别保持85.6%和84.1%以上的酶活;菌株2木聚糖酶的最适pH为4.0,在pH 4~8范围内酶活变化不明显,说明该木聚糖酶的pH适用范围较广,有利于酶在工业中的应用。但当pH大于9时,两菌的木聚糖酶活明显下降,在pH 12时几乎没有酶活。不同pH条件下菌株1和菌株2的纤维素酶酶活见图7。
图7显示菌株1和菌株2纤维素酶的最适pH均为3.0。菌株1和菌株2在pH 2~5范围内纤维素酶酶活变化不明显,说明两菌株均产生酸性纤维素酶。
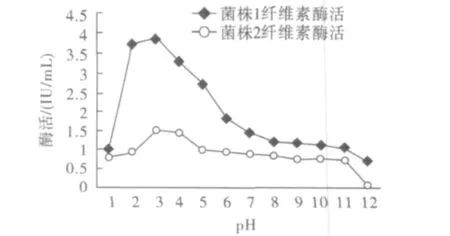
图7 纤维素酶的最适pHFig.7 Optimum pH value of cellulase
3 结论与讨论
南海红树林产纤维素酶或木聚糖酶的土壤微生物厦门大学和海南大学已有报道[12-13],但对分离菌株的分子鉴定及最适温度、pH等特性并未有详细数据。我们应用分子生物学手段,对菌株进行了分子鉴定,并对相关酶学性质进行了研究。
rDNA上的5.8、18和28 S rDNA基因有极大的保守性,同时绝大多数的真核生物都有极为广泛的序列多态性,即亲缘关系非常接近的2个种都能在ITS序列上表现出差异,显示最近的进化特征,这就是ITS序列在微生物种类鉴定的理论基础[14]。从深圳福田红树林土壤环境中筛选的产纤维素酶、木聚糖酶的真菌菌株,根据ITS序列特征,本研究鉴定的2个菌株,其ITS序列与数据库中已知菌株的序列相似性均高于99.5%,结合形态观察的结果,最终确定菌株1为草酸青霉(Penicillium oxalicum),菌株2为曲霉属的Aspergillus piperis。
本实验中菌株2纤维素酶的最适温度是70℃,属于嗜热纤维素酶[15],可应用于农业,使纤维素降解为糖,再由糖转化为乙醇,产嗜热纤维素酶的工程菌可在高温条件下大量生产酒精,为能源建设开辟新途径。本实验分离的两菌株纤维素酶最适pH均为3.0,说明均具有较强的耐酸性,酸性纤维素酶可广泛应用于酿酒、酿醋、果汁等食品工业中[16]。
由于酸性木聚糖酶在pH 4.0以下时仍然保持较高酶活性,可广泛应用于饲料加工、酿酒工业、果汁加工等领域[17]。本研究所筛选的Penicillium oxalicum和Aspergillus piperis均具有较高的木聚糖酶酶活。今后将进一步优化培养条件和培养基组分,提高酶活性。克隆相关的功能基因,深入研究其酶学性质,为开发新型纤维素酶和木聚糖酶制剂奠定基础。
[1]Eveleigh DE.Cellulase:a perspective[J].Phil Trans Royal Soc Lond Ser A,1987(321):435-447
[2]邱雁临.纤维素酶的研究和应用前景[J].粮食与饲料工业,2001(8):30-31
[3]Polizeli ML,Rizzatti AC,Monti R,et al.Xylanases from fungi:properties and industrial applications[J].Appl Microbiol Biotechnol,2005,67(5):577-591
[4]林鹏.红树林[M].北京:海洋出版社,1984:1-3
[5]曹启民,郑康振,陈耿,等.红树林生态系统微生物学研究进展[J].生态环境,2008,17(2):839-845
[6]Bridge P,Spooner B.Soil fungi:diversity and detection[J].Plant and soil,2001,232(1):147-154
[7]吴萍,史钧,骆丙国.真菌木聚糖酶产生菌的筛选及酶学性质研究[J].食品科学,2009,30(1):159-163
[8]国春艳,刁其玉,乔宇,等.酸性木聚糖酶产生菌株的筛选和酶学性质分析[J].中国农业科学,2010,43(7):1524-1530
[9]孔华忠.中国真菌志(青霉属及其相关有性型属)[M].北京:科学出版社,2007:22-23
[10]徐威.微生物学实验[M].北京:中国医药科技出版社,2004:37-38
[11]White TJ,Bruns T.Analysis of phytogenetic relationships by amplification and direct sequencing of ribosomal RNA genes[M].New York Academic Press,1990:315-322
[12]蒋云霞.基于红树林土壤微生物资源研发的宏基因组学平台技术的建立与应用初探[D].厦门:厦门大学博士论文,2007:1-2
[13]高阳,刘四新,王春燕.红树林土壤中高产纤维素酶菌株的筛选[J].热带农业工程,2009,33(4):9-12
[14]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786
[15]张华锋.纤维素酶研究进展[J].现代农业科学,2009,16(6):25-39
[16]刘春芬,贺稚非,蒲海燕,等.纤维素酶及应用现状[J].粮食与油脂,2004(1):15-17
[17]田永,侯运华,于同立.酸性木聚糖酶的应用研究进展[J].粮油加工,2008(5):110-113
