促肾上腺皮质激素受体检测和肿瘤细胞超微结构观察在肾上腺皮质肿瘤亚型诊断中的应用价值
2011-12-01李汉忠严维刚石冰冰
樊 华,李汉忠,严维刚,石冰冰
中国医学科学院 北京协和医学院 北京协和医院泌尿外科,北京100730
·论著·
促肾上腺皮质激素受体检测和肿瘤细胞超微结构观察在肾上腺皮质肿瘤亚型诊断中的应用价值
樊 华,李汉忠,严维刚,石冰冰
中国医学科学院 北京协和医学院 北京协和医院泌尿外科,北京100730
目的评估促肾上腺皮质激素受体(ACTH-R)检测和肿瘤细胞超微结构观察在肾上腺皮质肿瘤亚型诊断中的应用价值。方法采用Polymer免疫组织化学染色方法检测87例肾上腺皮质肿瘤组织中的ACTH-R表达情况,并以10例正常肾上腺组织作为对照;电子显微镜观察肿瘤细胞的超微结构,比较超微结构间的差异。结果sub-CPA组、CPA组、APA组、NFA组和NC组的ACTH-R阳性表达率分别为(80.1±8.2)%、(53.2±10.3)%、(63.2±10.1)%、(83.3±6.5)%和(70.1±7.3)%,其中,NFA组和sub-CPA组均明显高于NC组(P=0.001,P=0.000)、APA组(P=0.000,P=0.000)及CPA组(P=0.000,P=0.000),NC组明显高于APA组(P=0.039),APA组明显高于CPA组(P=0.037),NFA与sub-CPA组间差异无统计学意义(P=0.325)。透射电子显微镜观察结果显示,肾上腺皮质肿瘤具有部分相似的超微结构,但不同亚型肾上腺皮质肿瘤细胞内分泌颗粒的类型和数量存在差异。结论ACTH-R检测和肿瘤细胞超微结构观察可用于区分不同分泌功能的肾上腺皮质肿瘤。
肾上腺皮质肿瘤;亚型;促肾上腺皮质激素受体;超微结构
肾上腺皮质肿瘤是常见的内分泌肿瘤,典型的功能性皮质肿瘤包括醛固酮分泌瘤(aldosterone-producing adenoma,APA)及皮质醇分泌瘤(cortisol-producing adenoma,CPA)。目前主要依靠临床表现及内分泌检查区分不同分泌功能的肾上腺皮质肿瘤,而对于临床中常见的意外瘤(adrenal incidentalomas,AIA)(主要包括亚临床状态肾上腺肿瘤及无功能腺瘤)的认识尚有许多不足,明确诊断肾上腺皮质肿瘤的亚型对治疗及预后有重大意义。促肾上腺皮质激素受体(adrenocorticotropin-receptor,ACTH-R)主要分布于肾上腺皮质,可与促肾上腺皮质激素(Adrenocorticotropin,ACTH)特异性结合,引发肾上腺皮质激素分泌,在肾上腺分泌功能的发生、发展中发挥主要作用[1-2]。Latronico[3]研究发现,ACTH-R在不同类型肾上腺肿瘤中的表达有显著差异,提示ACTH-R异常可能参与了肾上腺皮质肿瘤中细胞的增殖和分化。目前肾上腺肿瘤常采用的病理诊断方法,主要倾向于鉴别肿瘤的良恶性[4-7],对肾上腺皮质肿瘤的亚型难以作出有效判断。本研究评估了ACTH-R检测和肿瘤细胞超微结构观察在肾上腺皮质肿瘤亚型诊断中的应用价值。
材料和方法
标本来源2008年3月至2010年7月在北京协和医院就诊的肾上腺肿瘤患者87例,包括:(1)肾上腺亚临床皮质醇分泌瘤(sub-Clinical Cortisol-producing adenoma,sub-CPA)24例,其中,男11例,女13例,平均年龄(33.4±4.2)岁(29~52岁);诊断标准:临床上无典型皮质醇增多症的表现,血皮质醇和24 h尿游离皮质醇水平轻度升高,小剂量地塞米松抑制实验不被抑制,CT显示为肾上腺占位病变,术后病理证实为肾上腺皮质腺瘤。(2)CPA 20例,其中,男11例,女9例,平均年龄(38.6±3.2)岁(31~49岁);诊断标准:临床上有皮质醇增多症的表现,血皮质醇和24 h尿游离皮质醇水平升高,大小剂量地塞米松抑制实验均不被抑制,CT显示为肾上腺占位病变,术后病理证实为肾上腺皮质腺瘤。(3)APA 20例,其中,男10例,女10例,平均年龄(37.6±4.3)岁(31~50岁);诊断标准:临床上有高血压和/或低血钾,高醛固酮、低肾素活性,正常皮质醇水平,CT显示为肾上腺占位病变,术后临床表现好转或消失,病理证实为肾上腺皮质腺瘤。(4)肾上腺无功能腺瘤(adrenal nonfunctional adenoma,NFA)23例,其中,男13例,女10例,平均年龄(40.1±4.1)岁(28~60岁);诊断标准:临床上没有皮质醇及醛固酮增多症表现,血皮质醇和24 h尿游离皮质醇水平正常,醛固酮、肾素活性均正常,CT显示为肾上腺占位病变,术后病理证实为肾上腺皮质腺瘤。2008年6月至2010年4月在北京协和医院就诊并行根治性肾切除的肾癌患者10例,其中,男5例,女5例,平均年龄(42.3±5.1)岁(35~66岁),术后病理证实一并切除的肾上腺组织无转移,收集其正常肾上腺组织(normal adrenal cortex,NC)作为对照。以上标本离体后迅速切取1块1 cm×1 cm×1 cm大小组织,用冷PBS冲洗3次以去除血迹后立即置于液氮冻存,用于ACTH-R检测。同时取1块1.0 mm×1.0 mm组织块,冷PBS冲洗3次后置于2.5%戊二醇固定液,4℃冻存备用,用于细胞的超微结构观察。本研究经北京协和医院伦理委员会审查批准,所有患者均签署知情同意书。
ACTH-R检测采用Polymer免疫组织化学方法,一抗ACTH-R为兔抗人多克隆抗体,效价为1∶40,产品编号SC-13107,购自美国Santa Cruz公司;超敏即用型二步法(非生物素)检测试剂盒购自美国GBI公司,试剂盒组成包括:内源性过氧化酶阻断剂(试剂A)、聚合物辅助剂(Polymer Helper)、辣根酶标记抗兔IgG多聚体(Poly Peroxidase-anti-Rabbit IgG); 3, 3’-4盐酸二氨基联苯胺(3,3’-4 Diaminobenzidine ,DAB)显色试剂盒购自瑞士Fluka公司。以PBS冲洗液替代一抗作阴性对照,具体操作过程参见试剂盒说明书。ACTH-R定位于细胞膜或胞浆, 阳性细胞胞膜或胞浆可出现黄色或棕褐色颗粒,对每例标本的ACTH-R阳性表达进行半定量分级,具体为10×30高倍镜下随机1~3个视野下观察500个细胞,计算每100个细胞中的阳性细胞表达率。
细胞超微结构观察采用JEM-1010透射电子显微镜(日本电子株式会社)观察肿瘤细胞的超微结构,主要试剂包括戊二醛固定液、饿酸固定液、柠檬酸铅染色剂等。操作过程包括取材、固定、脱水、浸透、包埋、超薄切片、电子染色等。其中,超薄切片是把标本切成厚度不超过0.1 μm的薄切片,是研究细胞、组织超微结构的关键性技术,本研究采用LEICA EM UC6超薄切片机(德国莱卡公司)进行操作,切片效果满意。
统计学处理采用SPSS 14.0统计软件,各组间阳性细胞表达率比较采用t检验及方差分析,P<0.05为差异有统计学意义。
结 果
ACTH-R检测结果sub-CPA组、CPA组、APA组、NFA组和NC组的ACTH-R阳性表达率分别为(80.1±8.2)%、(53.2±10.3)%、(63.2±10.1)%、(83.3±6.5)%和(70.1±7.3)%,其中,NFA组和sub-CPA组均明显高于NC组(P=0.001,P=0.000)、APA组(P=0.000,P=0.000)及CPA组(P=0.000,P=0.000),NC组明显高于APA组(P=0.039),APA组明显高于CPA组(P=0.037),NFA与sub-CPA组间差异无统计学意义(P=0.325)。
超微结构观察结果
正常肾上腺皮质球状带:球状带约占皮质的1/10,细胞较小,由3~5个细胞排列成腺泡状小球,约3~4层。细胞呈多边形或柱状,核大,圆形;胞质多,富有脂滴,脂滴的大小大致相仿;细胞内线粒体相对较小,呈狭长杆状或卵圆形,嵴呈板状或管状,基质深暗;滑面内质网少,常呈空泡状,粗面内质网罕见,Golgi复合体小,胞质中有大量游离核糖体。相邻细胞的间隙较大,常见细胞表面有少许微绒毛样突起,伸入细胞间隙。球状带可见中等量盐皮质颗粒,糖皮质颗粒罕见(图1)。

图1 正常肾上腺球状带见中等量盐皮质颗粒(箭头),糖皮质颗粒罕见(箭)Fig1 Zona glomerulosa of normal adrenal cortex, with moderate mineralocorticoid(arrowhead) and rarely seen glucocorticoid granules (arrow)
正常肾上腺皮质束状带:束状带约占皮质的3/5,细胞排列成条索状,在条索状细胞之间是伴行的毛细血管,束状带细胞至少有一面与毛细血管相邻。细胞较球状带细胞为大,也呈多边形,细胞内充满大小不一的脂滴;线粒体多,球形,大部分的嵴呈空泡状,基质较透明;滑面内质网丰富,大部分围绕线粒体和脂滴排列,一般找不到粗面内质网,胞质中有大量糖原粒和游离的核糖体,Golgi复合体中等大小,溶酶体数量少。可见少量糖皮质颗粒(图2)。
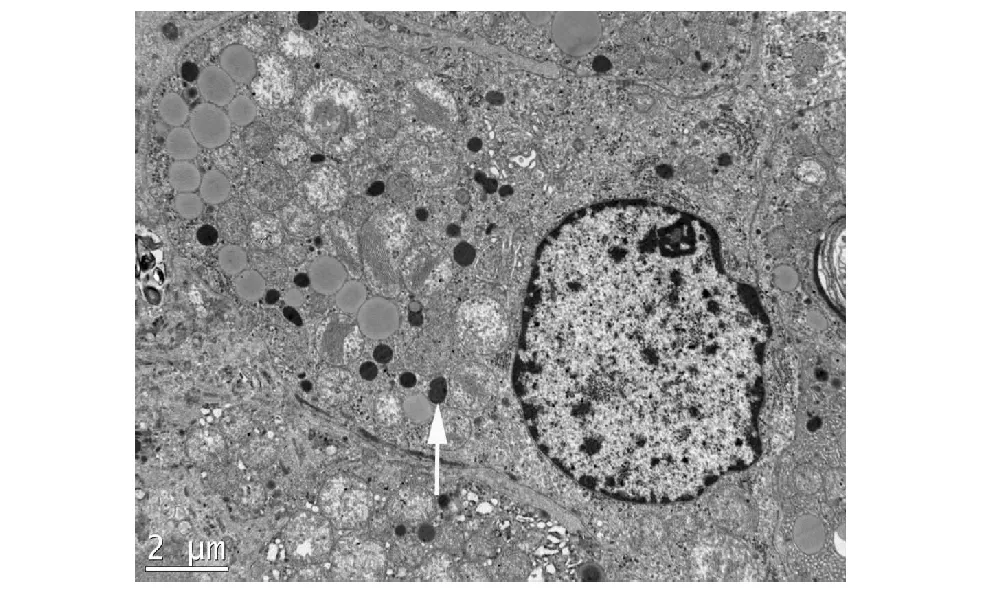
图2 正常肾上腺束状带见少量糖皮质颗粒(箭)Fig2 Fascicular zone of normal adrenal cortex, with a few glucocorticoid granules (arrow)
APA:细胞显示分泌醛固酮的球状带细胞特征,大部分瘤细胞主要由致密的细胞组成,细胞表面微绒毛增多。瘤细胞核以常染色质为主,核仁明显,球形、球面形或长形线粒体,线粒体有长管泡状嵴,堆状平行排列的细长的滑面和粗面内质网;线粒体丰富,高尔基复合体明显,滑面内质网少见,明显的脂褐素颗粒,有时可见核内假包涵体—螺内脂小体。可见大量空泡形成,中等量的盐皮质颗粒,糖皮质颗粒罕见(图3)。

图3 醛固酮分泌瘤见中等量盐皮质颗粒(箭头),糖皮质颗粒罕见Fig3 Ultrastructural of aldosterone-producing adenoma, with moderate mineralocorticoid(arrowhead)and rarely seen glucocorticoid granules
CPA:大部分瘤细胞符合束状带细胞形态特征,主要由致密细胞组成。细胞表面微绒毛增多,胞质丰富,内含少量脂滴;线粒体呈圆形或卵圆形,管泡状嵴;胞质中可见发育良好的高尔基复合体和滑面内质网,细胞器密度较高,主要为泡状滑面内质网和短股粗面内质网。瘤细胞胞质内含大量脂滴,直径1~2 μm,胞浆中可见中到大量糖皮质颗粒(图4)。

图4 皮质醇分泌瘤见大量糖皮质颗粒(箭)Fig4 Ultrastructural of cortisol-producing adenoma, with a large number of glucocorticoid granules (arrow)
sub-CPA:部分瘤细胞符合束状带细胞形态特征,主要由致密的细胞组成。细胞表面微绒毛增多,胞质丰富,内含少量脂滴,胞质中可见发育良好的高尔基复合体和滑面内质网,少量粗面内质网;细胞器密度较高,但胞内分泌颗粒少,偶见皮质醇颗粒(图5)。
NFA:细胞呈多边形或柱状,核大,圆形, 位于胞质中央;胞质多,富有脂滴,脂滴的大小大致相仿;线粒体相对较小,呈狭长杆状或卵圆形;基质深暗,滑面内质网少,常呈空泡状,粗面内质网罕见,Golgi复合体小,胞质中有大量游离核糖体。细胞内分泌颗粒罕见(图6)。
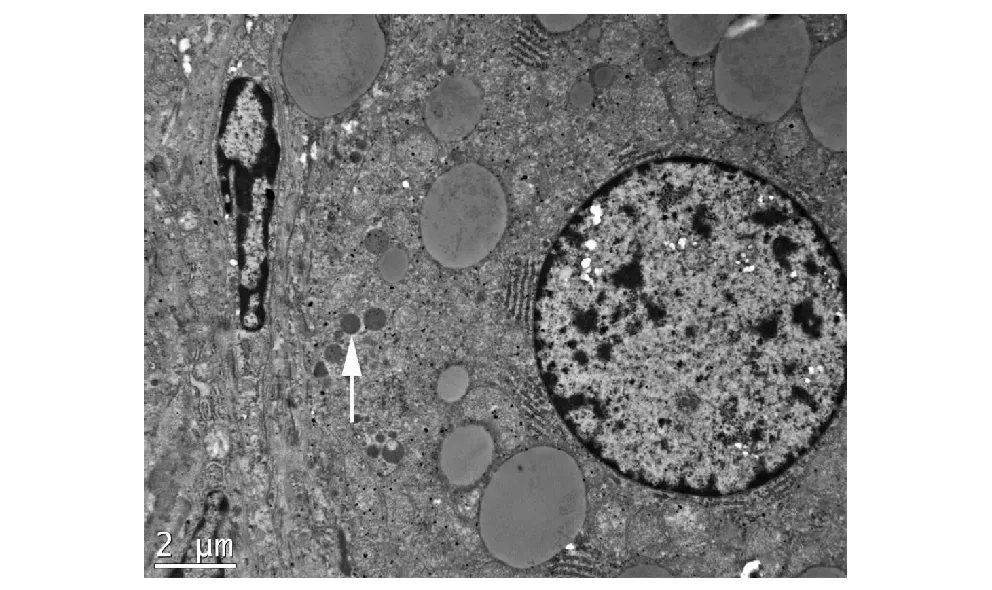
图5 亚临床皮质醇分泌瘤偶见糖皮质颗粒(箭)Fig5 Ultrastructural of sub-clinical cortisol-producing adenoma, with occasionally seen glucocorticoid granules(arrow)
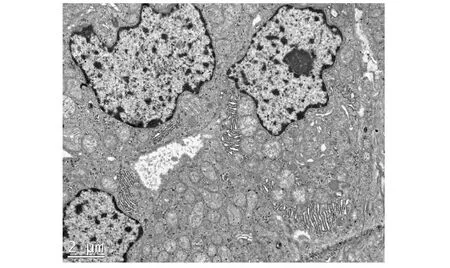
图6 无功能腺瘤盐皮质颗粒及糖皮质颗粒罕见Fig6 Ultrastructural of adrenal nonfunctional adenoma, with rarely seen mineralocorticoid and glucocorticoid granules
讨 论
ACTH-R属于褪黑素受体超家族,与其他褪黑素受体家族成员不同的是,ACTH-R可与ACTH特异性结合,而且分布上有高度的组织特异性,主要分布于肾上腺皮质[8]。ACTH-R的差异表达可能参与了肾上腺皮质肿瘤中细胞的增殖和分化,影响肾上腺皮质肿瘤的内分泌功能。本研究采用Polymer免疫组织化学方法,将二抗抗体分子的单价Fab片段和酶聚合在一起,替代传统方法中的二抗和三抗,直接放大抗原抗体结合的信号,可有效避免聚合分子过大而造成的空间位阻。与传统的SP三步法相比,具有快速、简单、阳性标记强度强等优点[9-10]。其中,独特的Polymer Helper可以使细胞的通透性发生改变,有利于大分子检测系统更好地结合所检测的一抗分子,此检测系统是目前已知的灵敏度最高的系列免疫组织化学检测系统[11-12]。实验中使用的一抗ACTH-R为兔抗人多克隆抗体,经预实验效价设定为1:40,但一抗孵育后需 4℃冰箱过夜,延长了实验时间,提示目前ACTH-R兔抗人多克隆抗体属实验用试剂,如应用于临床需完善试剂相关设计。本研究涵盖了肾上腺皮质肿瘤中的常见类型,ACTH-R阳性表达率由低到高依次为CPA、APA、NC、sub-CPA及NFA。除NFA与sub-CPA组间差异无统计学意义外,其余各组间差异均有统计学意义,提示通过免疫组织化学染色法区分不同分泌功能肾上腺皮质肿瘤具备一定的可行性。
Sub-CPA有自主分泌糖皮质激素而没有典型库欣综合征临床表现的状况,其在整体人群中的发病率约为78/10万[13-15 ]。文献报道sub-CPA发展到CPA的风险为12.5 %左右[16]。本研究中sub-CPA组ACTH-R阳性细胞表达数与CPA组间差异有统计学意义,接近NFA的ACTH-R阳性表达,提示sub-CPA应被列为肾上腺皮质肿瘤中的独立类型,sub-CPA进展为CPA的可能性较低,其机制尚待进一步研究[17],推测ACTH-R的差异表达可能是原因之一。
肾上腺皮质肿瘤内分泌颗粒的类型及数量差异决定肿瘤分泌功能的不同。有研究提示,肾上腺肿瘤分泌功能的发生可能与异位激素受体或激素的异位分泌等有关[18]。Ivsic等[19]研究发现,肾上腺皮质腺瘤的瘤细胞内可见神经内分泌颗粒。本研究结果显示,正常肾上腺球状带可见中等量盐皮质颗粒,束状带可见少量糖皮质颗粒,这些内分泌颗粒自细胞分泌入血后产生相应生理作用,维持机体内环境稳定。本研究还发现,NFA具有典型肿瘤的电镜结构,具备细胞间连接及细胞表面特征,但细胞内分泌颗粒罕见,没有内分泌功能,无法分泌肾上腺皮质激素。APA细胞内部密布盐皮质颗粒,提示其通过分泌大量盐皮质激素引起原发性醛固酮增多症。CPA细胞内部密布糖皮质颗粒,提示其通过分泌大量糖皮质激素引起库欣综合征[20]。Sub-CPA患者没有明显临床症状,可能是由于此类患者的肾上腺皮质细胞中用于合成糖皮质激素的细胞器比较少,或是皮质激素的生物合成酶活性较低,皮质醇产量相对不足,以至于不能够引起相应的临床症状[21]。本研究在观察sub-CPA超微结构时发现,sub-CPA细胞符合束状带细胞形态特征,但胞内分泌颗粒少,偶见皮质醇颗粒。而CPA细胞器较sub-CPA丰富,胞内有大量皮质醇颗粒,差异显著,进一步提示sub-CPA为肾上腺皮质肿瘤中的独立类型。
综上,本研究结果显示,不同分泌功能肾上腺皮质肿瘤细胞中ACTH-R的表达及肿瘤超微结构差异明显,ACTH-R检测和肿瘤细胞超微结构观察可用于区分不同分泌功能的肾上腺皮质肿瘤。
[1] Fridmanis D, Petrovska R, Kalnina I, et al. Identification of domains responsible for specific membrane transport and ligand specificity of the ACTH receptor (MC2R)[J]. Mol Cell Endocrinol, 2010, 321(2):175-183.
[2] Schubert B, Fassnacht M, Beuschlein F, et al. Angiotensin Ⅱ type 1 receptor and ACTH receptor expression in human adrenocortical neoplasms [J]. Clin Endocrinol (Oxf), 2001, 54(5):627-632.
[3] Latronico AC. Role of ACTH receptor in adrenocortical tumor formation [J]. Braz J Med Biol Res, 2000, 33(10):1249-1252.
[4] Pace V, Perentes E, Germann PG. Pheochromocytomas and ganglioneuromas in the aging rats: morphological and immunohistochemical characterization[J]. Toxicol Pathol, 2002, 30(4):492-500.
[5] Borncigaux N,Gaston V,Logié A,et al. High expression of cyclin E and G1 CDK and loss of function of p57KIP2 are involved in proliferation of malignant sporadic adrenocortical tumors[J].Clin Endocrinol Metab,2000,85(1):322-330.
[6] Lepique AP,Forti FL, Moraes MS,et al. Signal transduction in G0/G1-arrested mouse Y1 adrenocortical cells stimulated by ACTH and FGF2[J]. Endocr Res, 2000, 26(4):825-832.
[7] Bernini GP,Moretti A,Viacava P,et al. Apoptosis control and proliferation marker in human normal and neoplastic adrenocortical tissues[J].Br J Cancer,2002,86(10):1561-1565.
[8] Bassett MH,Mayhew B, Rehman K,et al. Expression profiles for steroidogenic enzymes in adrenocortical disease[J]. J Clin Endocrinol Metab, 2005, 90(9):5446-5455.
[9] Xie JH, Hollande F, Haynes JM,et al. Troubleshooting immunohistochemical labelling of proliferating cell nuclear antigen (PCNA) in cryocut tissue sections of mouse prostate[J].J Pharmacol Toxicol Methods, 2010, 61(2):98-101.
[10] Sung MT, Jiang Z, Montironi R,et al.Alpha-methylacyl-CoA racemase (P504S)/34betaE12/p63 triple cocktail stain in prostatic adenocarcinoma after hormonal therapy[J]. 2007, 38(2):332-341.
[11] Kämmerer U, Kapp M, Gassel AM, et al. A new rapid immunohistochemical staining technique using the EnVision antibody complex[J]. J Histochem Cytochem, 2001,49(5):623-630.
[12] Krishnamurthy S, Meric-Bernstam F, Lucci A, et al. A prospective study comparing touch imprint cytology, frozen section analysis, and rapid cytokeratin immunostain for intraoperative evaluation of axillary sentinel lymph nodes in breast cancer[J]. 2009, 115(7):1555-1562.
[13] Tauchmanovà L, Rossi R, Biondi B, et al. Patients with subclinical Cushing′s syndrome due to adrenal adenoma have increased cardiovascular risk [J]. J Clin Endocrinol Metab, 2002, 87(11):4872-4878.
[14] Nieman LK, Biller BM, Findling JW,et al.The diagnosis of Cushing’s syndrome: an Endocrine Society Clinical Practice Guideline[J]. 2008, 93(5):1526-1540.
[15] Barzon L, Sonino N, Fallo F, et al. Prevalence and natural history of adrenal incidentalomas[J]. Eur J Endocrinol, 2003, 149(4):273-285.
[16] Salmenkivi K,Heikkilä P,Haglund C,et al. Lack of histologically suspicious features, proliferative activity, and p53 expression suggests benign diagnosis in phaeochromocytomas[J]. Histopathology,2003,43(1):62-71.
[17] Barzon L, Fallo F, Sonino N, et al. Development of overt Cushing′s syndrome in patients with adrenal incidentaloma [J]. Eur J Endocrinol, 2002, 146(1):61-66.
[18] Lacroix A, Ndiaye N, Tremblay J, et al. Ectopic and abnormal hormone receptors in adrenal Cushing′s syndrome[J]. Endocr Rev, 2001, 22(1):75-110.
[19] Ivsic T, Komorowski RA, Sudakoff GS, et al.Adrenal cortical adenoma with adrenalin-type neurosecretory granules clinically mimicking a pheochromocytoma[J]. Arch Pathol Lab Med, 2002, 126(12):1530-1533.
[20] Carroll TB, Findling JW. The diagnosis of Cushing’s syndrome[J].Rev Endocr Metab Disord, 2010, 11(2):147-153.
[21] Hirano D, Okada Y, Ishida H, et al. Electron microscopic study to compare preclinical Cushing′s syndrome with overt Cushing’s syndrome[J]. Int J Urol, 2002, 9(4):193-199.
ApplicationofAdrenocorticotropicHormoneReceptorDeterminationandUltrastructuralObservationofTumorCellsintheSubtypingofAdrenocorticalNeoplasms
FAN Hua, LI Han-zhong, YAN Wei-gang, SHI Bing-bing
Department of Urology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
LI Han-zhong Tel:010-65296035,E-mail:lihzhpumch@163.com
ObjectiveTo explore the values of adrenocorticotropic hormone receptor (ACTH-R) determination and ultrastructural observation of tumor cells in the subtyping of adrenocortical neoplasms (ANs).MethodsThe expression of ACTH-R in 87 AN tissues were determined with Polymer immunohistochemical staining, with 10 normal adrenal tissues as the controls. The ultrastructure of the tumor cells was observed using electron microscopy.ResultsThe positive expression rate of ACTH-R was(80.1±8.2)%, (53.2±10.3)%, (63.2±10.1)%,(83.3±6.5)%, and(70.1±7.3)% in the sub-CPA group, CPA group, APA group, NFA group, and NC group, respectively. ACTH-R expression was significantly higher in NFA and sub-CPA groups than in NC group (P=0.001,P=0.000), APA group (P=0.000,P=0.000), and CPA group (P=0.000,P=0.000), and was also significantly different between NC group and APA group (P=0.039) and between APA group and CPA group (P=0.037). However, no significant difference was found between NFA group and sub-CPA group (P=0.325). As shown by the electron microscopy, ANs had some partially similar microscopic features, while different AN subtypes showed differences in the type and amount of secretory granules.ConclusionACTH-R determination and ultrastructural observation of tumor cells may be helpful for subtyping ANs.
adrenocortical neoplasm; sub-type; adrenocorticotropin-receptor; ultrastructure
ActaAcadMedSin,2011,33(6):679-684
李汉忠 电话:010-65296035,电子邮件:lihzhpumch@163.com
R446.8;R586.2
A
1000-503X(2011)06-0679-06
10.3881/j.issn.1000-503X.2011.06.019
中国医学科学院北京协和医院科研基金(2009321)Supported by the Research Fund of CAMS and PUMCH(2009321)
2011-11-02)
