初步建立中国人前列腺癌预测的数学模型
2011-12-01李秋洋李岩密何恩辉
李秋洋,唐 杰,李岩密,费 翔,张 艳,何恩辉
中国人民解放军总医院超声科,北京100853
·论著·
初步建立中国人前列腺癌预测的数学模型
李秋洋,唐 杰,李岩密,费 翔,张 艳,何恩辉
中国人民解放军总医院超声科,北京100853
目的建立中国人前列腺癌预测模型。方法对556例疑似前列腺癌患者行前列腺穿刺活检,收集建立模型的变量:患者年龄、前列腺体积、前列腺特异性抗原(PSA)、游离PSA(f-PSA)/总PSA(t-PSA)。将变量通过逐步回归建立回归方程,在此基础上建立穿刺活检阳性的危险评分数学模型,并通过受试者工作曲线下面积来评估该模型的预测价值。结果556例患者中,205例(36.87%)经前列腺穿刺活检证实为前列腺癌。单因素分析结果显示,患者的年龄、前列腺体积、血清PSA、f-PSA/t-PSA均为建立数学模型的影响因素。对受试者工作曲线的分析结果显示,所建模型的曲线下面积为0.8767,大于患者年龄、前列腺体积、PSA、f-PSA/t-PSA等单因素的0.6397、0.7255、0.7111、0.6973。结论初步建立具有较高预测价值的前列腺癌预测模型。
前列腺癌;数学模型;中国人;超声;前列腺特异性抗原
前列腺癌是老年男性常见的癌症之一,已严重危及人类健康。在欧美国家,前列腺癌发病率居第1位,死亡率居第2位,每年约有2.8万人死于该病,在男性癌症患者中仅次于肺癌、结肠癌,居第3位[1]。虽然中国是前列腺癌低发病率的国家,但随着人均寿命的提高、生活结构的改变和人们对前列腺癌重视程度的增加,前列腺癌的发病率和检出率也逐年上升[2]。目前临床上确诊前列腺癌的主要手段为直肠超声引导下前列腺穿刺活检,但该方法为有创检查,一些西方国家已经建立了前列腺癌预测模型,用以减少不必要的穿刺活检。本研究拟初步建立中国人前列腺癌预测模型,以期为临床医生进行前列腺穿刺活检提供理论依据。
对象和方法
对象2004年7月至2009年2月在中国人民解放军总医院就诊的经临床及实验室检查怀疑为前列腺癌的患者556例,平均年龄(70.9±9.1)岁(48~82岁),检查前均未接受过前列腺疾病治疗。符合以下穿刺指征之一者即行直肠超声引导系统穿刺活检术:(1)前列腺特异性抗原(prostate specific antigen,PSA)升高(>4 ng/ml);(2)直肠指检发现前列腺结节;(3)超声、磁共振成像等影像学检查提示前列腺占位性病变;(4)发现转移癌,怀疑原发灶在前列腺。
直肠超声引导下前列腺穿刺活检采用Acuson/TCR(德国西门子公司)或Sequoia 512(德国西门子公司)彩色多普勒超声诊断仪,端扫式(End-fire)变频探头,频率为5~10 MHz。穿刺前患者停用抗凝类药物,并在术前采用开塞露清洁灌肠和预防性口服抗菌素。患者常规左侧卧位,臀部靠近床边并朝向检查者。在探头置入直肠前,先行常规直肠指诊,确定有无结节,然后进行经直肠超声检查,计算前列腺体积,并在超声引导下进行6点系统前列腺穿刺,若声像图发现可疑病灶时,则在该区加穿刺2针。穿刺标本按部位分别装入盛有10%甲醛溶液的瓶内固定,送病理检查。由于前列腺6点穿刺活检可能会遗漏前列腺癌病灶,为了尽可能避免遗漏前列腺癌,所有患者均进行为期6个月的PSA检测及前列腺超声随访。
数据收集、模型建立及评估记录穿刺时患者的年龄、血清PSA水平、前列腺体积、游离前列腺特异性抗原(f-PSA)/总前列腺特异性抗原(t-PSA)。首先进行单因素分析,然后根据这些变量建立逐步Logistic回归方程,再根据得出的常数项及回归系数建立数学模型:expit (α + β1χ1+ β2χ2... βnχn),其中,α为常数项,β1,β2,…βn为回归系数, χ1,χ2,…χn为自变量[3]。采用受试者工作曲线(receiver operating characteristic,ROC)来评估该模型预测穿刺活检阳性率的价值,其曲线下面积(area under the curve,AUC)可综合反映该模型在预测前列腺癌时的敏感性和特异性,从而反映该模型的预测价值。计算模型各个截断点的灵敏度、特异度、阳性预测值、阴性预测值及其95%可信区间,将患者的临床参数带入模型后,所得数据即为危险评分。
统计学处理采用SPSS 13.0统计软件,数据以均数±标准差表示,组间参数资料均数比较采用独立样本t检验,率的比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
556例患者中,205例(36.87%)经前列腺穿刺活检确诊为前列腺癌。205例前列腺癌患者和351例非前列腺癌患者在年龄、前列腺体积、血清PSA水平和f-PSA/t-PSA方面差异有统计学意义(P均<0.001)(表1)。
多因素分析结果显示,年龄、前列腺体积、血清PSA水平、f-PSA/t-PSA和常数的回归系数(95%可信区间)分别为0.094(0.066,0.125)、-0.033(-0.048,0.020)、0.055(0.013,0.100)、-2.757(-5.421,-0.370)和-6.380(-8.663,-4.250)。
对ROC的分析结果显示,所建模型的AUC为0.8767,大于患者年龄、前列腺体积、PSA、f-PSA/t-PSA 等单因素的0.6397、0.7255、0.7111、0.6973。
将患者的临床参数带入模型后,所得危险评分在0~1间,取0.1、0.2、…0.9等截点计算各自的诊断灵敏度、特异度、阳性预测值及阴性预测值,结果显示,当患者的危险评分为0.45时,其进行穿刺活检为前列腺癌的可能性是76.5%,穿刺结果为阴性的可能性是84.7%,该模型此时的灵敏度为73.2%(漏诊率为26.8%),特异度86.9%(误诊率为13.1%)(表2)。
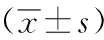
表 1 前列腺癌和非前列腺癌患者年龄、前列腺体积、PSA和f-PSA/t-PSA水平的比较
PSA:前列腺特异性抗原;f-PSA: 游离前列腺特异性抗原;t-PSA:总前列腺特异性抗原;与前列腺癌组比较,aP<0.001
PSA:prostate specific antigen; f-PSA: free PSA; t-PSA: total PSA;aP<0.001 compared with prostate carcinoma group
讨 论
早期发现前列腺癌,在可治疗阶段早期干预以降低死亡率是前列腺癌症筛查的主要目的。以往主要通过PSA筛查前列腺癌,但该方法可导致直肠出血、菌血症等并发症。近年研究显示,PSA筛查虽可增加疾病的检出率,但却未能降低死亡率,还可能带来过度诊断和治疗的问题[4]。2009年,PSA的发现者Ablin等[5]撰文质疑PSA筛查前列腺癌的预测效率,并指出其他前列腺疾病,如良性前列腺增生、慢性前列腺炎症也可升高血清PSA。因此,西方一些国家根据患者的临床信息及实验室检查资料建立了前列腺癌预测模型,以期提高穿刺检出率[6-7]。然而,由于中西方前列腺癌的发病率及生物学特征有所不同,因此国外的模型并不适宜直接应用于中国人,本研究的目的即在于根据中国人的数据建立适合中国人应用的模型。结果显示,556例接受前列腺穿刺活检的疑似前列腺癌患者中,205例(36.87%)经活检证实为前列腺癌。单因素分析结果显示,患者的年龄、前列腺体积、血清PSA、f-PSA/t-PSA均为建立数学模型的影响因素。对ROC的分析结果显示,所建模型的AUC为0.8767,大于患者年龄、前列腺体积、PSA、f-PSA/t-PSA等单因素的0.6397、0.7255、0.7111、0.6973,提示该模型具有较高的预测价值。将患者的临床参数带入模型后,当患者的危险评分为0.45时,其进行穿刺活检为前列腺癌的可能性是76.5%,穿刺结果为阴性的可能性是84.7%,该模型此时的灵敏度为73.2%(漏诊率为26.8%),特异度86.9%(误诊率为13.1%)。此时,医生应充分考虑患者的总体健康状况,将决策制订过程告知患者。
本研究的局限性在于,该模型的建立是基于本中心6针系统与结节穿刺活检相结合的结果。最近研究发现,随着穿刺针数的增加,检出率也相应增加[8-9]。

表 2 不同截点的灵敏度、特异度、PPV、NPV及其95%可信区间(%)
PPV:阳性预测值; NPV:阴性预测值
PPV:positive predictive value;NPV:negative predictive value
然而,由于临床上前列腺癌好发于老年患者,常同时罹患多种老年性疾病,如糖尿病、高血压、冠心病等,穿刺针数的增加可导致引发并发症的可能性增大,因此6针系统穿刺活检在国内一些中心仍在采用,故本模型仍有一定的参考价值与指导意义。
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin 2008, 58(2):71-96.
[2] 上海肿瘤研究所流行病研究室. 2006年上海市市区恶性肿瘤发病率[J]. 肿瘤, 2009, 29(9):918.
[3] Rochester MA, Pashayan N, Matthews F, et al. Development and validation of risk score for predicting positive repeat prostate biopsy in patients with a previous negative biopsy in a UK population[J]. BMC Urol, 2009, 9:7.
[4] Schröder FH, Hugosson J, Roobol MJ, et al. Screening and prostate-cancer mortality in a randomized European study[J]. N Engl J Med, 2009, 360(13):1320-1328.
[5] Ablin RJ, Haythorn MR. Screening for prostate cancer: Controversy? What controversy[J]. Curr Oncol, 2009, 16(3):1-2.
[6] Ohori M, Swindle P. Nomograms and instruments for the initial prostate evaluation: the ability to estimate the likelihood of identifying prostate cancer[J]. Semin Urol Oncol, 2002, 20(2):116-122.
[7] Djavan B, Remzi M, Zlotta A, et al. Novel artificial neural network for early detection of prostate cancer[J]. J Clin Oncol, 2002, 20(4):921-929.
[8] Presti JC Jr, O’Dowd GJ, Miller MC, et al. Extended peripheral zone biopsy schemes increase cancer detection rates and minimize variance in prostate specific antigen and age related cancer rates: results of a community multi-practice study[J]. J Urol, 2003, 169(1):125-129.
[9] Emiliozzi P, Scarpone P, DePaula F, et al. The incidence of prostate cancer in men with prostate specific antigen greater than 4.0 ng/ml: a randomized study of 6 versus 12 core transperineal prostate biopsy[J]. J Urol, 2004, 171(1):197-199.
DevelopmentofaNomogramforPredictingPositiveInitialProstateBiopsyAmongChinesePatients
LI Qiu-yang, TANG Jie, LI Yan-mi, FEI Xiang, ZHANG Yan, HE En-hui
Department of Ultrasound, General Hospital of Chinese PLA, Beijing 100853, China
TANG Jie Tel: 010-66939532, E-mail:txiner@vip.sina.com
ObjectiveTo develop a predictive nomogram for predicting the prostate carcinoma among Chinese population.MethodsTotally 556 Chinese male patients who had undergone an initial prostate biopsy in our hospital from July 2004 to February 2009 were enrolled in this study. Variables including age, volume, prostate specific antigen (PSA) level, and free PSA(f-PSA)/total PSA(t-PSA) were collected. Logistic regression analysis was performed to estimate the relative risk. Regression equation was established for variables via stepwise regression, via which a nomogram for assessing the positive biopsy results was established, and then the predictive value of this nomogram was evaluated using receiver area under curve (ROC) analysis.ResultsOf these 556 patients, cancer was detected in 205 patients (36.87%) via biopsies. Univariate analysis showed that age, prostate volume, PSA levels, and f-PSA/t-PSA were the influencing factors of the nomogram. The risk model performed well in an independent sample, with an AUCROCof 0.8767, which was significantly larger than that of the prediction based on age (AUCROC: 0.6397), prostate volume (AUCROC: 0.7255), PSA (AUCROC: 0.7111), or f-PSA/t-PSA (AUCROC: 0.6973) alone.ConclusionA preliminary nomogram with high predictive value for Chinese population was successfully established.
prostate carcinoma; nomogram;Chinese; ultrasound;prostate specific antigen
ActaAcadMedSin,2011,33(6):685-688
唐 杰 电话:010-66939532, 电子邮件: txiner@vip.sina.com
R445.1
A
1000-503X(2011)06-0685-04
10.3881/j.issn.1000-503X.2011.06.020
中国人民解放军总医院博士研究生创新项目(10BCZ02)和国家科技支撑计划项目(2009BAI86B05)Supported by the PLA General Hospital Excellent Ph.D. Students Innovation Foundation (10BCZ02) and the National Technology Support Program (2009BAI86B05)
2011-09-19)
