住院老年高血压患者的血糖改变及其对肾功能的影响
2011-11-28雷永富
雷永富 李 敏
临床上,不少老年高血压患者尿常规检查尿蛋白为阴性,而患者出现不同程度的肾功能损害,这类问题国内外文献报道不多。本文旨在探讨老年高血压住院患者中尿蛋白阴性患者的血糖改变及其对肾功能的影响。
1 对象与方法
1.1 研究对象 选择2008年1月—2010年11月在本院住院尿常规检测尿蛋白为阴性的老年原发性高血压患者575例,男291例,女284例,年龄65~92岁,平均(68.4±8.3)岁。
1.2 方法
1.2.1 收集资料 患者入院后均测动脉血压、身高、体质量、血肌酐、血脂,计算体质量指数(BMI)。入院次日测早7:00—9:00的尿常规、尿白蛋白及肌酐浓度,计算尿白蛋白/肌酐比值作为尿白蛋白排泄率(UAER);采用Cockroft-Gault公式计算肾小球滤过率(eGFR),进行口服葡萄糖耐量试验(OGTT)及胰岛素释放试验(IRT),糖尿病患者测定谷氨酸脱羧酶抗体(GADAb)。尿白蛋白测定采用放射免疫法,血尿肌酐测定采用碱性苦味酸法在OLYMPUS AU400全自动生化分析仪完成。UAER≥3.5 g/mol为UAER异常,eGFR≤60 mL/(min·1.73 m2)为eGFR下降。先以血糖水平为分组标准分为正常血糖(NGR)、空腹血糖受损(IFG)+糖耐量减低(IGT)及2型糖尿病(T2DM)组,比较各组间eGFR下降患者的比例及不同水平UAER患者的eGFR值;再以eGFR是否≤60 mL/(min·1.73 m2)为标准分为eGFR下降组和eGFR未下降组,比较2组的年龄、性别构成、BMI、血压及血糖等指标。
1.2.2 诊断标准 (1)糖尿病及相关诊断:①血糖正常(NGR),空腹血糖(FBG)<5.6 mmol/L,OGTT 2 h血糖(2 hBG)<7.8 mmol/L。②空腹血糖受损(IFG),FBG为5.6~6.9 mmol/L[1],2 hBG<7.8 mmol/L。③糖耐量减低(IGT),FBG<7.0 mmol/L,2 hBG 7.8~11.1 mmol/L。④2型糖尿病(T2DM),FBG≥7.0 mmol/L,2 hBG≥11.1 mmol/L。(2)高血压的诊断依据:①按IHS及WHO标准诊断。②原有高血压的患者虽然目前血压正常但仍在降压药物维持治疗中。
1.2.3 排除标准 1型糖尿病、甲状腺功能亢进、重度贫血、痛风、发热、尿路感染、尿常规检测尿蛋白(+)、尿肌酐浓度≤880 μmol/L、妊娠及哺乳者。
1.3 统计学分析 应用SPSS 11.0统计学软件进行分析,计量资料数据以均数±标准差(±s)表示,组间比较采用t或F检验,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同血糖水平患者eGFR的变化 血糖水平不同患者中,血糖较高者eGFR下降者较多,其中T2DM组最多,NGR组最少,差异有统计学意义(P<0.01)。同组患者UAER≥3.5 g/mol者的eGFR值较UAER<3.5 g/mol者降低,差异有统计学意义;UAER≥3.5 g/mol的患者中,随血糖水平的升高,其eGFR降低,差异有统计学意义(F=5.43,P<0.01)。UAER<3.5 g/mol的患者中,不同血糖组间eGFR水平差异无统计学意义(F=2.87,P>0.05),但3组eGFR值均高于正常水平,见表1。
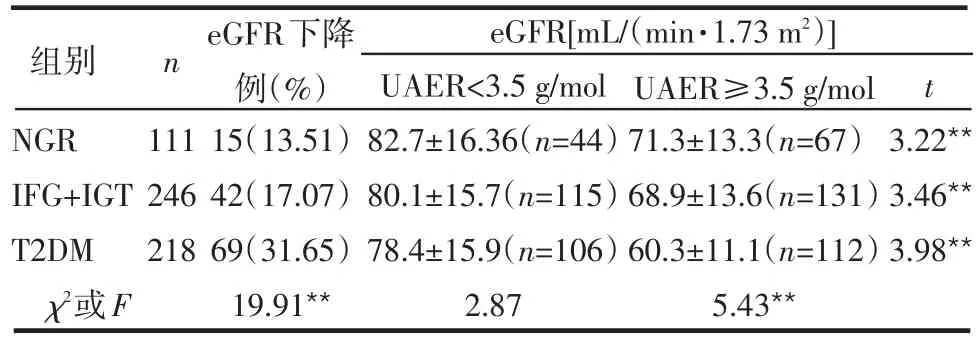
表1 不同血糖水平患者eGFR的改变
2.2 不同肾功能状态患者性别构成、年龄、BMI及血压的比较 eGFR下降组较未下降组患者的年龄更高,女性更多,收缩压(SBP)及舒张压(DBP)均明显升高,差异有统计学意义(均P<0.01);但2组间BMI的差异无统计学意义,见表2。
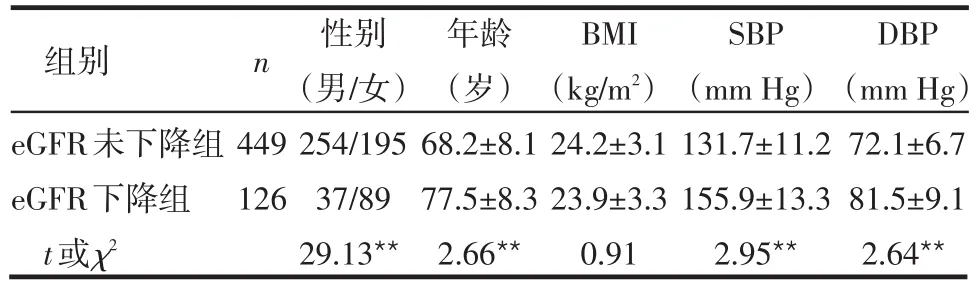
表2 不同肾功能状态患者性别、年龄、BMI及血压比较
3 讨论
糖调节受损(IGR)与糖尿病大血管并发症的关系已确立,但与糖尿病微血管并发症之间的关系尚不明确[2]。IGT患者存在与糖尿病患者相同的肾脏病变[3]。尿微量白蛋白增多不仅代表了广泛的血管内皮细胞功能紊乱,而且提示糖尿病肾病Ⅲ期肾小球毛细血管基底膜受损,高血压靶器官损害;心血管疾病的发病率及病死率增加[4]。所以,本研究选择UAER作为肾脏损伤的指标,表现为UAER异常及eGFR下降的比例高。可能的原因是:(1)糖代谢异常的比例高。这是由于老年及高血压患者均为糖尿病的高发人群,而且本文采用了美国糖尿病协会的IFG诊断标准,低于中国糖尿病防治指南规定的IFG诊断标准。(2)糖代谢的不同阶段均可造成肾脏损害,即使在IFG阶段也可发生肾小球及肾小管的损害。有证据表明,IGR组的尿转铁蛋白(TRF)、视黄醇结合蛋白(RBP)和UAER水平高于NGR组,IGT组4种尿蛋白(包括N-乙酰B-D-氨基葡萄糖苷酶)均较NGR组升高,提示在糖尿病前期已存在肾脏早期病变:肾小球、肾小管功能均有受累,并以IGT组肾损害更加明显[5]。本研究中UAER异常的患者随血糖水平升高其GFR逐渐减低,相同糖代谢状态患者中,UAER异常者其eGFR明显低于UAER正常者,说明在肾脏结构性病变的基础上糖代谢异常可加重eGFR损害。(3)长期持续的高血压可增加血管内皮的负荷、内皮微小损伤及肾小球囊内压,最终使内皮的屏障功能受损,UAER异常。(4)增龄性肾功能减退。除了增龄性肾功能减退之外,可能是因为肾小球滤过膜功能受损,蛋白质滤出增加,而近曲小管上皮细胞重吸收增加,故尿蛋白排泄未增加。因此,老年高血压患者尤其是伴T2DM者,肾损害发生率高,可表现为UAER异常,或eGFR显著下降,也可两者并存。不一定出现蛋白尿,而直接出现肾功能损害。因为糖代谢异常可能通过多种复杂机制导致肾损害:(1)糖尿病早期即存在肾小球内血流动力学异常,表现为高滤过、高灌注和肾小球毛细血管内高压。机械压力可直接通过诱导细胞外基质,组织金属蛋白酶抑制物-l基因表达,抑制膜型一基质金属蛋白酶-2 mRNA表达,使基质合成增加,降解减少,导致基质堆积,诱导肾小球硬化的发生[6]。(2)长期高糖环境使Ⅳ型胶原发生非酶糖基化,改变其生理特性,Ⅳ型胶原的糖基化使系膜细胞的功能变化,打破系膜基质合成与降解之间的平衡,导致糖尿病肾脏病特征性的病理变化—系膜扩张[7]。
[1]American diabetes association.Diagnosis and classif i cation of diabetes mellitus[J].Diabetes Care,2007,30(Suppl 1):S42-47.
[2]Fox CS,Larson MG,Leip EP,et al.Glycemic status and development of kidney disease:the Framingham Heart Study[J].Diabetes Care,2005,28(10):2436-2440.
[3]Gabir MM,Hanson RL,Dabelea D,et al.Plasma glucose and prediction of microvascular disease and mortality:evaluation of 1997 American Diabetes Association and 1999 World Health Organization criteria for diagnosis of diabetes[J].Diabetes Care,2000,23(8):1113-1118.
[4]罗敏.微量蛋白尿与代谢综合征[M].王吉耀.内科学下册.北京:人民卫生出版社,2005:1015-1016.
[5]李路,徐丹,吴炎,等.老年糖尿病前期患者早期肾功能的变化[J].中国老年学杂志,2007,27(7):651-652.
[6]Yaauda T,Kondo S,Homma T,et al.Regulation of extracellular matrix by mechanical stress in rat glomerular mesangial cells[J].J Clin Invest,1996,98(9):1991-2000.
[7]Andersun SS,Wu K,Nagase H,et al.Effect of matrix glycation on expression of typeⅣcollagen,MMP-2,MMP-9 and TIMP-1 by human mesungial cell[J].Cell Adhes Commun,1996,4(2):89-101.
