特发性高嗜酸细胞综合征一例报告
2011-11-28李世彬冯淑芝
李世彬 冯淑芝 张 蕴 曹 丽
1 病例报告
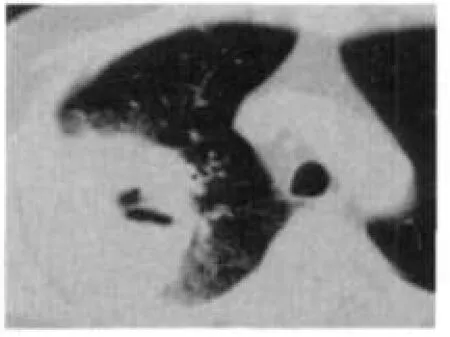
图1 2010年10月23日胸CT
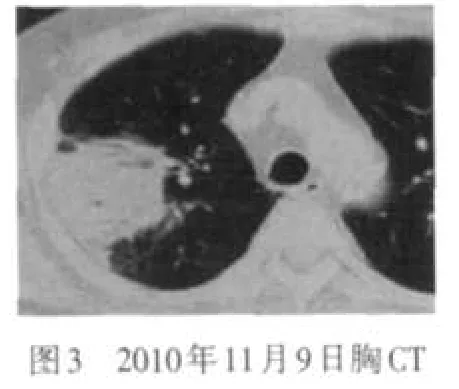
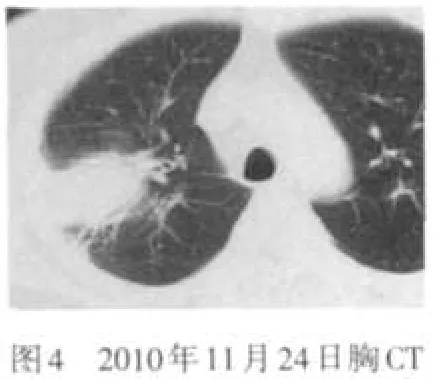
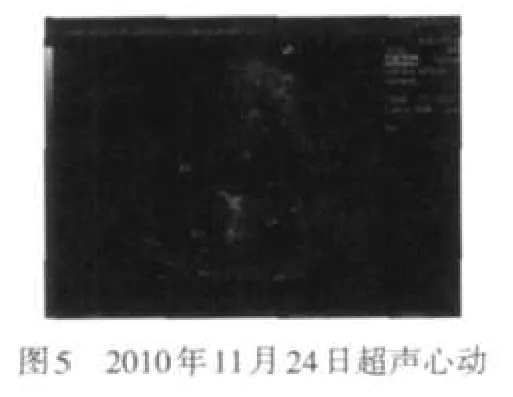
患者 男,61岁。主因发现嗜酸细胞(eosinophil,EOS)增高10个月,间断发热1个月,于2010年11月2日入院。患者于入院前10个月因“痛风”发作查血常规示白细胞及嗜酸细胞增高,间断复查EOS 0.273~0.521。逐渐出现胸闷气短乏力双下肢水肿、脾肿大、蛋白尿、血红蛋白及血小板减低,此后发现心尖部附壁血栓,于外院经相关检查除外寄生虫感染、风湿免疫系统疾病、超敏反应等,诊断为特发性高嗜酸细胞综合征(idiopathic hypereosinophilic syndrome,IHES),口服阿赛松(曲安西龙片)治疗后,EOS可降至正常,腹水、心包积液消失,心尖部血栓缩小,肝损害及脾大减轻。1个月前因受凉出现高热,体温达39.7℃,无咳嗽咳痰,胸CT示右肺上叶实变伴空洞形成,见图1,于外院予青霉素类抗感染治疗17 d,复查CT无明显好转,停药3 d后再次发热,遂收入我院。既往过敏性鼻炎、冠心病、高血压病、痛风病史。入院查体:体温38.5℃,神清语利,皮肤黏膜无黄染及皮疹,双肺无明显干湿性啰音,心率127次/min,律齐,无杂音,腹软,脾肋下2 cm,质中,无压痛,神经系统检查阴性。入院后查血常规示血红蛋白102 g/L,EOS计数0.45×109/L;尿便常规、凝血及肝肾功能基本正常;免疫球蛋白A 6.23 g/L,血沉55 mm/1h,C-反应蛋白50.50 mg/L,抗核抗体阴性,G试验阴性;超声心动示左房大,左室心尖部附壁血栓3.7 cm×1.7 cm×1.3 cm,二、三尖瓣轻度反流,见图2;腹部B超示肝脏多发实性结节,脾大12.8 cm×4.7 cm;骨穿示骨髓增生极度活跃,EOS多见(0.323 2),片状分布,形态偏成熟,散在偏成熟阶段中性粒细胞及中晚幼红细胞,巨核细胞正常,未见原始细胞、淋巴细胞增多;FIP1L1/PDGFRα融合基因检测阴性;气管镜示支气管炎症,支气管灌洗液无菌落发育,真菌阴性,抗酸染色阴性,病理示(右上叶后段、右上、尖后段间嵴)肺泡间质纤维组织增生致间隔增宽,肺泡上皮轻度增生,肺泡腔内充满粉染物质,考虑为肺泡蛋白沉着症;胸CT右上叶大片实变,并空洞形成,右下叶背段斑片影,考虑感染性病变,见图3。予口服阿赛松联合抗感染抗真菌保护靶器官对症治疗后,患者肺内实变影缩小,见图4,心尖部血栓稍减小,见图5,但于2010年12月8日突发全血细胞减少,血红蛋白58 g/L,白细胞0.31×109/L,血小板11×109/L;总胆红素75.5 μmol/L、直接胆红素43.3 μmol/L,白蛋白24 g/L;尿素29.9 mmol/L、肌酐153.0 μmol/L、尿蛋白++;脑利钠肽前体>9 000 ng/L、肌钙蛋白T 0.18 μg/L;心尖部血栓增大4.0 cm×3.0 cm×2.1 cm,全心扩大,肺动脉高压,二尖瓣、三尖瓣、主动脉瓣、肺动脉瓣轻度反流;复查骨穿示骨髓中EOS比例增高(0.067 5),外周血EOS比例正常,FIP1L1/PDGFRα融合基因检测阳性;体温38℃~40℃,肝区出现叩击痛,整体状况恶化。加大甲基泼尼松龙用量至80 mg/d,予丙种球蛋白及白蛋白静脉滴注出现过敏症状,并伴有一过性抽搐、记忆力丧失、谵语等神经系统症状,补充造血刺激因子无效,于2010年12月13日死亡。

2 讨论
IHES是一种罕见的以EOS增高、伴有靶器官损害为特征,合并与EOS增高相关的血管炎、骨髓增殖异常等的一类病征,临床表现各异。本例患者院外EOS持续增高病程达10个月,经多方检查缺乏明确的引起EOS增多的原因,并有左室心尖部附壁血栓、脾大肝损、神经系统症状,符合IHES的诊断标准。
IHES的治疗首选肾上腺皮质激素,有血管神经水肿、荨麻疹、血清IgE水平增高的超敏型患者,泼尼松治疗效果显著,预后良好;单纯泼尼松治疗效果不好或伴有心脏、周围神经、皮肤等靶器官损害的患者,可加用或改用细胞毒药物羟基脲或环磷酰胺,疗程可根据外周血细胞数加以调整。效果仍不明显者,可选用干扰素α,50周为1个疗程[1],或用环孢素A。嗜酸细胞计数较高者,可行白细胞或血浆置换,或选用长春新碱及烷化剂。2008年修订的WHO慢性髓细胞系肿瘤分类中,将IHES归于慢性骨髓增殖性疾病,并且强调了其肿瘤性质。有关IHES发病分子机制的研究显示,50%以上的IHES存在FIP1L1/PDGFRα融合基因,该基因是4号染色体q12中间缺失即del(4)(Q12Q12)形成的新的融合基因[2]。针对这一作用靶点,应用治疗慢性粒细胞白血病的特异性酪氨酸激酶抑制剂甲磺酸伊马替尼治疗IHES,可取得较好疗效。最近有研究对于FIP1L1/PDGFRα融合基因检测阴性患者予伊马替尼治疗效果仍较好,因例数少,需要积累更多的病例进行观察[3]。本例患者院外融合基因检测阴性,单予口服阿赛松1 mg/(kg·d)治疗1个月后,EOS可恢复正常,心脏血栓缩小,肝脾肾损害好转,遂将激素减量,此时合并肺部感染,予强有力抗生素抗真菌药物治疗的同时加大激素用量,肺部病变好转,但血液、心脏、肝肾等靶器官进行性恶化,并出现谵语等神经系统症状,不除外与心脏栓子脱落、弥漫性脑病有关,患者此时复查融合基因检测阳性,全血细胞减低造血系统衰竭,最终死亡。因此提高对EOS增多累及心脏临床表现的认识,有助于早期发现和给予积极的治疗,从而可能会改善患者的预后[4]。
[1]Yoon TY,Ahn GB,Chang SH.Complete remission of hypereosinophilic syndrome after interferon-alpha therapy:report of a case and literature review[J].Dermatol,2000,27(2):110-115.
[2]Metzgeroth G.Safety and efficacy of imatinib in chronic eosinophilic leukaemia and hypereosinophlic syndrome,a phase-II study[J].Br J Haematol,2008,143(5):707-715.
[3]刘红.特发性嗜酸粒细胞增多综合征多器官损害与预后的关系[J].西部医学,2010,22(7):1279-1280.
[4]田庄,方全,赵大春,等.嗜酸性粒细胞增多症患者心脏受累的临床和病理表现[J].中华内科杂志,2010,49(8):684-687.
