香豆素类Schiff 碱的合成*
2011-11-26尤学艳
尤学艳, 周 翼, 姚 成
(南京工业大学 理学院,江苏 南京 210009)
香豆素是广泛存在于自然界的一种内酯类化合物,由于其具有抗肿瘤、降血压、抗菌等活性以及优良的光学特性,被广泛应用于各个领域[1,2]。Schiff碱配体与金属离子形成的配合物表现出更强的生物活性,在抗肿瘤、抗病毒、抑菌杀菌等方面具有独特的药理活性[3]。Schiff碱易与大部分金属离子形成配合物,在配位化学中占重要地位。
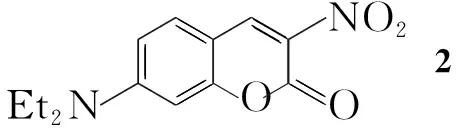
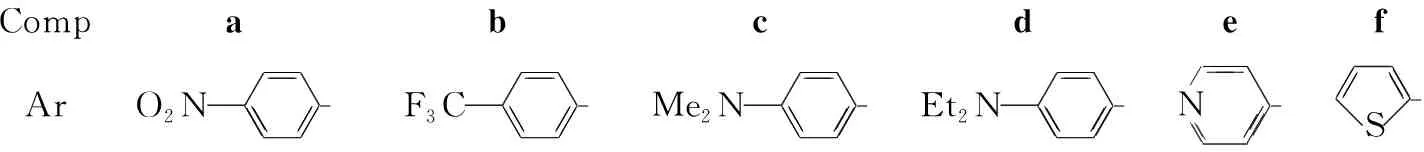
本文以乙酸和哌啶为催化剂,在正丁醇中通过4-(N,N-二乙氨基)水杨醛与硝基乙酸乙酯的缩合反应合成了3-硝基-7-(N,N-二乙基)香豆素(2);2经SnCl2/HCl还原制得3-氨基-7-(N,N-二乙基)香豆素(3);3与芳香醛(4a~4f)反应合成了六个新的香豆素类Schiff碱(1a~1f, Scheme 1),其结构经UV,1H NMR和MS表征。
1 实验部分
1.1 仪器与试剂
ZF-I型三用紫外分析仪(UV); Lanbda 35型紫外光谱仪(UV); Bruker AvaceⅢ 500 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);SS 33-5975B VL SMD型质谱仪。
4-(N,N-二乙氧基)水杨醛,纯度 99%,硝基乙酸乙酯,纯度97%,太原RHF责任有限公司;其余所用试剂均为分析纯。

Scheme1
1.2 合成
(1) 3的合成[4,5]
在反应瓶中依次加入4-(N,N-二乙氨基)水杨醛7 g(36.2 mmol),硝基乙酸乙酯5.3 g(40.0 mmol),正丁醇100 mL,催化剂哌啶0.2 mL和冰乙酸0.3 mL,搅拌使其溶解,于100 ℃回流反应12 h。充分冷却后过滤,滤饼用正丁醇洗涤三次,DMF重结晶得橙黄色固体2, m.p.199.7 ℃~199.9 ℃;1H NMRδ: 8.70(s, 1H, ArH), 7.44~7.43(d,J=5.0 Hz, 1H, ArH) , 6.72(dd,J=5.0 Hz, 2.5 Hz, 1H, ArH), 6.48(s, 1H, ArH), 3.50(q,J=10.0 Hz, 5.0 Hz, 4H, CH2), 1.28(t,J=5.0 Hz, 6H, CH3)。
在反应瓶中加入二水合氯化亚锡24.5 g(108.6 mmol)和15%盐酸120 mL,搅拌使其完全溶解,缓慢滴加用少量乙醇溶解的2,滴毕,于室温反应6 h(体系呈透明黄色)。用20%NaOH溶液调至碱性,有大量氢氧化锡固体析出,过滤,滤液用二氯甲烷(3×30 mL)萃取,滤饼用二氯甲烷(5×30 mL)洗涤,合并萃取液和洗涤液,用无水硫酸钠干燥,浓缩得黄色固体3, 收率76%, m.p.89.7 ℃~89.9 ℃;1H NMR(CDCl3)δ: 7.14(s, 1H, ArH ), 6.70(d,J=5.0 Hz, 1H, ArH), 6.57(s, 2H, ArH), 3.90(s, 2H, NH2), 3.39(q,J=10.0 Hz, 5.0 Hz, 4H, CH2), 1.21(t,J=5.0 Hz, 6H, CH3)。
(2)1的合成(以1a为例)[6,7]
在圆底烧瓶中加入4-硝基苯甲醛(4a) 1.6 g(4.3 mmol), 3 1.0 g(4.3 mmol)和乙醇20 mL,搅拌下回流反应4 h。自然冷却至室温,析出固体,过滤,滤饼用混合溶剂[V(乙酸乙酯) ∶V(乙醇)=5 ∶1]重结晶得1a。
用类似的方法合成1b~1f。
1a: 棕色晶体,产率67%, m.p.233 ℃~236 ℃; UVλmax: 450, 280 nm;1H NMRδ: 9.38(s, 1H, N=CH), 8.36~8.34(d,J=6.0 Hz, 2H, ArH), 8.16~8.13(d,J=9.0 Hz, 2H, ArH), 8.01(s, 1H, ArH), 7.56~7.53(d,J=9.0 Hz, 1H, ArH), 6.79(s, 1H, ArH), 6.60(s, 1H, ArH), 3.38(q, 4H, CH2), 1.14(t, 6H, CH3); FAB-MSm/z: 365(M+)。
1b: 黄色晶体,产率87%, m.p.161.0 ℃~161.1 ℃; UVλmax: 442, 262 nm;1H NMRδ: 9.31(s, 1H, N=CH), 8.10~8.08(d,J=6.0 Hz, 2H, ArH), 7.94(s, 1H, ArH), 7.87~7.84(d,J=9.0 Hz, 2H, ArH), 7.53~7.50(d,J=9.0 Hz, 1H, ArH), 6.77~6.74(s, 1H, ArH), 6.59(s, 1H, ArH), 3.34(q, 4H, CH2), 1.13(t, 6H, CH3); FAB-MSm/z: 389{[M+1]+}。
1c: 黄色晶体,产率73%, m.p.176 ℃~178 ℃; UVλmax: 432, 254 nm;1H NMRδ: 8.82(s, 1H, N=CH), 7.71~7.68(d,J=9.0 Hz, 2H, ArH), 7.63(s, 1H, ArH), 7.45~7.42(d,J=9.0 Hz, 1H, ArH), 6.79~6.76(d,J=9.0 Hz, 2H, ArH), 6.73~6.70(d,J=9.0 Hz, 1H, ArH), 6.55(s, 1H, ArH), 3.34(q, 4H, CH2), 3.01(s , 6H, CH3), 1.13(t, 6H, CH3); FAB-MSm/z: 364{[M+1]+}。
1d: 黄色晶体,产率69%, m.p.203 ℃~206 ℃; UVλmax: 430, 274 nm;1H NMRδ: 8.78(s, 1H, N=CH), 7.68~7.65(d,J=9.0 Hz, 2H, ArH), 7.60(s, 1H, ArH), 7.45~7.42(d,J=9.0 Hz, 1H, ArH), 6.75~6.69(d,J=9.0 Hz, 9.0 Hz, 3H, ArH), 6.55(s, 1H, ArH), 3.34(q, 8H, CH2), 1.13(t, 6H, CH3); FAB-MSm/z: 414{[M+Na]+}。
1e: 黄色晶体,产率85%, m.p.187 ℃~189 ℃; UVλmax: 381, 260 nm;1H NMRδ: 9.29(s, 1H, N=CH), 8.72~8.71(d,J=5.0 Hz, 2H, ArH), 8.00(s, 1H, ArH), 7.81~7.80(d,J=5.0 Hz, 2H, ArH), 7.54~7.53(d,J=5.0 Hz, 1H, ArH), 6.78~6.77(d,J=5.0 Hz, 1H, ArH), 6.60(s, 1H, ArH), 3.34(q, 8H, CH2), 1.13(t, 6H, CH3); FAB-MSm/z: 349{[M-N2]+}。
1f: 黄色晶体,产率80%, m.p.160 ℃~164 ℃; UVλmax: 380, 268 nm;1H NMRδ: 9.37(s, 1H, N=CH), 8.72~8.71( d,J=5.0 Hz, 2H, ArH), 7.83(s, 1H, ArH), 7.49~7.47(d,J=10.0 Hz, 2H, ArH), 7.22~7.20( t,J=5.0 Hz, 5.0 Hz, 1H, ArH), 6.75~6.73(d,J=10.0 Hz, 1H, ArH), 6.57(s, 1H, ArH), 3.40(q, 4H, CH2), 1.13(t, 6H, CH3); FAB-MSm/z: 322{[M-4]+}。
2 结果与讨论
1的1H NMR分析表明,在9.37~8.78的单峰为碳氮双键的特征化学位移,说明1在DMSO-d6介质中以亚胺的形式存在,证明Schiff碱生成。1a和1b由于苯环上分别连有强吸电子的硝基和三氟甲基,苯环上电子云密度降低,屏蔽效应减弱,使质子峰向低场位移。1c和1d分别含有供电子二甲氨基和二乙胺基,其孤对电子与苯环形成p→π共轭体系,供电子效应占优势,使苯环上电子云密度增加,屏蔽效应加强,质子共振磁场升高,化学位移降低。1e和1f分别是氮杂环的吡啶和硫杂环的噻吩,吡啶的电子效应相当于苯环上连有硝基,所以屏蔽效应减弱,使质子的化学位移移向低场。噻吩由于硫的电负性较大,导致去屏蔽效应加强,所以化学位移增大。
由1的UV分析可见,在260 nm~280 nm出现苯环共轭吸收带,在380 nm~450 nm出现的吸收带为具有共轭的Schiff碱C=N的π→π*电子跃迁产生的,由此证明新Schiff碱生成。1a由于含有生色基团硝基使吸收波长向长波方向移动最大,含有三氟甲基这个强吸电子基团的1b次之,1c和1d由于本身含有助色基团,向长波方向移动较小。1e和1f分别是连有氮杂环的吡啶和硫杂环的噻吩,它们相当于在苯环上连有生色基团,所以产生红移。
综上所述,1的结构与Scheme 1预期吻合。
由1的产率可见,含有吸电子基团化合物产率比含有供电子的化合物产率高。由于4a苯环上连有硝基强吸电子基团形成共轭体系,使醛基活性降低,不利于反应进行,故1a产率稍低。4e连有吡啶杂环,与硝基苯相似,所以。1e产率略低。4c和4d苯环上连有供电子基团,1c和1d产率与1a相当。实验发现,随着时间的增加,产率增加,但反应超过4 h后产率变化不大,所以反应时间选择4 h为宜。
[1] 孔令义. 香豆素化学[M].北京:化学工业出版社,2008.
[2] 姚念环,孔令义. 紫花前胡化学成分的研究[J].药学学报,2001,36(5):350-355.
[3] 于赛男,李志超. 含三氟甲基和双希夫碱化合物的合成表征[J].合成化学,2010,18(2):226-228.
[4] Ray Debdas, Bharadwaj P K. A coumarin-derived fluorescence probe selective for magnesium[J].Inorg Chem,2008,47(7):2252-2254.
[5] Gagey N, Emond M, Neveu P,etal. Alcohol uncaging with fluorescence reporting: evaluation ofo-acetoxyphenyl methyloxazolone precursors[J].Org Lett,2008,10(12):2341-2344.
[6] Na Li, YU Xiang, Aijun Tong. Highly sensitive and selective “turn-on” fluorescent chemodosimeter for Cu2+in water via Cu2+-promoted hydrolysis of lactone moiety in coumarin[J].Chemical Communications,2010,46:3363-3365.
[7] Helmi Neuvonen, Kari Neuvonen, Ferenc Flp. Substituent cross-interaction effects on the electronic character of the CdN bridging group in substituted benzylidene anilines-models for molecular cores of mesogenic compounds.A13C NMR study and comparison with theoretical results[J].J Org Chem,2006,71(8):3141-3148.
