融合蛋白anti-HER2-ScFv-GFP在昆虫细胞中的表达及其靶向结合乳腺癌细胞的功能分析*
2011-11-20高国辉王金丹黄奇迪杨纪峰杨水兵包兵兵胡孝渠
高国辉, 王金丹, 黄奇迪, 杨纪峰, 杨水兵, 包兵兵, 张 羽, 胡孝渠△
(温州医学院1生命科学院,2附属第一医院肿瘤外科,3仁济学院,浙江 温州 325000)
·实验技术·
融合蛋白anti-HER2-ScFv-GFP在昆虫细胞中的表达及其靶向结合乳腺癌细胞的功能分析*
高国辉1, 王金丹1, 黄奇迪2, 杨纪峰1, 杨水兵1, 包兵兵3, 张 羽3, 胡孝渠2△
(温州医学院1生命科学院,2附属第一医院肿瘤外科,3仁济学院,浙江 温州 325000)
目的: 利用昆虫细胞-杆状病毒表达系统表达获得携带绿色荧光蛋白(GFP)的抗人表皮生长因子受体2(HER2)的单链抗体可变区片段(ScFv),分析其靶向结合乳腺癌细胞表面受体HER2的功能。方法构建融合基因anti-HER2-ScFv-GFP,重组获得真核表达载体重组子pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP,转化DH10Bac,收集重组病毒bacmid,分别转染、感染粉纹夜蛾细胞Tn-5B1-4,SDS-PAGE及Western blotting分析融合蛋白表达产物。Ni2+-NTA 亲和层析法纯化anti-HER2-ScFv-GFP融合蛋白后分别滴入乳腺癌细胞HER2阳性的SKBR3和HER2阴性的MCF7,对比携带绿色荧光的抗HER2单链抗体靶向结合乳腺癌细胞表面HER2受体情况。结果获得长度约1 539 bp的融合基因anti-HER2-ScFv-GFP,感染重组病毒的Tn-5B1-4细胞膜附近有明显绿色荧光,SDS-PAGE、Western blotting法检测到60 kD的特异性条带。 结合实验显示HER2阳性的SKBR3细胞表面有明显绿色荧光,而HER2阴性的MCF7细胞表面荧光易被洗脱。结论在Tn-5B1-4中成功表达携带绿色荧光的融合蛋白anti-HER2-ScFv-GFP,该携带绿色荧光的抗HER2单链抗体具有靶向结合乳腺癌细胞表面HER2受体的效能。
抗HER2单链抗体可变区片段; 绿色荧光蛋白; 融合基因表达
研究表明,人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)基因在多种肿瘤组织表达[1-3]。 HER2表达量越高,肿瘤的恶性程度越高,患者预后也越差[4,5]。因此,以HER2为靶标的生物靶向治疗是抗肿瘤治疗的新思路。
抗HER2单链抗体可变区片段(anti-HER2 single-chain variable fragment,anti-HER2-ScFv)是抗HER2免疫球蛋白Fab片段中的可变区部分,由一段重链和一段轻链组成,具有靶向结合HER2的特异性。如果其携带药物分子靶向结合HER2,将会阻断表皮生长因子对HER2 受体的激活,同时药物定点杀伤靶细胞,从而导致HER2 受体无法磷酸化而使HER2阳性肿瘤细胞停止增殖[6]。在大量的临床分子诊断或生物靶向治疗研究中[7,8],验证抗HER2单链抗体与HER2靶向结合时,一般使用间接免疫技术或者染色技术。由于这两种技术使用过程中影响因素多,在多种临床分子诊断和靶向生物治疗等实验结果中容易产生误差。因此,研究一种同时具有靶向性和明显报告作用的抗HER2单链抗体应用于临床分子诊断和抗肿瘤靶向治疗十分必要。
本研究利用绿色荧光蛋白(green fluorescent protein,GFP)能在活细胞中直接观察的特点,构建anti-HER2-ScFv-GFP融合基因,用昆虫细胞-杆状病毒表达系统表达抗HER2 ScFv-GFP融合蛋白,分离纯化含有绿色荧光的抗HER2单链抗体后,以HER2阳性的乳腺癌细胞SKBR3和HER2阴性的乳腺癌细胞MCF7为模型,将其与SKBR3、MCF7结合,观察靶向结合效率,以探讨融合了绿色荧光蛋白的抗HER2单链抗体是否会改变靶向结合HER2受体的功能。实验成功后,使原来不可见的抗HER2单链抗体封闭乳腺癌细胞表面HER2受体现象变得直观便捷,为进一步的临床分子诊断和生物靶向治疗等提供动态变化的证据。
材 料 和 方 法
1材料
1.1基因片段、载体、菌株与细胞株 鼠源性人抗HER2-ScFv片段由中山大学医学院宋尔卫教授课题组提供、GFP片段由浙江大学生命科学院吴敏教授惠赠、pFAST Bac-to-Bac HT A表达载体、大肠杆菌TG1、DH10Bac、粉纹夜蛾细胞Tn-5B1-4(Tn)为浙江大学昆虫病毒分子生物学实验室提供。 pGEM T easy vector购于Promega,乳腺癌细胞SKBR3、MCF7为本实验室保存。
1.2主要试剂 T4DNA连接酶、TaqDNA聚合酶、dNTP、中分子量蛋白marker、PVDF膜购于Promega,限制性内切酶EcoRI、HindIII、BamHI及其配套bueffr、dNTPs、DNA marker DL2000、DNA marker 4500均购自TaKaRa; 鼠抗His-Tag mAb、goat anti-mouse IgG-HRP、DAB为Abmary产品,DMEM高糖培养基和胎牛血清购自Gibco-BRL,昆虫细胞培养基NTM-FH insect medium为Sigma产品。 DNA Gel Purficatoin Kit 3.1为上海申能博彩生物科技有限公司产品;质粒抽提试剂盒购于Omega。
1.3PCR引物 根据anti-HER2-ScFv片段序列设计引物如下:上游引物5’-ccg gaattc atggcccag gtgcag-3’,引入酶切位点EcoR I,下游引物5’-ccat ggatcc atggtggtgg tgat-3’,引入酶切位点BamH I,其中抗HER2-ScFv片段的终止密码子TAA被删除掉。
根据GFP片段序列设计引物如下:上游引物5’-aac ggatcc atggtgagca agggcg-3’,其中引入酶切位点BamH I,下游引物5’-ccg aagctt ttacttgtacagc tcgtc-3’,其中引入酶切位点HindIII,M13通用引物如下:上游引物5’-gtttt cccag tcacga c-3’,下游引物5’-cagga aacag ctatg ac-3’,用于检测转座的发生和插入外源基因片段的大小。以上3对引物由上海捷瑞生物技术有限公司合成。
2方法
2.1融合基因anti-HER2-ScFv-GFP的获得 PCR法分别获得目的基因anti-HER2-ScFv和GFP。利用引物设计中的两端对应酶切位点EcoR I、BamH I双酶切基因片段anti-HER2-ScFv,产生同时具有EcoRI、BamH I黏性末端的片段,胶回收之;利用引物设计中的两端对应酶切位点HindIII、BamH I双酶切基因片段GFP,产生同时具有HindIII、BamH I黏性末端的片段,胶回收之,将两条同时具有BamH I黏性末端胶回收片段产物利用T4 DNA连接酶16 ℃直接连接BamH I黏性末端。以该连接产物为模板,以片段anti-HER2-ScFv的上游引物为融合基因的上游引物,以片段GFP的下游引物为融合基因的下游引物,PCR扩增获得融合基因,1%琼脂糖凝胶电泳鉴定之。将PCR产物克隆到pGEM T easy vector,转化TG1感受态细胞,氨苄青霉素抗性筛选,构建供体重组质粒pGEM T easy vector/anti-HER2-ScFv-GFP,PCR法和EcoR I、HindIII双酶切鉴定,并测序鉴定阳性质粒中融合基因序列,BLAST比对序列的正确性。
2.2真核表达载体重组子pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP的构建 用EcoR I、HindIII分别双酶切供体质粒pGEM T easy vector/anti-HER2-ScFv-GFP和真核表达载体pFAST Bac-to-Bac HT A;用T4 DNA连接酶将anti-HER2-ScFv-GFP与具有相同黏性末端的表达载体pFAST Bac-to-Bac HT A在4 ℃连接反应过夜,转化TG1感受态细胞,氨苄青霉素抗性筛选,双酶切鉴定重组子,并对重组子测序确认阅读框的正确性。
2.3重组bacmid的获得 将阳性重组质粒pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP转化含有辅助质粒的DH10Bac感受态细胞。37 ℃培养8 h后,转移载体质粒在辅助质粒提供的转座酶的作用下发生转座,并使DH10Bac获得庆大霉素抗性,通过涂布含IPTG、X-gal、卡那霉素、庆大霉素及四环素的LB平板上筛选白色菌落,挑入含有3种同样抗生素的液体LB培养基,37 ℃振荡培养过夜,碱法小量提取重组病毒DNA,用M13上、下游通用引物进行PCR扩增确定融合基因anti-HER2-ScFv-GFP转座是否成功。
2.4昆虫细胞Tn-5B1-4的培养、转染及重组病毒的感染 取鉴定好的重组bacmid基因组DNA,用Lipofectin转染细胞。详细步骤如下:(1)先在35 mm细胞培养皿中接种2×105Tn-5B1-4细胞,加入2 mL有血清培养基,轻轻摇动培养皿,使细胞均匀分散,27 ℃培养24 h。(2)取2支1.5 mL Eppendorf管配制下列溶液:溶液A:约1-2 μg重组杆状病毒DNA溶于100 μL无血清培养基中;溶液B:5 μL Lipofectin稀释于80 μL无血清培养基中;合并溶液A和溶液B轻轻混匀,室温静置15 min。(3)弃细胞培养液,并用无血清培养基洗3次,加0.8 mL无血清培养基至Lipofectin-DNA混合物中,轻轻混匀后,小心滴加到细胞表面,轻轻混匀。(4)27 ℃培养8 h后,弃转染液,加有血清培养基2 mL继续培养。(5)感染5 d后收集有明显病毒感染症状的细胞上清,再感染Tn-5BI-4细胞3轮进行病毒扩增。荧光显微镜下观察被感染的粉纹夜蛾细胞Tn-5B1-4(Tn)的变化。
2.5SDS-PAGE与Western blotting分析 取重组病毒感染5 d后的Tn-5B1-4细胞和阴性对照经bacmid感染的Tn-5B1-4细胞,超声破碎,经3 000 r/min离心2 min,弃上清,1×PBS缓冲液洗涤3次。每1.5 mL感染细胞悬浮液加50 μL PBS,再加50 μL 2×SDS上样缓冲液,进行12% SDS-PAGE电泳检测。含有表达产物细胞破碎上清液经SDS-PAGE电泳后,电转移至PVDF膜,以5 g/L脱脂奶粉室温封闭1 h,依次加入鼠抗6×His-Tag mAb(1∶1 000稀释,4 ℃孵育过夜)为 Ⅰ 抗,HRP标记的山羊抗小鼠IgG(1∶5 000稀释,室温2 h)为 Ⅱ 抗,用化学发光试剂盒于暗室条件下感光显影。
2.6融合蛋白anti-HER2-ScFv-GFP的分离纯化与浓度测定 取20 mL含有表达产物的经过第3轮感染的Tn-5B1-4细胞培养液离心后收集细胞,用100 mmol/L Tris·HC1(pH 8.0)重悬,冰浴中温和超声6次(每次2 min,间隔10 s)破碎,4 ℃,10 000×g离心5 min,收集上清,用Ni2+-NTA亲合层析柱室温结合1 h,用洗涤缓冲液(100 mmol/L Tris·HC1,20 mmol/L咪唑,pH 8.0)洗涤5 次后,分别用含100、200、500 mmol/L的咪唑洗脱缓冲液洗脱,过0.22 μm滤膜过滤待用。考马斯亮蓝法测定收集的融合蛋白浓度,以牛血清白蛋白(BSA)为标准品,计算出未知样品的蛋白质浓度(g/L)。
2.7融合蛋白封闭HER2阳性细胞株SKBR3与HER2阴性细胞株MCF7功能的对比分析 胰酶消化铺满的乳腺癌细胞SKBR3和MCF7,重悬于无胎牛血清的RPMI-1640培养液,分别滴入不同稀释度的anti-HER2-ScFv-GFP融合蛋白样品(1∶5,1∶20,1∶40),37 ℃、50 mL/L CO2培养箱中培养2 h,使anti-HER2-ScFv与乳腺癌细胞SKBR3、MCF7细胞表面受体充分接触,调整细胞密度为5×108/L,以1 mL/well加入6孔细胞培养板,每孔1 mL,添加胎牛血清含100 mL/L,37 ℃、50 mL/L CO2培养箱中培养24 h,PBS洗3次。激光共聚焦显微镜观察单链抗体与SKBR3、MCF7细胞表面受体结合情况。用GFP蛋白标准品对应浓度溶液滴定SKBR3作为阴性对照。
结 果
1融合基因anti-HER2-ScFv-GFP的获得
1%琼脂糖凝胶电泳鉴定表明anti-HER2-ScFv在816 bp左右、GFP在720 bp左右,见图1B,2条片段产物用T4 DNA连接酶直接连接的产物经PCR扩增在1 539 bp左右有明显条带,见图1C,将之克隆到pGEM T easy vector,EcoR I、HindIII双酶切鉴定结果在1 539 bp左右有明显条带,单酶切结果在4 500 bp左右,见图1D,与预计相符合。 对阳性质粒pGEM T easy vector/anti-HER2-ScFv-GFP测序,表明整个融合基因为1 539 bp,BLAST分析重组子中的融合基因序列与理论序列同源性为100%,因此融合基因成功构建,供体质粒pGEM T easy vector/anti-HER2-ScFv-GFP的构建成功。

Figure 1.Construction of the fusion gene anti-HER2-ScFv-GFP.The anti-HER2-ScFv DNA sequence and GFP DNA sequence were produced by PCR.The two aim gene DNA sequence were digested by restriction enzyme and ligated by the T4 DNA ligase directly.The PCR product was amplified from the ligated product.And the PCR product was cloned into pGEM T easy vector.A:schematic diagram of anti-HER2-ScFv generated by fusing GFP gene in frame with the 5’ end of the fusion genes; B: M: marker;1:the product of aim gene anti-HER2-ScFv; 2: the product of aim gene GFP ;C: M:marker;1: the PCR product amplified from the ligation product of fusion gene anti-HER2-ScFv-GFP; D: M:marker;1:the double digestion product of pGEM T easy vector/anti-HER2-ScFv-GFP;2:the single digestion product of pGEM T easy vector/anti-HER2-ScFv-GFP.
2真核表达载体重组子pFASTBac-to-BacHTA/anti-HER2-ScFv-GFP的构建与重组病毒bacmid的获得
EcoR I、HindIII双酶切鉴定重组子pFAST Bac-to-Bac HT A /anti-HER2-ScFv-GFP,1%琼脂糖凝胶电泳可见在1 539 bp有明显条带,见图2A,经测序结果完全正确,阳性重组质粒pFAST Bac-to-Bac I /anti-HER2-ScFv-GFP转化DH10Bac感受态细胞后,以M13通用引物PCR鉴定白色菌落,结果在3 800 bp左右有明显条带,见图2B,与预计相符合,证明融合基因anti-HER2-ScFv-GFP完全转座到重组病毒bacmid上。
3融合基因anti-HER2-ScFv-GFP在Tn-5B1-4中的表达与鉴定分析
重组bacmid在Lipofectin介导下转染Tn-5B1-4细胞。5 d后有少量绿色荧光显示,见图3B,分离获得血清中的重组病毒颗粒,连续3轮感染Tn-5B1-4通过荧光显微镜观察发现在细胞内荧光蛋白越来越多,均匀分布于靠近细胞膜附近,见图3C、D、E。
经12% SDS-PAGE电泳和Western blotting免疫印迹分析,结果在55 kD与72 kD之间有1条特异性条带,与预计在60 kD左右有1条目的条带相符合,见图4。 Ni2+-NTA亲合层析柱纯化目的蛋白,用考马斯亮蓝法测定蛋白浓度约为144.9 mg/L。
4融合蛋白封闭HER2阳性细胞株SKBR3与HER2阴性细胞株MCF7功能的对比分析
将纯化后的融合蛋白分别做3个梯度的稀释后,不同浓度的融合蛋白anti-HER2-ScFv-GFP与HER2阳性的乳腺癌细胞SKBR3均结合,表面分布大量绿色荧光,细胞表面的荧光单链抗体不容易被洗脱,细胞有微弱的皱缩现象,见图5A,而3个梯度的融合蛋白与HER2阴性的乳腺癌细胞MCF7混合后表面的携带绿色荧光单链抗体极易被洗脱而表面无绿色荧光,见图5B,不同浓度的GFP蛋白标准品与HER2阳性的乳腺癌细胞SKBR3也容易被洗脱而无法观察到绿色荧光,见图5C。
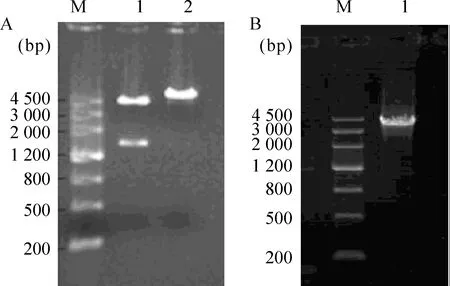
Figure 2.The pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP positive plasmid was digested by restriction enzyme EcoR I and Hind III,and was transformed into dh10Bac cells(containing bacmid and help plasmid).Transposition occurred between the mini-Tn7 element on the pFAST Bac-to-Bac HT A and the mini-att Tn7 target site on the bacmid to generate a recombinant bacmid.The recombinant bacmid was verified by PCR to make sure that the fusion gene anti-HER2-ScFv-GFP had been transferred into bacmid.A: M:marker;1:the double digestion product of pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP positive plasmid;2:the single digestion product of pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP positive plasmid;B: M:marker;1:the PCR product of the recombinant bacmid containing fusion gene anti HER2 ScFv-GFP.
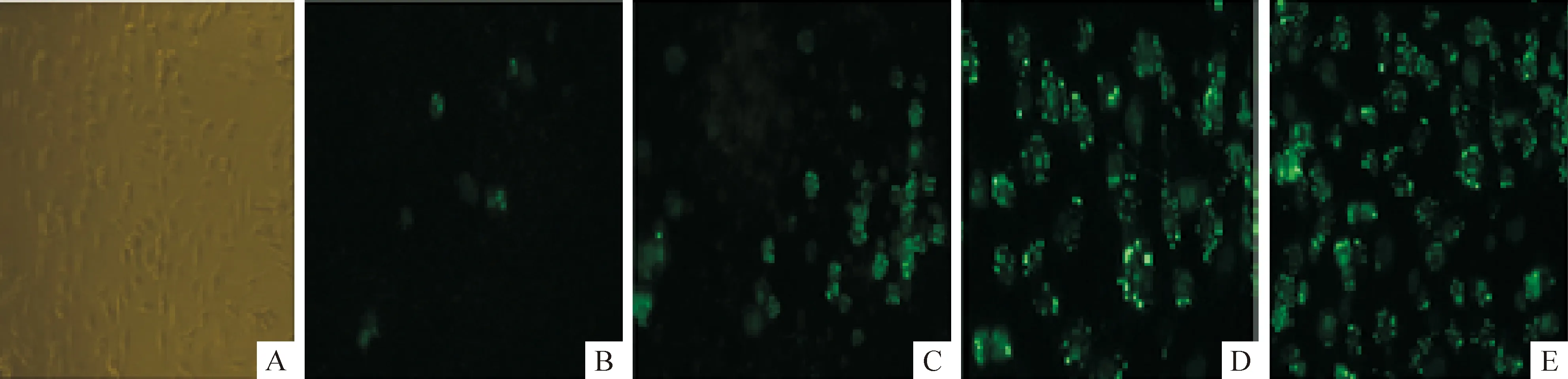
Figure 3.The recombinant bacmid was transfected into insect cells Tn-5B1-4,and the green fluorescence was seen.It was showed that the fusion gene anti-HER2-ScFv-GFP had been integrated into bacmid.The recombinant virus infected insect cells Tn-5B1-4.The result indicated that the anti-HER2-ScFv-GFP with green fluorescent protein was successfully expressed in insect cells Tn-5B1-4.A:negative control;B:insect cells Tn-5B1-4 transfected by the recombinant bacmid;C:insect cells Tn-5B1-4 infected by the recombinant virus at the first phase(5 d);D:insect cells Tn-5B1-4 infected by the recombinant virus at the second phase(5 d);E:insect cells Tn-5B1-4 infected by the recombinant virus at the third phase(5 d).
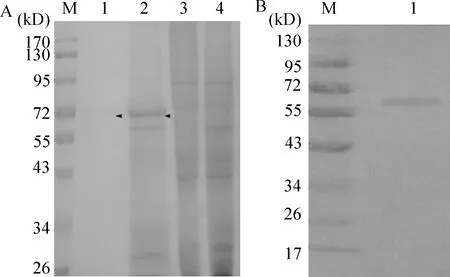
Figure 4.The SDS-PAGE and Western blotting analysis of the fusion protein anti-HER2-ScFv-GFP from the infected Tn-5B1-4.It indicated that there was a specific protein between 55 kD and 72 kD.A: the result of the SDS-PAGE analysis.M: marker;1: the fusion anti-HER2-ScFv-GFP purified protein from Tn-5B1-4;2: the fusion protein anti-HER2-ScFv-GFP from the infected Tn-5B1-4;3:Tn-5B1-4-bacmid;4:Tn-5B1-4 negative control.B: the Western blotting analysis result.M: marker;1: the fusion protein anti-HER2-ScFv-GFP.
讨 论
在乳腺癌的治疗中,癌基因HER2的表达水平与预后、治疗手段的选择等相关。虽然HER2在乳腺癌的表达率不高,但是阳性病例在临床上往往表现预后差、发展快。因此,针对HER2制备抗HER2的单链抗体开发新的生物靶向治疗方法具有十分重要的意义。
目前,以抗HER2单链抗体为研究对象,将效应分子与之融合直接在细胞中表达,获得具有靶向杀伤性抗HER2单链抗体,并用其靶向治疗HER2阳性肿瘤细胞的报道越来越多。此研究思路利用抗HER2单链抗体既可以封闭HER2信号通道,又能特异性地发挥杀伤作用。裘秀春等[9]将抗HER2单链抗体基因e23ScFv与铜绿假单胞菌外毒素PE的转膜结构域基因(PEII)和tBid基因连接,构建携带抗HER2重组融合蛋白基因ScFv/tBid的真核表达载体pCMV,转染骨肉瘤E10细胞,采用间接免疫荧光染色法观察发现细胞出现明显的固缩、核浓缩等形态特征。王芳等[10]研究重组抗HER2 ScFv/tBid基因在SKBR3细胞中的表达及其对转染SKBR3细胞的作用,结果表明重组抗HER2 ScFv/tBid分子可以在转染的SKBR3细胞中表达,采用间接免疫荧光染色法观察到该融合蛋白可抑制转染细胞的生长,诱导细胞发生凋亡。此外,以抗HER2单链抗体作为导向系统偶联各种HER2阳性肿瘤细胞的HER2受体并特异性杀死该肿瘤细胞的研究还有很多。
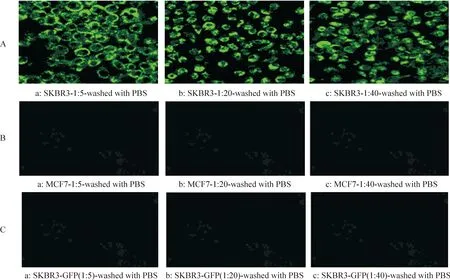
Figure 5.The combining function comparison of fusion protein anti-HER2-ScFv-GFP with HER2-negative breast cancer cell MCF7 and HER2-positive breast cancer cell SKBR3.The combining function of GFP with HER2-positive breast cancer cell SKBR3 was also observed.A: the combining function result of fusion protein anti-HER2-ScFv-GFP with SKBR3;B: the combining function result of fusion protein anti-HER2-ScFv-GFP with MCF7;C: the combining function result of GFP with SKBR3.
在融合蛋白的检测方面,本研究充分利用绿色荧光蛋白在活细胞中可直接观察外源基因表达的特点,在融合基因的设计中,将抗HER2-ScFv基因片段置于融合基因的上游,绿色荧光蛋白GFP置于融合基因下游,通过引物设计删除抗HER2-ScFv基因的终止密码子TAA,构建成绿色荧光蛋白基因处下游的融合基因anti-HER2-ScFv-GFP。结果,利用激光共聚焦显微镜或者普通荧光显微镜在昆虫细胞Tn-5B1-4内细胞膜附近可直接观察到明显绿色荧光出现,表明绿色荧光蛋白在昆虫细胞中成功表达,从而可直接断定该融合基因上游的部分片段抗HER2单链抗体基因在该昆虫细胞中正确表达。而在前期的抗HER2单链抗体的表达中,众多研究通过间接免疫荧光染色法或者夹心ELISA 法进行检测融合蛋白的表达[10,11],这些方法中需要使用多种抗体参与鉴定过程或需要使用专业设备。而本研究中,若在昆虫细胞内显示绿色荧光,则表明GFP正确表达不需要通过间接免疫荧光染色法或者夹心ELISA 法即可判断抗HER2-ScFv成功表达。
在抗HER2单链抗体的靶向功能检测方面,本研究利用杆状病毒表达载体pFAST Bac-to-Bac HT A含有6×His的特点,采用Ni2+-NTA亲和层析法获得高度纯化的目的融合蛋白进行靶向性验证,弱化了杂质对靶向性的影响。结果,利用激光共聚焦显微镜直接观察到被认定为HER2阳性的乳腺癌细胞SKBR3表面均匀分布大量的绿色荧光,且高浓度的融合抗体与SKBR3结合24 h后有一定的皱缩现象,而被认定为HER2阴性的乳腺癌细胞MCF7与该融合蛋白结合后很容易被PBS洗脱。分析认为,携带绿色荧光的抗HER2单链具有靶向结合HER2阳性细胞表面HER2的功能,更重要的是鉴定靶向性时也仅需要利用激光共聚焦显微镜或普通荧光显微镜观察HER2阳性细胞表面的荧光分布情况即可,同时细胞发生皱缩变化等动态现象也很明显。张立红等[12]构建重组真核表达载体pCMV-e23scFv-PEII-revcasp3,并转染人T淋巴瘤细胞系Jurkat,筛选并建系。用ELISA检测培养上清中融合蛋白的分泌表达,将上清接种人卵巢癌细胞SKOV3细胞之后1-6 d用MTT(噻唑蓝)比色法检测细胞的存活情况。姚燕丹等[13]将HER2阳性的人乳腺癌BT 474和HER2阴性的人乳腺癌MDA-MB 231细胞分为单纯原位移植组和matrigel联合移植组,肿瘤组织及相关脏器送病理切片和HE染色及免疫组化,比较matrigel对2种乳腺癌细胞移植后肿瘤形成时间、成瘤率、肿瘤生长、增殖、凋亡和转移的情况,结果用免疫组化法和HE染色法,然后用光镜观察肿瘤凋亡和增殖情况。从方法学上比较,在融合蛋白的表达和靶向性检测2个方面充分利用绿色荧光的报告作用,对简化检测步骤、避免误差有一定作用。
在抗HER2单链抗体的结合效率方面,将浓度为144.9 mg/L的纯化蛋白3个梯度进行结合实验,均在HER2阳性的细胞表面有明显荧光,可以认为携带绿色荧光的融合抗HER2单链抗体具有特异靶向性。从pFAST Bac to Bac HT A表达载体的序列图谱看,核糖体结合位点后的第1个翻译起始密码子ATG与目的融合基因的起始密码子之间的碱基数目多翻译出30个氨基酸,其是由ATG、6×His、TEV site构成,分析认为本实验中得到的抗HER2单链抗体实际是在上游多出30个氨基酸,下游多出1个绿色荧光蛋白的融合蛋白,功能域几乎没有影响。但是,将该种携带绿色荧光的抗HER2单链抗体与药物分子相互结合,再进行靶向杀伤治疗,是否有影响还需要进一步研究。
本研究利用抗HER2 ScFv在抗HER2治疗中的靶向功能,又利用绿色荧光蛋白的报告作用,将为研究抗HER2治疗提供新思路。本实验的成功使原来不可见的单链抗体封闭乳腺癌细胞表面HER2受体现象在荧光蛋白的报告下能够变得可见。通过测定荧光强度可以对抗HER2单链抗体基因的表达水平和封闭效率进行判断,更直观分析乳腺癌细胞凋亡与单链抗体浓度变化的关系。
[1]Baxevanis CN,Sotiropoulou PA,Sotiriadou NN,et al.Immunobiology of HER-2/neuoncoprotein and its potential application in cancer immunotherapy[J].Cancer Immunol Immunother,2004,53(3):166-175.
[2]Zhou H,Randall RL,Brothman AR,et al.Her-2/neu expression in osteosarcoma increases risk of lung metastasis and can be associated with gene amplification[J].J Pediatr Hematol Oncol,2003,25(1):27-32.
[3]Morris CD,Gorlick R,Huvos G,et al.Human epidermal growth factor receptor 2 as a prognostic indicator in osteogenic sarcoma[J].Clin Orthop Relat Res,2001,(382):59-65.
[4]Ross JS,Fletcher JA.The HER-2/neuoncogene: prognostic factor,predictive factor and target for therapy[J].Semin Cancer Biol,1999,9(2):125-138.
[5]Salmon DJ,Clark GM,Wong SG,et al.Human breast cancer:correlation of relapse and survival with amplification of the HER2/neu oncogene[J].Science,1987,235(4785):177-182.
[6]Li X,Stuckert P,Bosch L,et al.Single chain antibody-mediated gene delivery into ErbB2-positive human breast cancer cell[J].Cancer Gene Ther,2001,8(8):555-565.
[7]Tsai YS,Shiau AL,Chen YF,et al.Enhancement of antitumor activity of gammaretrovirus carrying IL-12 gene through genetic modification of envelope targeting HER2 receptor: a promising strategy for bladder cancer therapy[J].Cancer Gene Ther,2010,17(1):37-48.
[8]Tse C,Brault D,Gligorov J,et al.Evaluation of the quantitative analytical methods real-time PCR forHER-2 gene quantification and ELISA of serum HER-2 protein and comparison with fluorescenceinsituhybridization and immunohistochemistry for determining HER-2 status in breast cancer patients[J].Clin Chem,2005,51(7):1093-1101.
[9]裘秀春,单乐群,纪振钢,等.重组抗HER2融合蛋白基因ScFv/tBid对骨肉瘤E10细胞的促凋亡作用[J].中国肿瘤生物治疗杂志,2008,15(2):105-109.
[10]王 芳,裘秀春,王立锋,等.重组抗HER2 ScFv/tbid基因的表达及其对乳腺癌SKBr-3细胞的促凋亡作用[J].第四军医大学学报,2006,27(12):1057-1059.
[11]解志刚,郭 宁,施 明,等.抗人P185erbB2的scFv-Fc 融合蛋白的表达及免疫功能分析[J].生物化学与生物物理学报,2003,35 (4): 371-374.
[12]张立红,贾林涛,鲍 炜,等.抗HER2单链抗体融合凋亡蛋白对SKOV3细胞的靶向杀伤[J].细胞与分子免疫杂志,2003,19(2):160-162.
[13]姚燕丹,黄松音,袁广卿,等.Matrigel对不同Her2表达的乳腺癌细胞原位成瘤、增殖、凋亡和转移的影响[J].中国病理生理杂志,2009,25(12):2338-2343.
Expressionoffusionproteinanti-HER2-ScFv-GFPininsectcellsandbindingtosurfaceofbreastcancercells
GAO Guo-hui1,WANG Jin-dan1,HUANG Qi-di2,YANG Ji-feng1,YANG Shui-bing1,BAO Bing-bing3,ZHANG Yu3,HU Xiao-qu2
(1SchoolofLifeSciences,2DepartmentofSurgicalOncology,TheFirstAffiliatedHospital,3RenjiSchool,WenzhouMedicalCollege,Wenzhou325000,China.E-mail:drhxj@163.com)
AIM: To express a recombinant fusion protein anti-human epidermal growth factor receptor-2 single-chain variable fragment with green fluorescent protein (anti-HER2-ScFv-GFP) using the insect cells-Bac-to-Bac baculovirus expression system and to analyze the binding function of this fusion protein with HER2 on the surface of the breast cancer cells.METHODSHuman anti-HER2-ScFv gene from mice was fused with GFP gene.To obtain the recombinant plasmid pFAST Bac-to-Bac HT A/anti-HER2-ScFv-GFP,we inserted it into Bac-to-Bac baculovirus expression plasmid pFAST Bac-to-Bac HT A.The identified recombinant plasmid was transferred intoEscherichiacoliDH10Bac to allow the generation of a recombinant bacmid.After transfected the recombinant virus bacmid into the insect cells Tn-5B1-4,the recombinant virus was collected to infect Tn-5B1-4.SDS-PAGE and Western blotting analysis were used to verify the expression product in Tn-5B1-4.The fusion protein was purified with Ni2+-NTA affinity chromatography.The purified fusion protein was bound to the surface of HER2-positive breast cancer cells SKBR3 and HER2-negative breast cancer cells MCF7.The binding effects on the surface of breast cancer cells were observed under laser confocal microscope.RESULTSThe fusion gene anti-HER2-ScFv-GFP was successfully constructed with the length of 1 539 bp.The green fluorescence was also observed in Tn-5B1-4 cells infected with the recombinant virus under fluorescent microscope.A 60 kD protein was examined and confirmed by SDS-PAGE and Western blotting.Under laser confocal microscope,strong green fluorescence was observed on the surface of the HER2-positive breast cancer cells SKBR3.However,no green fluorescence was observed on the surface of HER2-negative breast cancer cell MCF7.Obvious green fluorescence on the surface of HER2-positive breast cancer cell SKBR3 was also found after the cells were eluted with 1×PBS.CONCLUSIONThe fusion protein anti-HER2-ScFv-GFP was successfully expressed in insect cells Tn-5B1-4,and can firmly bind to the surface of breast cancer cells SKBR3 and emit the green fluorescent light.
anti-HER2-ScFv; Green fluorescent protein; Fusion gene expression
1000-4718(2011)05-1034-07
R363
A
10.3969/j.issn.1000-4718.2011.05.040
2010-12-16
2011-03-04
国家自然科学基金资助项目(No.30801118/C160403);浙江省自然科学基金资助项目(No.Y207301);温州市科技局资助项目((No.Y20090293;No.Y2003A138)
△通讯作者 Tel:0577-88078237;E-mail:drhxj@163.com
