妊娠期脂多糖接触激活体内TLR4信号通路引起胚胎脑内炎症应激
2011-11-20朱元贵陈晓春陈志
朱元贵, 陈晓春, 陈志
(福建医科大学附属协和医院1神经内科,福建省老年医学研究所,2 血液科,福建省血液病研究所,福建 福州 350001;3 Rush大学医学中心药理学系,美国伊利诺伊州 芝加哥市 60612)
妊娠期脂多糖接触激活体内TLR4信号通路引起胚胎脑内炎症应激

(福建医科大学附属协和医院1神经内科,福建省老年医学研究所,2血液科,福建省血液病研究所,福建 福州 350001;3Rush大学医学中心药理学系,美国伊利诺伊州 芝加哥市 60612)
目的: 观察孕鼠腹腔脂多糖 (LPS) 注射后母体外周血单个核细胞 (PBMNC) 上Toll样受体4 (TLR4) 信号通路激活情况和胚胎脑组织中炎症性细胞因子的水平。方法10.5 d孕鼠腹腔注射LPS 0、3、6、12、24、48 和72 h后,通过蛋白免印迹测定孕鼠PBMNC 上TLR4、分化抗原14 (CD14)、髓样分化蛋白2 (MD-2)、p65和p50蛋白水平,Luminex 100免疫荧光法测定孕鼠血清、羊水、脑组织及胚胎脑组织细胞因子TNF-α、IL-1β和IL-10蛋白水平,实时RT-PCR测定孕鼠PBMNC和胚胎脑组织TNF-α、IL-1β和IL-10 mRNA水平。结果LPS腹腔注射诱导激活孕鼠PBMNC上TLR4信号通路,TLR4、CD14和MD-2蛋白水平短暂增高,核因子κB (NF-κB) 激活片段p65 和p50蛋白水平增高,TNF-α、IL-1β和IL-10 mRNA水平增高(Plt;0.01);孕鼠外周血和羊水TNF-α、IL-1β和IL-10水平短暂增高(Plt;0.01),脑内IL-1β蛋白水平短暂升高(Plt;0.01);胚胎脑内TNF-α和IL-1β蛋白和mRNA水平显著增高(Plt;0.01)。结论妊娠期母体LPS接触可激活母体外周免疫细胞TLR4信号通路,引发胚胎脑内炎症应激状态,可能增加出生后相关疾病的发生风险。
脂多糖; Toll样受体4; 细胞因子类; 胚胎
细菌性阴道炎 (bacterial vaginosis,BV) 是妊娠期常见的感染性疾病,大约占妊娠人数的14%[1]。BV是引起早产、低体重儿和死胎的重要原因[2,3]。BV主要由革兰阴性菌引起,引起绒毛膜组织肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、白细胞介素1β (interleukin 1β,IL-1β) 和白细胞介素6 (IL-6) 水平明显增高[4,5]。在BV孕妇羊水中也可以检测出内毒素成分脂多糖 (lipopolysaccharide,LPS)[5]。LPS可诱导胎盘绒毛组织生成炎性细胞因子和前列腺素,与流产和早产有关[6]。此外,BV与白质损伤和脑瘫等胎儿的神经系统疾病发生有关[7]。我们前期研究发现Sprague-Dawley (SD) 大鼠在多巴胺 (dopamine,DA) 能神经元发育早期阶段即妊娠期第10.5 d腹腔注射LPS后引起出生后个体DA 能神经元数量减少、纹状体DA含量降低、脑内小胶质细胞活化、炎性细胞因子TNF-α和IL-1β水平升高[8-10]等帕金森病 (Parkinson disease,PD) 特征性的神经病理变化,提示妊娠期感染可能是胚胎出生后发生PD的重要危险因素之一,但是妊娠期母体LPS暴露如何影响胚胎和出生后个体DA系统的功能还不清楚。
LPS是革兰阴性菌的主要致病成分,具有强烈的免疫激活功能,诱导机体细胞因子失控性表达。Toll样受体4 (Toll-like receptor 4,TLR4) 是LPS主要识别受体,是介导LPS引发细胞内信号激活不可缺少的细胞表面成分之一[11]。LPS首先与血清的LPS结合蛋白 (LPS-binding protein,LBP) 结合,然后再结合于细胞表面的CD14分子。LPS以LPS-LBP-CD14三体复合物形式活化TLR4信号通路。同时结合于TLR4胞外区的髓样分化因子-2 (myeloid differentiation factor 2,MD-2) 对于稳定LPS-LBP-CD14复合物具有重要的作用,是TLR4信号通路中不可缺少的成分之一[12]。TLR4参与的信号转导可以通过核因子 (nuclear factor κB,NF-κB) 激活细胞因子基因转录,如IL-1、IL-6和IL-8,介导B7家族成员表达活化[13]。
因此本研究观察孕鼠第10.5 d LPS腹腔注射后孕鼠外周血单个核细胞 (peripheral blood mononuclear cells,PBMNC) TLR4、CD14、MD-2、p65和p50蛋白以及细胞因子TNF-α、IL-1β 和IL-10 mRNA水平的变化,同时测定孕鼠血清、羊水和脑内TNF-α、IL-1β 和IL-10 蛋白以及胚胎脑内细胞因子蛋白和mRNA水平,为妊娠期LPS暴露引起出生后个体中枢神经系统功能异常提供胚胎早期异常的实验依据。
材 料 和 方 法
1动物的选择
2 月龄成年SD大鼠购自Zivic-Miller公司。所有的动物饲养在清洁级的动物中心,常规给于饲料和饮用水,所有的动物在使用前3 d送达,以让动物适应饲养环境。所有有关动物实验的方案经过美国Rush大学实验动物管理委员会批准。
2SD孕鼠腹腔LPS注射
于妊娠期第10.5 d (embryonic day 10.5,E10.5) 腹腔注射LPS (Sigma,型号:Escherichiacoli026∶B6; 目录号: L-8274; 10 000 endotoxin units/kg溶于HBSS中) 或HBSS (Hank’s balanced salt solution) 对照,分别于注射后0、3、6、12、24、48和72 h后处死孕鼠,对照组取72 h,每组5只,分别收集孕鼠和胚胎组织,进行下一步的实验。
3动物的处死和标本的收集
常规苯巴比妥钠 (65 mg/kg) 麻醉后打开腹腔,用27G1注射针头迅速收集羊水,加入肝素抗凝,然后取出胎盘和胚胎组织置于预冷的HBSS中,随后母体心室内抽取5-10 mL全血,肝素抗凝后用于单个核细胞的分离,同时抽取1 mL全血用于分离血清。最后心室内灌注预冷的生理盐水,迅速取出大脑放入干冰预冷的2-甲基丁烷迅速冷冻后置于-80 ℃保存。胚胎断头后在解剖显微镜下剥离脑膜及血管,分离出的大脑组织用PBS冲洗后,一半置于组织裂解液(Bio-Rad),另一半置于Trizol液(Invitrogen)中,均用超声波匀浆仪 (Biologics) 制备匀浆后于-80 ℃下保存不超过2个月。
4PBMNC分离
用Ficoll-Paque Plus淋巴细胞分离液 (Amersham Biosciences) 常规分离PBMNC,PBS清洗2次制备细胞悬液,分成2份离心去掉上清液,一份加入100 μL组织裂解液,另一份加入200 μL Trizol液,混匀后于-80 ℃下保存。
5孕鼠脑组织的分离
把冷冻的全脑置于干冰预冷的大理石板上,根据大鼠脑部解剖图谱,从水平方向切成2 mm厚的薄片,根据纹状体和中脑所在部位,用直径为2 mm的中空组织收集细针收集纹状体和中脑黑质组织,同时收集小脑组织,置于组织裂解液(每10 mg组织至少200 μL裂解液)中,然后用超声波匀浆仪制备匀浆后低温12 000×g离心30 min,汲取上清液进行蛋白浓度测定(Bio-Rad),蛋白浓度表示为g/L。
6PBMNC细胞裂解液Westernblotting测定
细胞裂解液低温下12 000×g离心15 min后汲取上清液进行蛋白浓度测定后用裂解液稀释成2 g/L的样本液,然后加入等体积的上样缓冲液 (62.5 mmol/L Tris-HCl,pH 6.8,10% 甘油,2% SDS,0.1% 溴酚蓝),熟沸5 min,冷却后取样品30 μg以10% SDS-聚丙烯酰胺凝胶电泳分离,分离的蛋白转移到硝酸纤维素膜上,室温下用封闭液 (含5%脱脂奶粉和1.2%Tween 20)封闭1 h后分别加入用封闭液稀释的兔抗鼠TLR4 (Santa cruz,1∶500),或CD14 (Santa Cruz,1∶500),或MD-2 (Santa Cruz,1∶500),或p65和p50 (Santa Cruz,1∶1 000),或β-actin (Abcam,1∶4 000稀释),4 ℃孵育过夜,用1∶4 000稀释的辣根过氧化物酶偶联的抗兔IgG(Vector)孵育2 h,再用增强型化学发光法显色 (Pierce),X射线底片 (Fujifilm RX) 曝光。同时选择β-actin为内参照。每次曝光后底片扫描后对条带的点密度用Scion的软件进行定量,然后与β-actin作比较,计算出相对百分值。
7细胞因子的测定
细胞因子的测定利用Bio-Rad的多细胞因子分析试剂盒(TNF-α,IL-1β,IL-10)测定,测定方法为Luminex 100免疫荧光法,具体方法可参考文献[14,15]。这种方法的原理是把不同的抗体连接到特殊的微粒上,然后与标本孵育,这样抗原与抗体结合在微粒上后再与生物素标记的抗体孵育后形成抗体-抗原-抗体复合物,最后用链亲和素标记的Ⅱ抗结合生物素标记的抗体,结合流式细胞仪测定微粒的荧光信号,进行定量测定。血清和羊水用分析液进行1∶8稀释,脑组织提取液用裂解液调整蛋白浓度到1 g/L后再测定。血清和羊水样本的细胞因子浓度表示为ng/L,脑组织样本的浓度表示为ng/g 蛋白,所有标本重复测定,取平均值作为样本的值。当样本的荧光强度值低于标准曲线最低值1.95 ng/L时,取1.95 ng/L作为测定值进行分析统计。
8实时定量RT-PCR(real-timeRT-PCR)检测细胞因子mRNA表达
利用Trizol常规提取PBMNC和胚胎脑组织总RNA,RNA定量后用DNase (Ambion) 处理样本去除DNA污染以纯化RNA,然后应用一步法real-time RT-PCR检测TNF-α、IL-1β和IL-10 mRNA的表达水平,并以β-actin为参照,试剂购自Qiagen。引物序列见表1。25 μL的反应体系包括1× RT混合液、0.5 μmol/L的引物和2.5单位的逆转录酶。反应以SYBR Green为荧光指示剂。反应在50℃下30 min进行逆转录,95 ℃下15 min灭活逆转录酶,然后94 ℃变性15 s,退火温度和时间见表1,72 ℃延伸45 s,共30 (β-actin) 或40个循环。PCR扩增反应的结果根据熔解温度 (Tm) 进行判定。选择LPS腹腔注射6 h后脾组织的总RNA建立TNF-α、IL-1β、IL-10和β-actin mRNA扩增标准曲线,根据标准品确定样本的mRNA相对量,并与内参照β-actin对比,计算出样本内不同细胞因子与β-actin的比值。另外在扩增终点取8 μL的产物,进行1.5%琼脂糖凝胶电泳并拍照,进一步确定PCR反应的特异性。
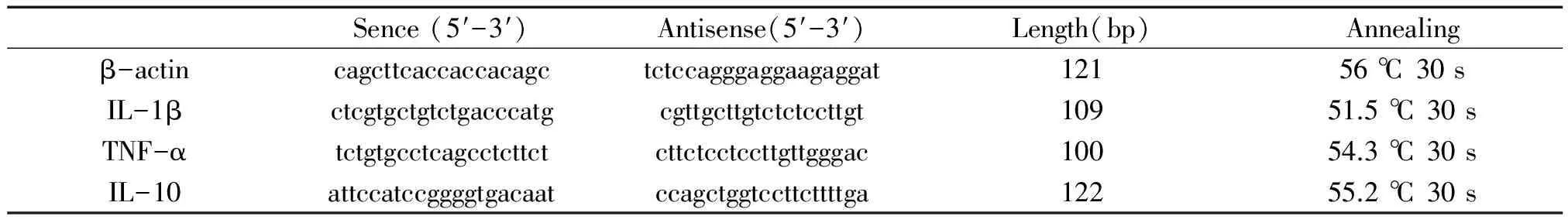
表1 实时RT-PCR的引物序列和扩增条件
9统计学处理
结 果
1孕鼠LPS注射后母体PBMNC上TLR4信号通路的激活
孕鼠PBMNC上表达有TLR4、MD-2和CD14,LPS腹腔注射后以上蛋白组份均短暂增高 (Plt;0.01vs0 h),见图1。LPS注射后在3 h-12 h间可见NF-κB激活片段p65和p50表达,提示LPS可快速诱发免疫细胞内TLR4信号通路中NF-κB激活,促进核内有关炎症性基因的转录。
2孕鼠LPS注射后母体PBMNC细胞因子mRNA的表达水平
由图2可见,LPS注射后PBMNC上TNF-α、IL-1β和IL-10 mRNA表达水平明显增高(Plt;0.01vs0 h)。TNF-α mRNA水平3 h后就达到峰值,48 h后逐渐恢复到正常水平。IL-1β mRNA持续升高到6 h后逐渐下降,在72 h后仍高于正常值水平,而IL-10 mRNA水平在12 h后明显上升,但24 h后就逐渐恢复到正常水平。

Figure 1.Maternal lipopolysaccharide (LPS) administration induces a variety of proteins expressed in peripheral blood mononuclear cells (PBMNC) of gravid rats.±s.n=5.**Plt;0.01 vs control (0 h).
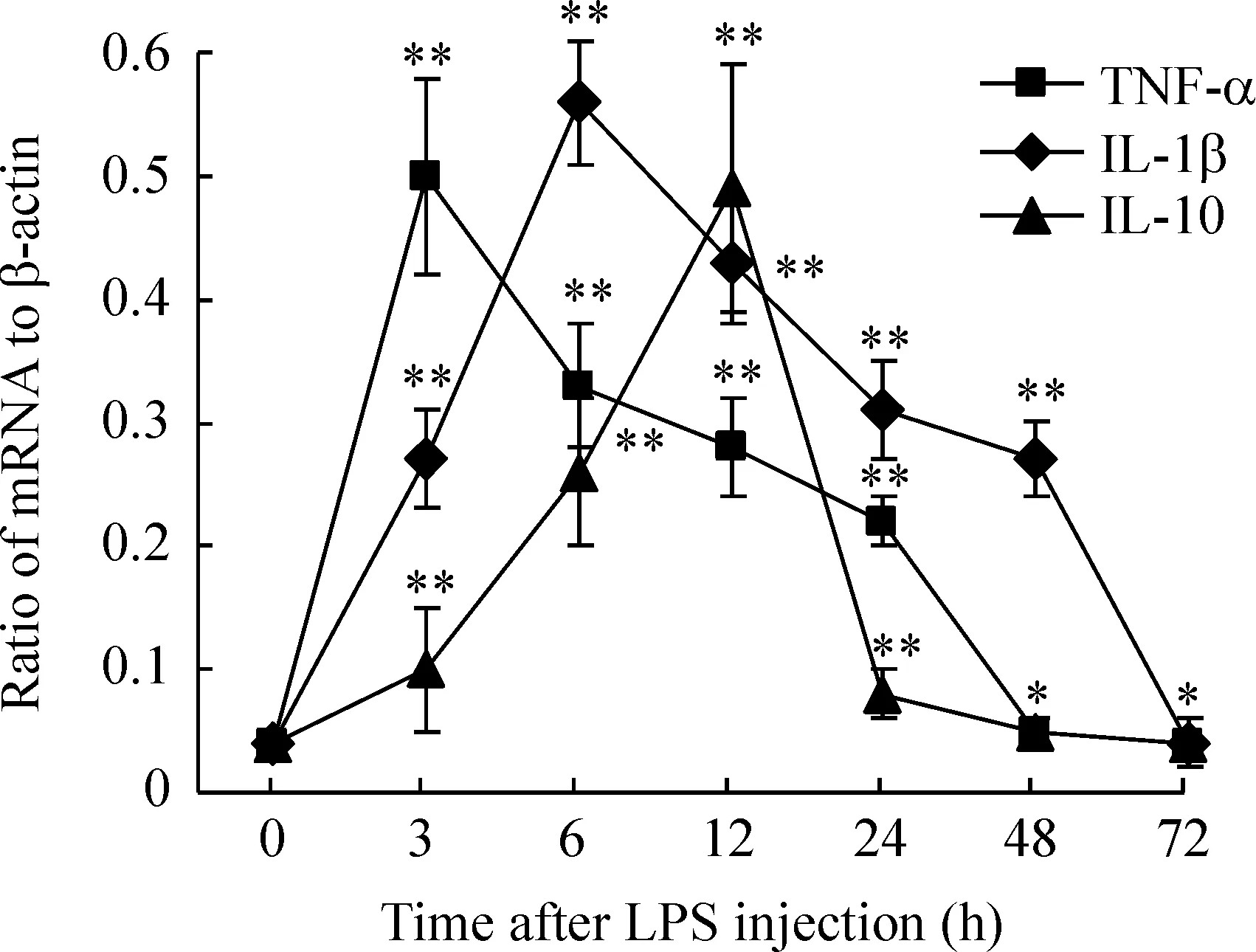
Figure 2.The mRNA levels of TNF-α,IL-1β and IL-10 in PBMNC of gravid rats after maternal LPS administration.±s.n=5.*Plt;0.05,**Plt;0.01 vs control (0 h).
3孕鼠LPS注射后母体血清、羊水和脑内细胞因子水平
由表2可见,LPS作用后孕鼠血清TNF-α和IL-1β水平明显增高 (Plt;0.01vs0 h)。TNF-α在6 h就达到高峰,随后持续下降。IL-1β持续升高到12 h后缓慢下降,72 h仍高于正常水平 (Plt;0.01vs0 h)。此外LPS作用6 h后IL-10水平明显增高 (Plt;0.01vs0 h),24 h后迅速下降到正常水平。
同时,E10.5腹腔注射LPS后可见羊水内细胞因子TNF-α、IL-1β和IL-10水平明显增高 (Plt;0.01vs0 h)。此外孕鼠脑内纹状体、中脑黑质和小脑组织内只有IL-1β出现水平升高 (结果未显示),24 h后恢复到正常水平。
4孕鼠LPS注射后胚胎脑组织内细胞因子水平
E10.5孕鼠腹腔注射LPS后3 h胚胎脑组织内TNF-α和IL-1β水平明显增高 (Plt;0.01vs0 h),见表3,而IL-10水平没有改变。TNF-α和IL-1β 72 h后仍高于对照组水平,提示胚胎脑内炎症性细胞因子水平增高。
5孕鼠LPS注射后胚胎脑组织内细胞因子mRNA水平
为进一步验证脑组织内的细胞因子是否来源于胚胎脑组织本身转录翻译,我们还测定了脑组织内TNF-α、IL-1β和IL-10 mRNA表达水平。由图3可见,LPS作用后脑内TNF-α和IL-1β mRNA表达水平明显增加 (Plt;0.01vs0 h)。其中TNF-α mRNA 24 h后下降到正常水平,IL-1β在48 h后逐渐下降到正常值水平,而IL-10 mRNA的表达水平没有明显变化。
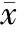
表2 孕鼠腹腔LPS注射后不同时点血清和羊水细胞因子水平
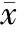
表3 孕鼠腹腔LPS注射后不同时点胚胎脑内细胞因子水平
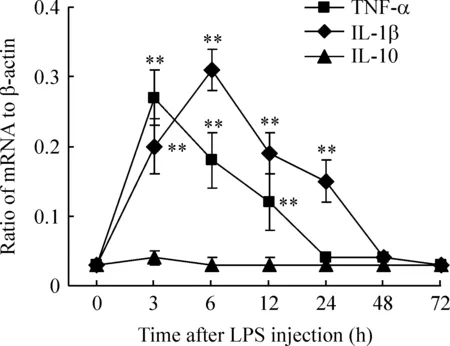
Figure 3.The mRNA levels of TNF-α,IL-1β and IL-10 in embryonic brains after maternal LPS administration..n=5.**Plt;0.01 vs control (0 h).
讨 论
本研究发现孕鼠LPS接触后可通过TLR4信号通路激活母体PBMNC上NF-κB,诱导相关细胞因子基因转录,并引起胚胎脑内炎症性细胞因子水平增高。结合我们前期发现的E10.5腹腔注射LPS可引起出生后个体DA 能神经元数量减少[8-10],推测在DA能神经元发育阶段,妊娠母体内毒素诱发的胎儿脑内炎症应激,可能会影响胚胎期DA神经元系统发育,最终引起出生后个体DA神经元系统功能障碍。
TLR4广泛表达在各种免疫细胞表面。本研究中,孕鼠腹腔注射LPS后PBMNC TLR4、CD14和MD-2短暂性表达增加,同时LPS诱导NF-κB激活引起p65和p50水平增加。PBMNC内TNF-α和IL-1β mRNA表达水平以及血清中有关细胞因子水平亦明显升高。PBMNC内p65水平升高、细胞因子mRNA表达升高和血清中细胞因子水平升高具有一定的时间次序,提示PBMNC可识别LPS诱发信号激活NF-κB,随后引起细胞因子的基因转录。
此外,本研究发现在LPS作用的早期血清中抗炎性细胞因子IL-10亦有升高。IL-10处理后的单核细胞对LPS的反应性明显下降,提示IL-10在LPS引起的炎症反应中起对抗作用[16]。LPS引起IL-10水平的升高和IL-10的对抗作用发生在TNF-α和IL-1β等炎症性细胞因子水平升高以后[16]。本研究也发现IL-10蛋白或mRNA水平均较TNF-α和IL-1β反应慢,而且持续的时间较IL-1β短,提示LPS暴露后IL-10水平增高可能是一种防御性作用,但炎症性细胞因子占优势,诱导了炎症损伤。
LPS作用后孕鼠体内免疫细胞通过TLR4信号途径识别LPS和激活信号通路并诱导产生细胞因子,这种作用引起的炎症性细胞因子是否会影响胚胎的发育,或是胚胎本身是否能识别LPS从而诱发自身的免疫反应,目前还不清楚。本研究结果证实孕鼠LPS接触会引起胎儿脑内炎症性细胞因子水平升高,这种结果对于包括DA神经元系统在内的神经组织发育具有重要的影响作用。在胚胎发育的早期,由于胎盘屏障和血脑屏障发育不成熟,母体LPS接触后产生的细胞因子可能通过血液循环进入胎盘和胚胎组织引起胚胎脑内细胞因子增高,或是妊娠母体LPS直接进入胚胎体内。但是此阶段胚胎是否识别LPS以及如何激活自身的免疫系统还不清楚。本研究发现胚胎脑内只有炎症性细胞因子(TNF-α和IL-1β)在蛋白和mRNA水平明显升高,而IL-10没有明显改变,而妊娠母体外周血TNF-α、IL-1β和IL-10水平均明显增高,提示胚胎脑内TNF-α和IL-1β可能来源于胚胎本身对LPS的识别和免疫激活。事实上,TLR4表达在胚胎发育的早期,小鼠在E10就可在胚盘组织上检出TLR2和TLR4 mRNA表达,肺和肝脏组织也可在E13检出TLR2和TLR4 mRNA[17]。我们也发现小鼠胚胎脑组织在E10就可以检测出TLR2和TLR4蛋白表达(资料未显示),利用荧光标记的LPS腹腔注射孕鼠后在胚胎体内可见荧光物质[18],因此推测在E10.5,妊娠母体LPS暴露后LPS可能会直接通过胎盘组织或血液循环进入胚胎体内,识别TLR4引发相应的信号激活和基因转录。
综上所示,本研究提示妊娠期内毒素暴露可诱发机体通过TLR4信号通路诱导NF-κB激活和炎症性细胞因子的基因转录,引发胚胎炎症应激状态,导致相应窗口期的组织器官发育异常,增加出生后神经系统相关疾病的发生风险。
[1]Zabor EC,Klebanoff M,Yu K,et al.Association between periodontal disease,bacterial vaginosis,and sexual risk behaviours[J].J Clin Periodontol,2010,37 (10):888-893.
[2]Purwar M,Ughade S,Bhagat B,et al.Bacterial vaginosis in early pregnancy and adverse pregnancy outcome[J].J Obstet Gynaecol Res,2001,27 (4):175-181.
[3]Denney JM,Culhane JF.Bacterial vaginosis: a problematic infection from both a perinatal and neonatal perspective[J].Semin Fetal Neonatal Med,2009,14 (4):200-203.
[4]Dammann O,Leviton A.Maternal intrauterine infection,cytokines,and brain damage in the preterm newborn[J].Pediatr Res,1997,42 (1):1-8.
[5]Romero R,Manogue KR,Mitchell MD,et al.Infection and labor.IV.Cachectin-tumor necrosis factor in the amniotic fluid of women with intraamniotic infection and preterm labor[J].Am J Obstet Gynecol,1989,161 (2):336-341.
[6]Hillier SL,Witkin SS,Krohn MA,et al.The relationship of amniotic fluid cytokines and preterm delivery,amniotic fluid infection,histologic chorioamnionitis,and chorioamnion infection[J].Obstet Gynecol, 1993,81 (6):941-948.
[7]Ando M,Takashima S,Mito T.Endotoxin,cerebral blood flow,amino acids and brain damage in young rabbits[J].Brain Dev,1988,10 (6):365-370.
[8]Carvey PM,Punati A,Newman MB.Progressive dopamine neuron loss in Parkinson’s disease: the multiple hit hypothesis[J].Cell Transplant,2006,15 (3):239-250.
[9]Ling Z,Gayle DA,Ma SY,et al.In utero bacterial endotoxin exposure causes loss of tyrosine hydroxylase neurons in the postnatal rat midbrain[J].Mov Disord,2002,17 (1):116-124.
[10]Zhu Y,Carvey PM,Ling Z.Altered glutathione homeostasis in animals prenatally exposed to lipopolysaccharide[J].Neurochem Int,2007,50 (4):671-680.
[11]王伯瑶,黄 宁,吴 琦.炎症反应Toll信号传导通路[J].中国病理生理杂志,2000,16(6):567-571.
[12]Shimazu R,Akashi S,Ogata H,et al.MD-2,a molecule that confers lipopolysaccharide responsiveness on Toll-like receptor 4[J].J Exp Med,1999,189 (11):1777-1782.
[13]Akira S,Takeda K,Kaisho T.Toll-like receptors: critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2 (8):675-680.
[14]Hulse RE,Kunkler PE,Fedynyshyn JP,et al.Optimization of multiplexed bead-based cytokine immunoassays for rat serum and brain tissue[J].J Neurosci Methods,2004,136 (1):87-98.
[15]Ling Z,Zhu Y,Tong CW,et al.Prenatal lipopolysaccharide does not accelerate progressive dopamine neuron loss in the rat as a result of normal aging[J].Exp Neurol,2009,216 (2):312-320.
[16]Grutz G.New insights into the molecular mechanism of interleukin-10-mediated immunosuppression[J].J Leukoc Biol,2005,77 (1):3-15.
[17]Harju K,Glumoff V,Hallman M.Ontogeny of Toll-like receptors Tlr2 and Tlr4 in mice[J].Pediatr Res,2001,49 (1):81-83.
[18]Lehnardt S,Massillon L,Follett P,et al.Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway[J].Proc Natl Acad Sci U S A,2003,100 (14):8514-8519.
MaternalexposuretolipopolysaccharideinducesTLR4signalingactivationandembryonicbraininflammatorystressingravidrats

(1DepartmentofNeurology,UnionHospitalofFujianMedicalUniversity,FujianInstituteofGeriatrics,Fuzhou350001,China;2DepartmentofHematology,UnionHospitalofFujianMedicalUniversity,FujianInstituteofHematology,Fuzhou350001,China;3DepartmentofPharmacology,RushUniversityMedicalCenter,Chicago,Illinois60612,USA.E-mail:ygzhu92@gmail.com)
AIM: To observe the signaling activation of Toll-like receptor 4 (TLR4) in peripheral blood mononuclear cells (PBMNC) of gravid rats and inflammatory cytokine response in embryonic brains following maternal exposure to lipopolysaccharide (LPS).METHODSTimed-pregnant rats at embryonic day 10.5 (E10.5) were intraperitoneally injected with LPS (10 000 endotoxin unit/kg).The PBMNC,serum and amniotic fluid (AF) in gravid rat,and fetal brain were harvested 0 h,3 h,6 h,12 h,24 h,48 h and 72 h after LPS administration.Western blotting was performed to measure the protein levels of TLR4,cluster of differentiation 14 (CD14),myeloid differentiation factor 2 (MD-2),p65 and p50 in PBMNC.Luminex 100 multiplex cytokine assay and real-time reverse transcription polymerase chain reaction (RT-PCR) were used to determine the protein and mRNA levels of tumor necrosis factor α (TNF-α),interleukin 1β (IL-1β) and interleukin 10 (IL-10).RESULTSMaternal LPS exposure led to TLR4 signaling activation in PBMNC of gravid rats,with a transient (within 6 h) increase in the protein levels of TLR4,CD14 and MD-2,as well as p65 and p50,activated subunits of nuclear factor κB (NF-κB) .Proinflammatory cytokines TNF-α and IL-1β,as well as anti-inflammatory cytokine IL-10,were significantly increased in the serum and AF of gravid rats.There was only a transient increase in IL-1β protein in the brains of gravid rats.In contrast,both protein and mRNA levels of TNF-α and IL-1β were significantly increased in embryonic brains over the time course of 3 h and 48 h.CONCLUSIONThe results reveal that maternal exposure to LPS induces TLR4 signaling activation in peripheral immune cells of gravid rats and inflammatory stress in embryonic brains,indicating the pathogenesis of some postnatal diseases.
Lipopolysaccharide; Toll-like receptor 4; Cytokines; Embryo
1000-4718(2011)05-0956-06
R711; Q189
A
10.3969/j.issn.1000-4718.2011.05.023
2010-11-15
2011-02-22
△ 通讯作者 Tel: 0591-83357896-8525; E-mail: ygzhu92@gmail.com
