缺氧诱导上皮性卵巢癌细胞分化逆转机制的实验研究*
2011-11-20殷啸俊尧良清竺鹏飞徐丛剑
陈 默, 殷啸俊, 尧良清△, 李 娜, 竺鹏飞, 徐丛剑
(1复旦大学附属妇产科医院妇科,上海 200001;2昆山市第二人民医院妇科,江苏 昆山 215300)
缺氧诱导上皮性卵巢癌细胞分化逆转机制的实验研究*
陈 默1, 殷啸俊2, 尧良清1△, 李 娜1, 竺鹏飞1, 徐丛剑1
(1复旦大学附属妇产科医院妇科,上海 200001;2昆山市第二人民医院妇科,江苏 昆山 215300)
目的: 在三维培养系统中进行缺氧刺激,可诱导卵巢恶性上皮性肿瘤细胞SKOV-3和ES-2向血管内皮样细胞分化逆转,本文拟探讨其相关的分子机制。方法建立Matrigel三维培养系统,在1%O2缺氧条件下,诱导卵巢上皮性癌细胞SKOV-3和ES-2向血管内皮样细胞分化逆转后,应用端粒重复序列扩增法(TRAP)和实时荧光定量RT-PCR检测原始肿瘤细胞、肿瘤内皮样细胞和人脐静脉内皮细胞(HUVECs)端粒酶活性以及周期蛋白cyclinD1、抑癌基因p53、原癌基因v-src转录水平的差异。结果常氧时,SKOV-3和ES-2细胞端粒酶活性表达为阳性,缺氧诱导后SKOV-3内皮样细胞端粒酶活性为阳性,而ES-2内皮样细胞端粒酶活性转为阴性。缺氧诱导后的SKOV-3和ES-2内皮样细胞cyclinD1 mRNA的表达显著低于常氧时SKOV-3和ES-2的表达(Plt;0.05或Plt;0.01);和HUVECs的表达无显著差异。SKOV-3和ES-2内皮样细胞p53 mRNA的表达显著高于常氧时SKOV-3、ES-2和HUVECs的表达(Plt;0.05或Plt;0.01)。缺氧和常氧状态下各种细胞均不表达v-src mRNA。结论缺氧可以诱导少量卵巢上皮性癌细胞SKOV-3和ES-2向血管内皮样细胞分化逆转,主要是通过改变端粒酶的活性,调节cyclinD1和p53的转录水平发挥调控作用。
卵巢肿瘤; 缺氧; 血管内皮样细胞; 细胞分化; 端粒酶; 细胞周期蛋白D1; 基因,p53; 基因,v-src
卵巢癌(ovarian carcinoma)在女性生殖道癌肿中死亡率居首位,本课题组在前期研究中发现,缺氧刺激能够诱导少量上皮性卵巢癌细胞逆转分化为血管内皮样细胞,同时增加其增殖、侵袭、转移特性,在卵巢癌的发生发展中具有重要作用[1,2]。由于血管内皮细胞为非恶性肿瘤细胞,因此本文拟研究缺氧诱导部分卵巢癌细胞逆转分化前后细胞与正常内皮细胞在癌基因、原癌基因、周期蛋白及端粒酶的表达差异,以期探讨缺氧刺激上皮性卵巢恶性肿瘤细胞分化逆转的实质及其分子机制。
材 料 和 方 法
1材料
1.1细胞来源及培养 卵巢上皮性癌细胞系SKOV-3(No.HTB-77,腺癌来源)和ES-2(No.CRL-1978,透明细胞癌来源)均购自美国标准菌库(American Type Culture Collection,ATCC)。根据ATCC指引,用Mccoy’s 5A培养、传代。人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVECs)经医院医学伦理委员会同意,来自本院产科健康产妇足月剖宫产或顺产的新生儿脐带,长度gt;30 cm,无菌条件下冲洗血迹,脐静脉管腔内注入0.25%胰酶+EDTA消化细胞,1 000 r/min离心10 min分离获得消化液转移至无菌培养皿中送细胞培养室,完全培养基(M199+10%胎牛血清)37 ℃、5%CO2培养箱培养。24 h后换液,以后每2-3 d半量换液1次,观察细胞生长情况,可见铺路石样细胞。传代至第3代时进行下一步实验。
1.2主要试剂及仪器设备 胎牛血清购自Hyclone,Mccoy’s 5A购自Gibco,Matrigel胶购自Bamp;D;TRAP-Hyb kit端粒酶活性检测试剂盒购自华美生物工程公司;2.5 L缺氧盒购自Mitsubishi;细胞周期分析软件Mob Forltnacv 1.01(Bamp;D);Rotor-Gene3000 实时PCR仪(Corbett Research);Primer Premier 5.0软件(Premier Biosoft)。
2方法
2.1Matrigel三维培养及缺氧诱导 Matrigel三维培养将Matrigel与含15%FBS 的Mccoy’s 5A 培养基按1∶1(V/V)混合,滴入培养板中,37 ℃孵育凝胶;分别将对数生长期SKOV-3和ES-2消化成单细胞悬液,接种在Matrigel培养系统;分别在常氧(O2浓度为21%)、缺氧(O2浓度为1%)等条件下每隔48 h更换上述培养液1次,培养7 d。将细胞培养板置于缺氧盒中,1%O2模拟缺氧环境。
2.2体外诱导形成肿瘤内皮样细胞的鉴定 采用免疫组织化学荧光双重标记肿瘤内皮样细胞特异性抗原,透射电镜下观察肿瘤内皮样细胞超微结构,检测相关细胞acLDL吞噬功能等方法对SKOV-3细胞及ES-2细胞在缺氧诱导条件下转化为内皮样细胞及原代培养获得的人脐静脉内皮细胞进行鉴定。具体方法见本课题组前期实验结果[1]。
2.3卵巢癌内皮样细胞及相关细胞端粒酶活性的检测 收集实验2.1各组细胞及常氧下原代培养获得的人脐静脉内皮细胞,按端粒酶活性试剂盒说明书逐步操作。结果判断:酶标仪上读取450 nm的吸光度值(A值)。其中阳性对照为人胚肾转化细胞系293细胞,阴性对照为65 ℃处理30 min的293细胞获得。阴性对照A值低于0.05按0.05计算,高于0.05按实际A值计算。若A值大于0.3,则判断为无效,需重做实验。样本A值大于阴性对照A值的2.1倍时,判为端粒酶活性阳性。
2.4实时定量RT-PCR检测抑癌基因p53、原癌基因v-src和周期蛋白cyclin D1的表达 (1)引物的设计:应用Primer Premier 5.10软件设计,扫描人类基因库中未发现的其它同源序列。Cyclin D1:上游引物5’-GATGCCAACCTCCTCAACGAC-3’,下游引物5’- CTCCTCGCACTTCTGTTCCTC-3’,产物片段为171 bp;p53:上游引物5’-GCTGCTCAGATAGCGATGGTC-3’,下游引物5’-CTCCCAGGACAGGCACAAACA-3’,产物片段为298 bp;v-src:上游引物5’-CACTCGCTCAGCACAGGACAG-3’,下游引物5’-AGAGGCAGTAGGCACCTTTCG-3’,产物片段为196 bp;β肌动蛋白(β-actin):上游引物5’-GTGGTGGTGAAGCTGTAGCC-3’,下游引物5’-GAGACCTTCAACACCCC-3’,产物片段为230 bp。(2)RNA含量及纯度测定:收集实验2.1各组细胞及常氧下原代培养获得的人脐静脉内皮细胞,分别提取总RNA,测定RNA含量及纯度。(3)RT反应:20 μL反应体系,按照RT试剂盒操作步骤进行,合成cDNA。(4)PCR反应:20 μL反应体系,95 ℃预变性3 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃充分延伸7 min,结束温度为4 ℃。(5)结果与计算:各样品的目的基因和管家基因分别进行real-time PCR反应。根据绘制的梯度稀释DNA标准曲线,各样品目的基因和管家基因的浓度结果直接由机器生成。每个样品的目的基因浓度除以其管家基因的浓度,即为此样品此基因的校正后的相对含量。
3统计学处理
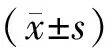
结 果
1卵巢癌内皮样细胞及相关细胞端粒酶活性的表达
常氧时SKOV-3和ES-2细胞端粒酶活性表达为阳性,缺氧诱导后SKOV-3内皮样细胞端粒酶活性为阳性,而ES-2内皮样细胞转为与人脐静脉细胞相似,端粒酶活性为阴性,见表1、2。
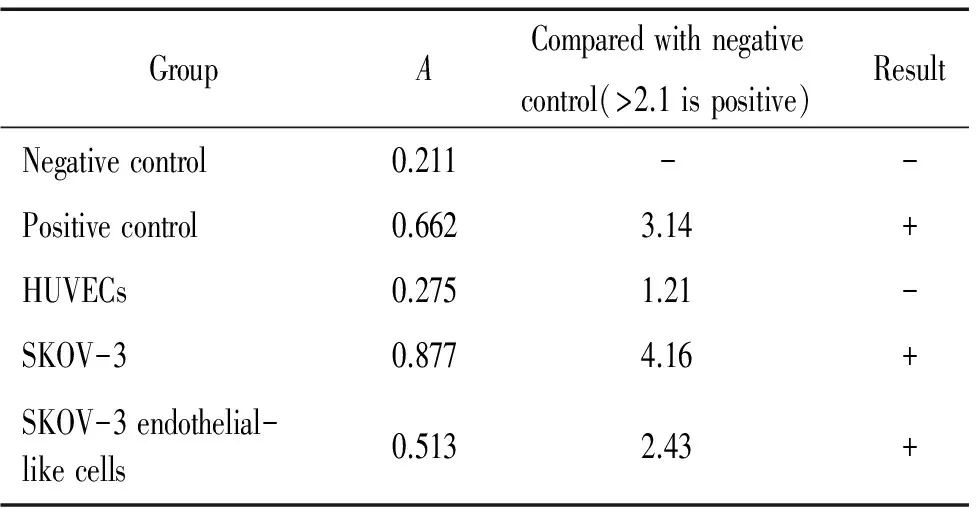
表1 SKOV-3及其内皮样细胞端粒酶活性的检测
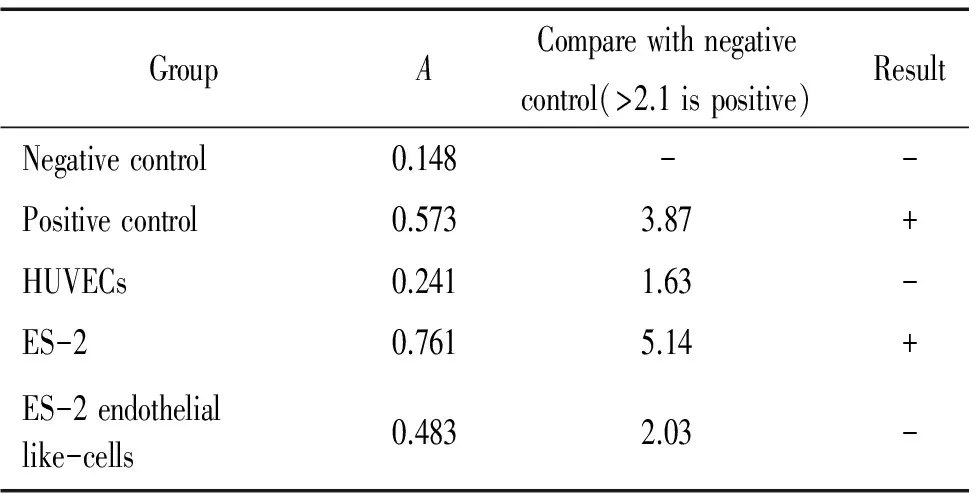
表2 ES-2及其内皮样细胞端粒酶活性的检测
2体外诱导形成肿瘤内皮样细胞的鉴定
本课题组前期实验结果已表明[1]:缺氧可以诱导卵巢癌细胞SKOV-3和ES-2转化为内皮样细胞,并形成腔样、管状、分支和网络状等拟态血管。SKOV-3内皮样细胞可表达Flk-1、AC133和vWF;细胞出现空泡样变,表面出现微绒毛样突起,极少数细胞出现质膜包裹的颗粒。ES-2内皮样细胞可以表达Flk-1和CD34;细胞出现空泡样变,表面出现微绒毛样突起,极少数细胞出现质膜包裹的颗粒;部分细胞局部胞浆出现Dil阳性细胞,具有吞噬acLDL功能。HUVECs的鉴定:vWF表达阳性,具有acLDL吞噬功能,胞内含Weibel-Palade小体。
3卵巢癌内皮样细胞及相关细胞cyclinD1、p53和v-srcmRNA的表达
缺氧诱导后SKOV-3内皮样细胞cyclin D1 mRNA的表达显著低于常氧时的表达(Plt;0.01);与HUVECs表达比较无显著差异(Pgt;0.05);p53 mRNA表达显著高于常氧时的表达(Plt;0.01),也显著高于HUVECs的表达(Plt;0.01);v-src mRNA的表达与常氧和HUVECs比较均无显著差别(Pgt;0.05),见图1。
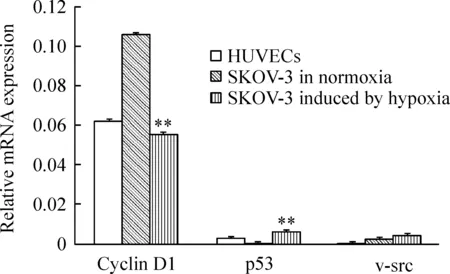
Figure 1.The expression of cyclin D1,p53 and v-src mRNA in SKOV-3 and SKOV-3 endothelial -like cells.Analysis of real-time RT-PCR at the 7th day revealed that hypoxia decreased the mRNA expression of cyclin D1 and increased the expression of p53 in SKOV-3 cells.No significant difference of v-src mRNA expression was observed under all conditions.±s.n=3.**Plt;0.01 vs SKOV-3 in normoxia.
缺氧诱导后ES-2内皮样细胞cyclin D1 mRNA的表达显著低于常氧时的表达(Plt;0.05);与HUVECs表达比较无显著差异(Pgt;0.05);p53 mRNA表达显著高于常氧时的表达(Plt;0.01),并显著高于HUVECs表达(Plt;0.01);v-src mRNA的表达与常氧和HUVECs比较均无显著差别(Pgt;0.05),见图2。
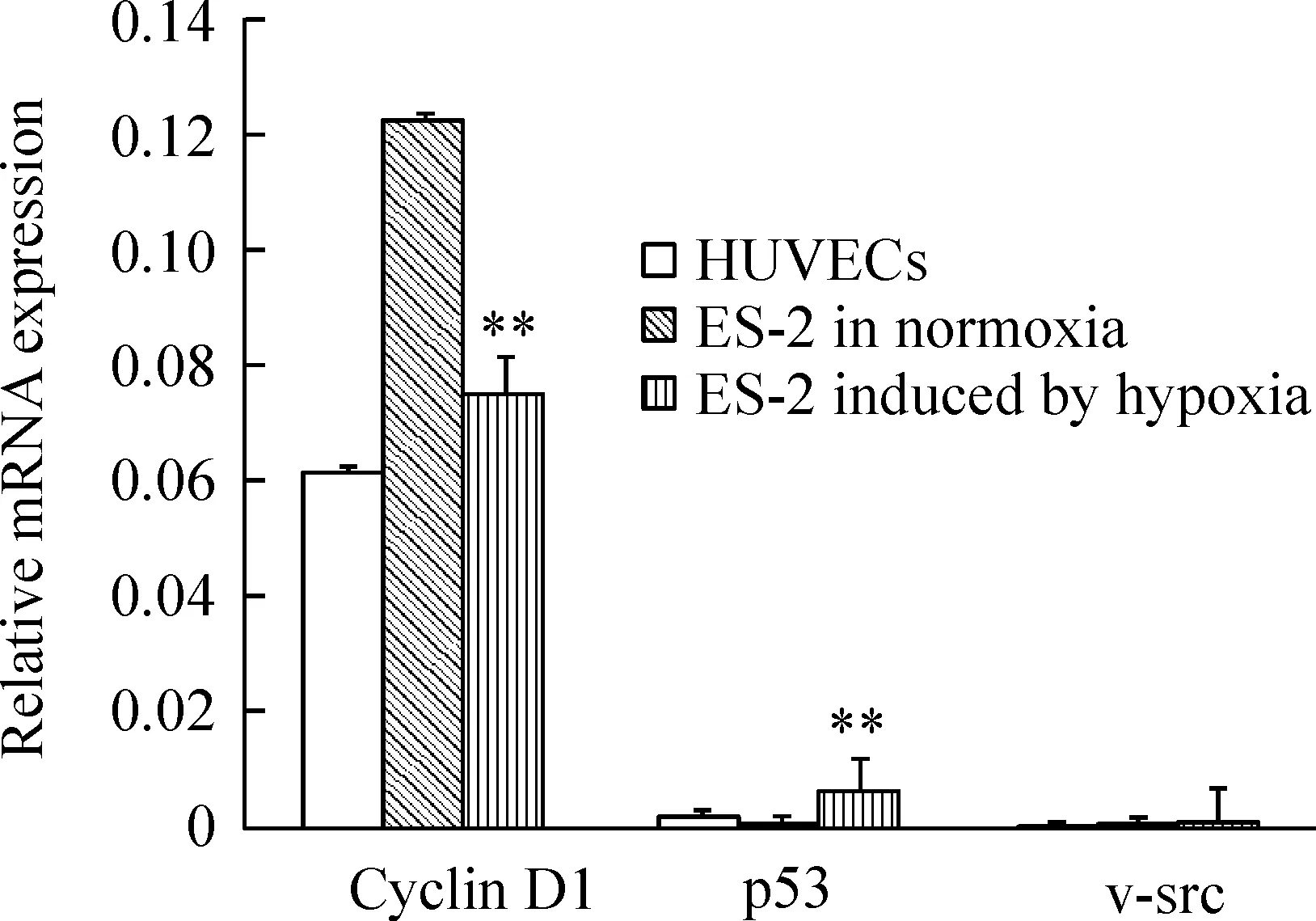
Figure 2.The expression of cyclin D1,p53 and v-src mRNA in ES-2 and ES-2 endothelials-like cells.Analysis of real-time RT-PCR at the 7th day revealed that hypoxia significantly decreased the mRNA expression of cyclin D1 and increased the expression of p53 in ES-2 cells.No significant difference of v-src mRNA expression was observed under all conditions±s.n=3.**Plt;0.01 vs ES-2 in normoxia.
讨 论
局部氧分压降低是几乎所有实体肿瘤的特征,肿瘤细胞团增至1 mm×1 mm×1 mm或更大时,中央缺氧,此时肿瘤对微环境缺氧存在自身调节和适应[3]。本课题组前期实验中,证实缺氧可影响SKOV-3和ES-2细胞增殖、细胞周期分布、凋亡及侵袭等生物学行为[2]。同时证明,缺氧可以将卵巢上皮性癌细胞SKOV-3和ES-2诱导分化为血管内皮样细胞,形成拟态血管,为肿瘤提供血供;恶性程度越高的肿瘤,形成拟态血管能力越强[1-3]。由于血管内皮细胞为非恶性肿瘤细胞,本文研究缺氧诱导部分卵巢癌细胞逆转分化前后细胞与正常血管内皮细胞在端粒酶、周期蛋白、癌基因及原癌基因的表达差异。
端粒酶的表达对于维持干细胞自我更新能力和复制潜能有重要意义;端粒的长度,使得肿瘤细胞不断增殖,以致永生化[4-7]。本文结果表明,SKOV-3在缺氧前后端粒酶活性表达均为阳性,端粒酶活性没有发生改变,此时SKOV-3内皮样细胞仍未完全分化为终末细胞,我们推测其可能还具有肿瘤干细胞(tumor stem cell,TSC)属性,有可能被进一步诱导[8]。ES-2在缺氧前端粒酶活性阳性,缺氧后ES-2内皮样细胞的端粒酶活性转为阴性,表明 ES-2内皮样细胞已丧失肿瘤细胞的增殖特性,同时也丧失了TSC的复制潜能,ES-2内皮样细胞已转化为具有特定功能与标记的终末细胞。
干细胞的特性是不断地增殖与分化,而其进行增殖分化的前提是进入细胞周期。干细胞周期调控与其它哺乳动物细胞一样,也是通过各种细胞周期蛋白和细胞周期蛋白依赖性激酶等相互作用来完成的。Cyclin D1合成是细胞接受外界信号刺激而进入细胞周期的最早期事件,它推动细胞进入S期,使细胞周期进入不依赖细胞外信号刺激的不可逆阶段[9-12]。本研究结果表明,缺氧后SKOV-3内皮样细胞和ES-2内皮样细胞cyclin D1表达显著下降,和HUVECs无显著差异。由此我们可以推论:缺氧诱导后的肿瘤细胞SKOV-3和ES-2受cyclin D1的调控减少,从而停滞在G期而增殖分化受阻,使其恶性程度降低。表明cyclin D1在调控卵巢癌细胞向内皮样细胞分化中具有重要的作用。
在肿瘤发生过程中,抑癌基因p53功能丧失是目前最常检测到的变化之一,其中卵巢癌中的突变率高达30%-79%。缺氧诱导因子-1能对野生型P53蛋白的降解起抑制作用,稳定P53使之水平升高,而对突变型P53无作用[13-16]。本研究结果表明,野生型p53在SKOV-3和ES-2细胞中表达极弱或丧失;经缺氧诱导后,在SKOV-3和ES-2内皮样细胞表达水平显著升高,也显著高于HUVECs表达。本结果提示,从抑癌基因p53表达的角度来看,缺氧通过上调抑癌基因p53的表达来使SKOV-3和ES-2原有的恶性肿瘤细胞属性降低或丧失。
v-src基因是一个促进细胞分化并参与其调节的癌基因[17],本研究结果显示,无论是缺氧前或后,SKOV-3和ES-2,或者它们的内皮样细胞均不能检测到v-src mRNA表达,提示v-src癌基因没有参与卵巢癌细胞SKOV-3或ES-2的发生与发展,没有参与缺氧诱导出现SKOV-3和ES-2内皮样细胞形成的过程。
缺氧是卵巢上皮性癌血管生成拟态的主要诱导因素之一。在缺氧状态下,正常内皮细胞增殖抑制,无法为肿瘤生长提供足够血供。而此时卵巢癌细胞干细胞潜能优先向血管内皮细胞发展,以满足其恶性发展的需要。根据本研究,我们推测:卵巢癌细胞向血管内皮样细胞分化表面上看其发生逆分化,恶性程度降低;但是从长远的发展,肿瘤血管的生成为肿瘤的生长提供了养分和转移的途径,增加了其危害性,因此,缺氧对上皮性卵巢癌生长发展具有双刃剑的作用。如何阻断其逆分化,针对逆分化后肿瘤内皮样细胞进行靶向治疗,有望为卵巢癌提供潜在的治疗靶点。
[1]Yao LQ,Feng YJ,Ding JX,et al.Characteristics and differentiated mechanism of vascular endothelial cells-like derived from epithelial ovarian cancer cells induced by hypoxia[J].Int J Oncol,2007,30(5):1069-1075.
[2]竺鹏飞,丰有吉,尧良清,等.缺氧激发卵巢癌上皮性肿瘤细胞中的干细胞向内皮样细胞分化[J].复旦学报(医学版),2010,37(4):418-421.
[3]Zhu PF,Ning YX,Yao LQ,et al.Apoptosis,invasion of epithelial ovarian cancer cells induced by hypoxia[J].J Exp Clin Canc Res,2010,29(5):124.
[4]Weljie AM,Jirik FR.Hypoxia-induced metabolic shifts in cancer cells: Moving beyond the Warburg effect[J].Int J Biochem Cell Biol,2010,Aug 24.[Epub ahead of print].
[5]Tsusumi M,Tsujiuchi T,Ishikawa O,et al.Increased telomerase activities in human pancreatic duct adenocarcinomas[J].JPN J Cancer Res,1997,88(10):971-976.
[6]苏园园,黄 瑾,季明芳,等.端粒酶活性联合CA125检测与预测卵巢上皮癌腹腔化疗疗效的关系[J].中国病理生理杂志,2006,22(8):1471-1474.
[7]Yang K,Zheng D,Deng X,et al.Lysophosphatidic acid activates telomerase in ovarian cancer cells through hypoxia-inducible factor-1alpha and the PI3K pathway[J].J Cell Biochem,2008,105(5):1194-1201.
[8]Taylor BA,Meng E,Shevde LA,et al.Telomerase activity in multiple successive generations of ovarian cancer stem cells[J].Gynecol Oncol,2009,112(2 Supp1 1):S120.
[9]Hu J,Handisides DR,Van Valckenborgh E,et al.Argeting the multiple myeloma hypoxic niche with TH-302,a hypoxia-activated prodrug[J].Blood,2010,116(9):1524-1527.
[10]Kim JK,Diehl JA.Nuclear cyclin D1: an oncogenic driver in human cancer[J].Cell Physiol,2009,220(2):292-296.
[11]Wu GQ,Xie D,Yang GF,et al.Cell cycle-related kinase supports ovarian carcinoma cell proliferation via regulation of cyclin D1 and is a predictor of outcome in patients with ovarian carcinoma[J].Int J Cancer,2009,125(11):2631-2642.
[12]Yang C,Chen L,Li C,et al.Cyclin D1 enhances the response to estrogen and progesterone by regulating progesterone receptor expression[J].Mol Cell Biol,2010,30(12):3111-3125.
[13]Crum CP,Xian W.Bringing the p53 signature into focus[J].Cancer,2010,116(22):5119-5121.
[14]Bernardini MQ,Baba T,Lee PS,et al.Expression signatures of TP53 mutations in serous ovarian cancer[J].BMC Cancer,2010,10:237.
[15]Anderson KS,Wong J,Vitonis A,et al.p53 autoantibodies as potential detection and prognostic biomarkers in serous ovarian cancer[J].Cancer Epidemiol Biomarkers Prev,2010,19(3):859-868.
[16]Palmer JE,Sant Cassia LJ,Irwin CJ,et al.P53 and bcl-2 assessment in serous ovarian carcinoma[J].Int J Gynecol Cancer,2008,18(2):241-248.
[17]Sugimura M,Kobayashi K,Sagae S,et al.Mutation of the SRC gene in endometrial carcinoma[J].Jpn J Cancer Res,2000,91(4):395-398.
Molecularmechanismofretrodifferentiationfromepithelialovariancancercellsinducedbyhypoxia
CHEN Mo1,YIN Xiao-jun2,YAO Liang-qing1,LI Na1,ZHU Peng-fei1,XU Cong-jian1
(1DepartmentofGynecology,ObstetricsandGynecologyHospital,FudanUniversity,Shanghai200001,China;2DepartmentofGynecology,TheSecondPeople’sHospitalofKunshanCity,Kunshan215300,China.E-mail:yaoliangqingcn@126.com)
AIM: To investigate the molecular mechanism of retrodifferentiation from epithelial ovarian cancer into vascular endothelial-like cells induced by hypoxia.METHODSThe three-dimensional culture system with Matrigel was established to culture SKOV-3 and ES-2 ovarian cancer cell lines under hypoxic condition (1% O2).Telomeric repeat amplification protocol (TRAP) and real-time RT-PCR were used to analyze the activity of telomerase and the mRNA expression of cyclin D1,p53 and v-src in endothelial-like cells differentiated from the microdissected tumors.The data were compared with those in original cancer cells and human umbilical vein endothelial cells (HUVECs).RESULTSThe activity of telomerase was positive in SKOV-3 and ES-2 cells under normoxic condition,and was positive in SKOV-3 endothelial-like cells but negative in ES-2 endothelial-like cells under hypoxic condition.The mRNA expression of cyclin D1 in SKOV-3 and ES-2 endothelial-like cells with hypoxia was significantly lower than that in the same cells with normoxia (Plt;0.01),but was not significantly different from that in HUVECs (Pgt;0.05).In SKOV-3 and ES-2 endothelial-like cells,the mRNA expression of p53 was higher with hypoxia than that with normoxia.No expression of v-src mRNA in all kinds of the cells under either hypoxic or normoxic condition was detected.CONCLUSIONHypoxia induces the differentiation of SKOV-3 and ES-2 cells into vascular endothelial-like cells by decreasing telomerase activity and cyclin D1 expression,and the increasing the mRNA expression of p53.
Ovarian neoplasms; Hypoxia; Vascular endothelial-like cells; Cell differentiation; Telomerase; Cyclin D1; Genes,p53; Genes,v-src
1000-4718(2011)05-0848-05
R737.31
A
10.3969/j.issn.1000-4718.2011.05.004
2011-01-31
2011-04-15
上海市科委自然科学基金资助项目(No.08ZR1401900);高等学校博士学科点专项科研基金资助项目(No.20070246020)
△通讯作者 Tel:021-63450944;E-mail:yaoliangqingcn@126.com
