重组木聚糖酶的安全高效表达与应用研究
2011-11-10暴立娟宋庆凤
暴立娟,宋庆凤,李 杰
(东北农业大学生命科学学院,黑龙江哈尔滨150030)
重组木聚糖酶的安全高效表达与应用研究
暴立娟,宋庆凤,李 杰*
(东北农业大学生命科学学院,黑龙江哈尔滨150030)
以pPIC9为载体能够实现里氏木霉木聚糖酶基因(xyn2)在巴斯德毕赤酵母(Pichia pastoris)中的高效表达,但是却需要甲醇诱导,从而限制其在食品加工等领域的应用。本研究以毕赤酵母组成型启动子——GAP启动子替换pPIC9上的甲醇诱导型启动子AOX,成功地表达了木聚糖酶。在此基础上以经密码子优化后的INU信号肽替换载体上原有的α-Factor信号肽,同时根据已发表的基因序列和AOX1基因的氨基酸序列,按照毕赤酵母的酵母偏爱密码子,对毕赤酵母表达载体pPIC9上的α信号肽序列进行改造,结果表明,两种信号肽均能够引导木聚糖酶的分泌。通过添加0.01%的Triton,可以有效增强细胞膜的通透性,提高外源蛋白的分泌能力。薄层层析结果表明,木聚糖酶的酶解产物为木二糖和木三糖为主的低聚木糖及少量的木糖。
木聚糖酶,GAP启动子,INU信号肽,α信号肽,低聚木糖
木聚糖是主要由吡喃木糖通过β-1,4-糖苷键连接而成的多聚糖,是半纤维素的主要成分,广泛存在于植物细胞壁中,是自然界中含量仅次于纤维素的可再生资源[1]。木聚糖酶(1,4-β-D-xylan xylanohydrlase,EC 3.2.1.8)通过内切方式水解木聚糖分子中的β-1,4-木糖苷键,水解产物以木二糖和木三糖为主,以及少量的木糖和阿拉伯糖[2]。木聚糖酶在食品、造纸、饲料等领域都有广泛的应用。目前,低聚木糖主要通过酶法降解木聚糖制备。筛选和制备高活性和高底物特异性的木聚糖酶组分,以获得二糖、三糖比例高,单糖比例低的水解产物是生产低聚木糖的技术关键。传统的方法是通过菌种筛选和发酵控制获得高木聚糖内切酶活性、低木糖苷酶活性的木聚糖酶,但此法酶活性低、发酵工艺不稳定。利用毕赤酵母表达里氏木霉的木聚糖内切酶,发酵生产只有内切酶活性而没有糖苷酶活性的木聚糖酶,用于生产低聚木糖,能够达到简化产酶工艺、提高产物纯度和产量的目的。本实验室前期构建的pPIC9-xyn2表达载体能够有效地表达xyn2基因,但AOX1启动子仍不太恰当、方便,使AOX1启动子应用受限。本研究从启动子和信号肽的替换入手,构建新型毕赤酵母分泌表达载体,获得安全高效分泌表达木聚糖酶基因的工程菌。通过添加Triton等非离子表面活性剂增加膜的通透性,提高外源蛋白的分泌能力[3],以期获得更高的表达量,进一步对重组木聚糖酶的水解产物进行分析,探讨应用其生产低聚木糖的可行性,以期为低聚木糖的生产探索新的方法。
1 材料与方法
1.1 实验材料
毕赤酵母菌株 GS115、大肠杆菌菌株 E.coli DH5α、质粒pPIC9-xyn2、T-GAP、pT-αM、pGAPHa均由本研究室保存;pMD18-T载体、T4DNA连接酶、Pyrobest Taq酶、限制性内切酶 均购自大连宝(TaKaRa)生物工程公司;DNA胶回收试剂盒 购自北京百泰克生物技术有限公司;其它试剂 均为国产分析纯;YPD、MD培养基 见 Invitrogen公司Pichia Expression Kit提供的说明书。
1.2 实验方法
1.2.1 菊粉酶基因信号肽INU的密码子优化 参照文献[4],根据毕赤酵母密码子用法表[5],优化菊粉酶信号肽序列INU并设计合成接头。经密码子改造后的接头序列如下:

1.2.2 毕赤酵母表达载体的构建 质粒DNA提取、电泳、酶切、大肠杆菌感受态制备、转化等操作参见《分子克隆实验指南》(第三版)[6],表达载体转化子的鉴定通过菌落PCR和酶切的方法进行。
1.2.2.1 毕赤酵母表达载体pGAPHα-xyn2的构建毕赤酵母表达载体pGAPHα-xyn2的构建过程如图1所示。以 BamHI、EcoT221双酶切 pPIC9-xyn2和T-GAP载体,分别回收约 8000bp的大片段和约500bp的GAP启动子片段,连接,转化,构建成毕赤酵母表达载体pGAPHα-xyn2。

图1 毕赤酵母表达载体pGAPHα-xyn2的构建
1.2.2.2 毕赤酵母表达载体pGAPHINU-xyn2的构建
毕赤酵母表达载体pGAPHINU-xyn2的构建过程如图2所示。以BamHI、SnaBI双酶切 pGAPHαxyn2,回收约8000bp的大片段,与经密码子优化的菊粉酶基因信号肽INU连接,构建成毕赤酵母表达载体pGAPHINU-xyn2。
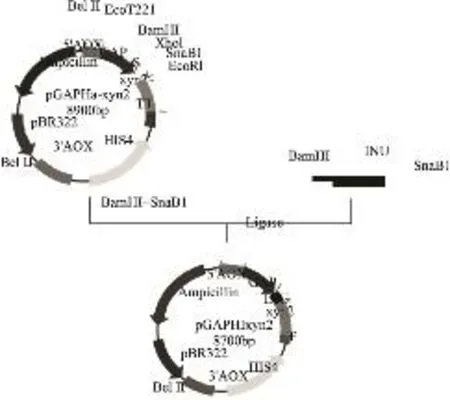
图2 毕赤酵母表达载体pGAPHINU-xyn2的构建
1.2.2.3 毕赤酵母表达载体pGAPHαM-xyn2的构建
毕赤酵母表达载体pGAPHαM-xyn2的构建如图3所示。BamHI、XolI双酶切pGAPHα,BglⅡ、XolI双酶切T-αM,分别回收约8000bp和300bp的片段,连接,转化大肠杆菌,构建中间表达载体pGAPHaM,然后用EcoRl和Notl分别酶切pGAPHaM和pGAPHaxyn2,回收目的片段,连接,转化,构建成表达载体pGAPHaM-xyn2。
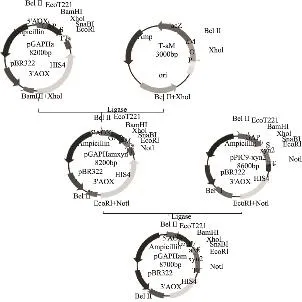
图3 毕赤酵母表达载体pGAPHαM-xyn2的构建
1.2.3 毕赤酵母的转化 参照Invitrogen公司Pichia Expression Kit提供的说明书(P59),采用电击法转化毕赤酵母。
1.2.4 木聚糖酶活性的测定 用YPD培养基培养酵母72h后,4000r/min离心5min,取上清DNS法[6]测定木聚糖酶活性。
酶活单位定义:在设定的温度及pH条件下,1min从底物溶液中分解产生1μmol还原糖(表示为还原糖当量)所需要的酶量为一个酶活单位,简称IU。
1.2.5 Triton的添加 挑取单菌落用YPD培养基振荡培养24h后添加Triton,使其终浓度为0.01%,培养72h后,4000r/min离心5min,取上清DNS法测酶活。
1.2.6 木聚糖酶酶解产物的分析 采用薄层层析法。1.5mL 5%的木聚糖与同体积的木聚糖酶在50℃水浴中反应10min,5000r/min离心4min,上清在50℃烘箱中浓缩至体积约为200μL,用微量进样器吸取约0.2μL上清液,点样于0.25mm厚的硅胶板上,上行法展开后,喷显色剂,将薄层层析板置于105℃的烘箱中烘10min显色。展开剂为正丁醇∶冰醋酸∶水(体积比为2∶1∶1),显色剂为苯胺-邻苯二甲酸(苯胺0.93g、邻苯二甲酸1.66g,溶于水饱和的正丁醇100mL中)。
2 结果与分析
2.1 毕赤酵母表达载体pGAPHα-xyn2的构建
将pGAPHα-xyn2的质粒用BamHI、EcoT221双酶切,切出来约8100、500bp的片段,如图4所示,表明载体构建成功。
2.2 毕赤酵母表达载体pGAPHINU-xyn2的构建
将pGAPHINU-xyn2和pGAPHa-xyn2的质粒分别用BamH1和Notl双酶切,分别酶切出8000、650bp和8000、950bp的两对片段,如图5所示,载体构建成功。
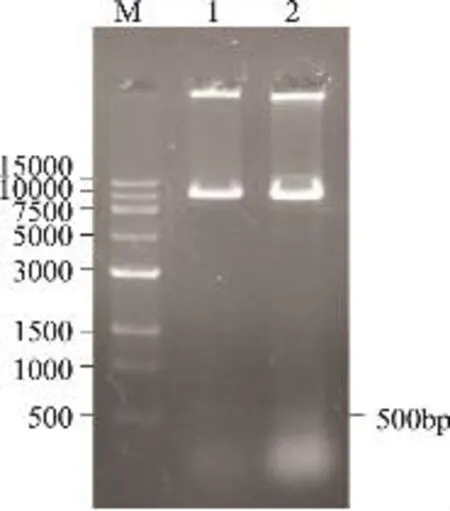
图4 pGAPHα-xyn2双酶切鉴定
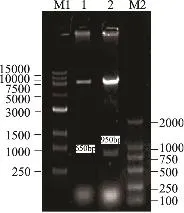
图5 pGAPHINU-xyn2双酶切鉴定
2.3 毕赤酵母表达载体pGAPHαM-xyn2的构建
中间表达载体pGAPHaM的鉴定如图6所示,因BamHI和BglⅡ属同尾酶,连接后无酶切位点,采用PCR的方法鉴定,上游引物为GAP启动子的下游引物,下游引物为木聚糖酶基因的上游引物,可清晰地看见870bp的片段,表明载体构建成功。将pGAPHaxyn2的质粒用BamHI和Notl双酶切,酶切成8300bp和570bp的两个片段,如图7所示,载体构建成功。

图6 pGAPHaM的PCR鉴定
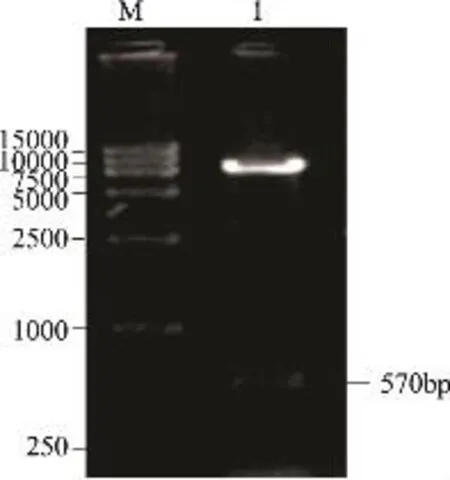
图7 pGAPHαM-xyn2双酶切鉴定
2.4 表达载体的转化及酶活性鉴定
用BglⅡ酶切不同的表达载体,使质粒线性化,电击法转化毕赤酵母GS115,筛选转化子。将转化子在YPD培养基中振荡培养72h,离心取上清液,测定木聚糖酶活性,以毕赤酵母诱导型表达载体pPIC9-xyn2为对照,实验结果见表1。
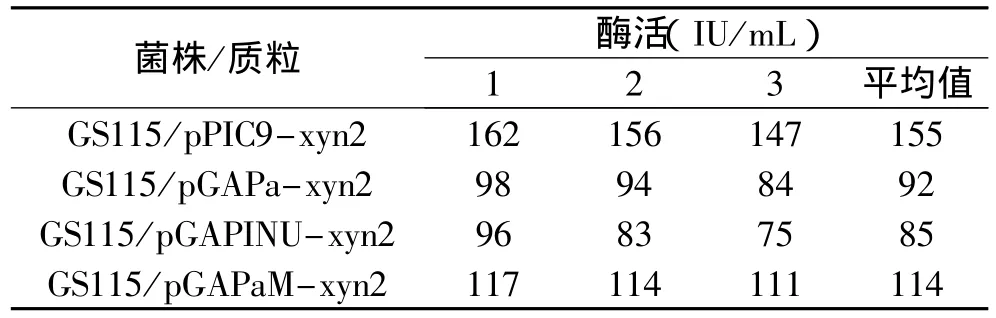
表1 不同表达载体表达xyn2的酶活性
2.5 添加Triton的影响
结果见表2。

表2 添加Triton的影响
2.6 酶解产物分析
如图8所示,木聚糖酶的酶解产物为以木二糖和木三糖为主的低聚木糖,以及少量的木糖。
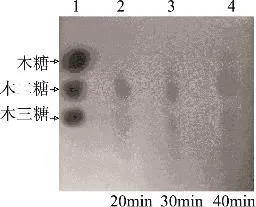
图8 酶解产物分析
3 讨论
启动子在基因表达过程中具有很重要的作用,本文用GAP启动子替换pPIC9-xyn2上的AOX启动子,构建组成型表达载体pGAPHα-xyn2。在生产和应用过程中无需甲醇诱导,大大增加了安全性。同时,转化过程中无抗生素基因被引入,也增加了安全性。尽管在本实验中与AOX启动子相比,GAP启动子调控的xyn2基因表达水平稍低,但是在安全性方面的优势使其有望在食品等领域得到广泛应用。
重组蛋白的分泌表达对于提高表达量和产品的纯化都是有利的,在毕赤酵母中,信号肽对不同的异源蛋白分泌效率有很大的差异[8]。不同的信号肽对木聚糖酶的引导能力有所不同,其中以改造后的α信号肽最强,比原来的信号强增强了约24%,优化的INU信号肽虽然不如α信号肽强,但在毕赤酵母中也能有效引导外源蛋白的分泌。
对于液体摇瓶培养来说,在培养基中添加某些表面活性剂可能会提高酶的产量。表面活性剂所起的作用可能是改变细胞膜的通透性,并提高氧在气液界面的传递速度[9]。实验表明,添加一定量的Triton,可以有效提高细胞分泌外源蛋白的能力,使酶活显著提高。
重组木聚糖酶的酶解产物主要为木二糖和木三糖,仅有少量的木糖,可用于低聚木糖的生产。
[1]Techapun C,Poosaran N,Watanabe M,et al.Thermostable and alkaline-tolerant microbial cellulose-free xylanases produced from agricultural wastes and the properties required for use in pulp bleaching bioprocesses:a review[J].Process Biochem,2003,38:1327-1340.
[2]Neeta K,Abhay S,Mala R.Molecular and biotechnological aspects of xylanases[J].FEMS Microbiology Reviews,1999,23:411-456.
[3]Pingzuo Li,Anukanth Anumanthan,Xiu-GongGao. Expression of Recombinant Proteins in Pichia Pastoris[J].Appl Biochem Biotechnol,2007,142:105-124.
[4]Bong Hyun Chung,Soo Wan Nam.Biotechnol Bioeng[M]. 1996:47-479.
[5]Da Teng,Ying Fan,Ya-lin Yang.Codon optimization of Bacillus licheniformis β-1,3-1,4-glu-canase gene and its expression in Pichia pastoris[J].Appl Microbiol Biotechnol,2007,74:1074-1083.
[6]萨姆布鲁克,等.分子克隆实验指南[M].第三版.北京:科学出版社,2002:14-138.
[7]Ghose TK.Measurement of cellulase activities[J].Pure and Appl Chem,1987,59(2):257-268.
[8]张树军,杨磊,黄瑾.信号肽序列在酵母分泌表达系统中的应用[J].医学综述,2007,13(9):643-645.
[9]蔡敬民,于宙,张洁,等.曲霉木聚糖酶发酵条件与性质[J].生物学杂志,1996(2):14-16.
Study on high efficient and safe expression of recombinant xylanse and its application
BAO Li-juan,SONG Qing-feng,LI Jie*
(College of Life Science,Northeast Agricultural University,Harbin 150030,China)
Xylanase gene xyn2 from Trichoderma reesei can be expressed efficiently in Pichia pastoris by pPlC9 vector,but it is limited to applicate in food processing for inducing expressing by methanol.Xylanase was expressesed under the controled of GAP promoter instead of AOX promoter of pPlC9 vector.The optimized lNU signal peptide and modified α-Factor signal peptide according to the optimal condon of Pichia pastoris were used to replace the α-Factor signal peptide of pPlC9 vector.The result indicated that the two signal peptides can lead the secrete of xylanase.The secrete ability of foreign protein raised by the addition of 0.01%Triton which could strengthen the permeability of cellular membrance.Result of TLC showed that the enzymolysis product of xylan by the recombinant xylanase were xylobiose,xylotriose and little xylose.
xylanse;GAP promotor;lNU signal peptide;α signal peptide;xylan
Q784
A
1002-0306(2011)01-0156-04
2009-10-16 *通讯联系人
暴立娟(1980-),女,硕士,研究方向:分子遗传学与基因工程。
