氨水富液再生及再生液吸收特性的试验研究
2011-10-29方梦祥朱德臣项群扬骆仲泱
吕 忠, 方梦祥, 朱德臣, 项群扬, 汪 桢, 骆仲泱
(浙江大学 能源清洁利用国家重点实验室,杭州310027)
目前,由于燃烧化石燃料排放大量CO2导致的全球变暖问题已经引起了人们越来越多的关注.作为CO2的排放大户,燃煤电厂的CO2减排问题一直受到人们的关注.作为目前电厂烟气脱碳应用最广的方法,基于醇胺类吸收剂(以MEA为主)的化学吸收方法对于大型电厂而言依然过于昂贵[1].另外,醇胺类脱碳方法还存在许多问题,如循环过程中吸收效率不高、吸收容量低、吸收剂的氧化降解和对设备的腐蚀等[2-3].近年来,有学者[4-5]提出用氨水作为吸收剂脱除CO2.氨水作为吸收剂不仅具有廉价、吸收速率高、容量大、再生能耗低、不存在氧化和腐蚀等优点,而且有学者指出,氨水可以实现同时脱除烟气中的SOx和NOx等多种酸性污染物[6].
全球许多机构的研究者对氨法脱碳开展了研究,并取得了一定的进展[7-12].其中,在氨水富液再生方面,Yeh等人[7]首先在半连续试验台上进行了氨水吸收CO2后富液解析CO2的试验研究,通过加热氨水吸收CO2形成的富液,以及对再生后的再生液进行循环吸收,研究了循环过程中吸收剂吸收能力的变化以及加热再生的效果;同时,通过对碳酸氢铵、碳酸铵及其混合溶液的加热再生,研究了不同温度下氨法吸收CO2生成物的再生情况.Resnik等人[11]在填料塔中对氨水富CO2溶液进行加热再生试验,结果表明:随着再生温度从71.1℃升高到82.2℃,连续循环系统中CO2脱除效率提高,CO2担载能力增加,此后略有下降,而氨损失随温度升高呈线性增加.Corti等人[12]对再生塔中温度和压力进行了模拟,指出随着再生塔操作压力增大,再生塔出口氨逸出量减少,氨再生比例、CO2与氨分离率和CO2纯度均有所增加,但CO2解析效率有所下降.此外,国内研究者[13]也对氨法脱碳主要吸收产物碳酸氢铵溶液受热解析CO2的过程开展了试验研究,考察加热温度及溶液浓度对CO2解析过程的影响.但是总体来说,目前针对氨水富液再生方面的报道相对较少,对氨水富液再生过程中各种因素的影响尚缺乏进一步的深入研究.
为了更全面地了解氨水吸收CO2后富液的再生情况,笔者在常压60~90℃范围内对不同负荷的氨水富液(0.2~0.7 mol CO2/mol NH3)的再生情况进行了试验研究,考察温度及溶液负荷对氨水富液再生速率及最终再生程度的影响.此外,还研究了氨水富液再生前后脱碳能力的变化,考察了通过添加少量新鲜氨液来进一步恢复氨水再生液吸收能力的可行性.
1 试验装置与方法
1.1 反应机理
在氨水富液再生过程中,主要反应见式(1)~式(4)[7],其中式(1)是氨基甲酸盐的吸热水解过程,随着溶液温度的升高,反应向右进行;式(2)~式(4)则是富液中碳酸盐和碳酸氢盐受热分解的过程.同时,由于液相中的分压比气相中高及搅拌的影响,溶液中的部分NH3及水蒸气也会随着气流离开溶液.

其中,ΔH为反应热.
1.2 试验装置
试验系统如图1所示.吸收试验系统中,钢瓶中的纯N2、CO2经质量流量计控制流量后进入混气罐,混合均匀后经主路(旁路主要用于试验开始前清洗系统以及调整烟气分析仪)进入玻璃吸收反应器.混合烟气经吸收反应器吸收CO2后依次经过酸洗瓶(稀硫酸)和干燥瓶,分别脱除尾气中的NH 3和H2O,然后进入在线烟气分析仪,分析获得出口的CO2浓度.

图1 氨水吸收及富液解析CO2试验系统示意图Fig.1 Schematic of the experimental system for aqueous ammonia absorption and desorption
再生试验系统主要由油浴加热再生系统、酸洗净化系统以及收集系统三部分组成.试验中,首先将油浴锅加热到预定温度,然后向反应器中加入一定量预先制备好的一定负荷氨水富液,打开磁力搅拌器,开始试验.为防止再生产生的CO2与挥发的NH3重新反应后生成结晶堵塞管道,在反应器的气体出口段至酸洗瓶之间外加了电加热带保温,温度控制在120℃,以防止发生二次反应.再生气经酸洗瓶用浓硫酸吸收挥发的NH3并脱水后,剩余的纯CO2气体经流量计测量流量后进入排水集气装置统一收集.试验过程中定时从取样口取少量溶液分析液相负荷变化情况,并及时补充同样体积的新鲜氨水富液.试验完成后,读取排水集气装置最终收集的气体体积,并与流量计的积分结果和液相计算结果进行对比,若相互间误差≤10%,则说明试验准确.
1.3 试验方法
吸收试验中,试验条件为温度30℃,气体流量N2为0.7 L/min,CO2为95 mL/min(控制混合气体中CO2浓度为12%),吸收液质量为120 g.采用CO2的吸收速率ξi来反映溶液的吸收性能,其计算公式如下:
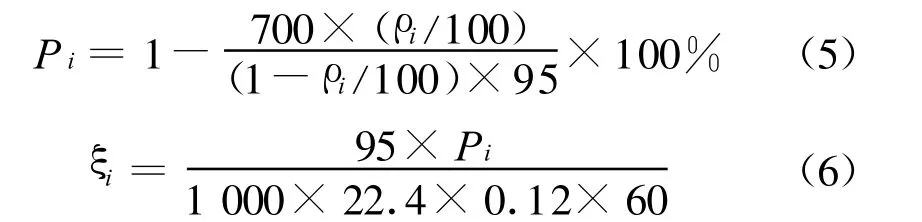
式中:脱除率P代表吸收前后CO2的减少情况;i代表时间,min.
氨水富液再生试验中,氨水的初始浓度均为8%,试验条件为常压,搅拌转速为400 r/min,采用的变量为不同的再生温度(60℃、70℃、80℃和90℃)及不同的富液负荷(0.2~0.7 mol CO2/mol NH3).采用CO2的再生速率以及再生程度来反映富液的再生特性.其计算公式分别见式(7)和式(8).
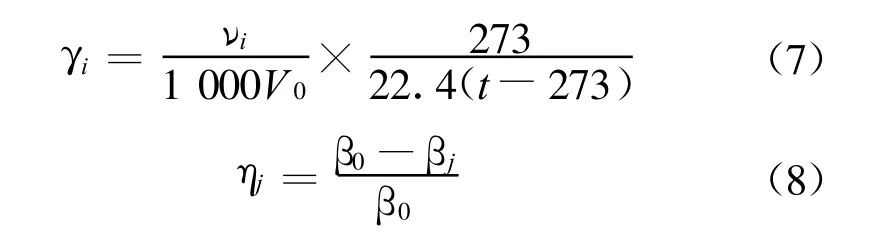
式中:γi为CO2的再生速率,mol/(L·s);ηi为CO2的再生程度;νi为经流量计测得的CO2的流量,mL/min;βj为由滴定法测定的溶液负荷,mol CO2/mol NH3;i代表时间,min;j代表取样的次数;t代表环境温度,℃;V0为溶液体积,L;β0为溶液初始负荷,mol CO2/mol NH 3.
2 结果与分析
2.1 氨水富液再生CO2的典型反应过程
图2所示为氨水富液再生CO2的典型反应过程.试验采用500 g初始氨水,浓度为8%,负荷为0.6 mol CO2/mol NH3的氨水富液在常压、油浴80℃和搅拌转速400 r/min条件下再生.从图中可以看出,在试验开始阶段,由于反应器内部的温度较低,CO2的再生速率也非常低.随着试验的进行,反应器内部的温度开始升高,CO2的再生速率也开始迅速上升,在到达最高值后开始缓慢下降.在70 min的时候,CO2的再生速率已基本为零,再生过程结束.富液中CO2的再生程度也显示出同样的变化过程,在经历缓慢上升到快速上升再到逐步稳定3个阶段后,CO2的再生程度最终保持在一定的水平.
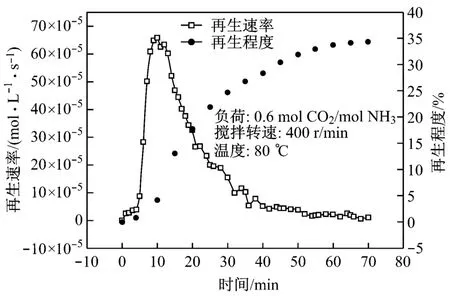
图2 氨水富液再生CO2的典型反应历程Fig.2 Typical reaction process of regeneration of CO2-rich ammonia solution
2.2 温度对氨水富液再生CO2的影响
图3和图4分别给出了温度对氨水富液再生速率以及再生程度的影响.试验条件为常压、搅拌转速400 r/min,选取500 g负荷为0.6 mol CO2/mol NH3的氨水富液分别在温度为60℃、70℃、80℃和90℃条件下再生.从图4可以看到,在较低温度下(60℃),氨水富液的再生非常困难,再生速率小于1.5×10-5mol/(L·s),而且在20 min后就基本降为零.这说明,虽然氨水吸收CO2后的主要产物之一碳酸氢铵非常不稳定,在常温下即会部分分解[5],但是由于氨水吸收CO2后另外一种产物碳酸铵相对比较稳定[5]以及热力学因素的影响,氨水富液在较低温度下的再生情况并不理想.随着再生温度的升高,反应式向右移动,CO2的再生速率明显加快.这表现为:一方面更快地形成了更高的再生速率峰值;另一方面,整个再生过程中的平均再生速率也 由70℃时的5.74×10-5mol/(L·s)上 升到80℃时的16.39×10-5mol/(L·s)和90℃时的26.45×10-5mol/(L·s).温度对最终再生程度的影响可以从图4中看出.在较低温度下,富液的再生程度非常低,60℃和70℃时最终再生程度分别只有2.03%和11.37%.随着温度的升高,在80℃和90℃时,再生程度分别提高到34.42%和80.1%.可见,提高温度对提高氨水富液的再生速率和再生程度都非常有效.但是随着温度的升高,再生过程中氨的挥发量也将增加[11],在实际应用中这必将降低再生后再生液的吸收性能以及增加下一环节喷水除氨的工作量.因此,最终再生温度应综合衡量各种因素后再做选择.
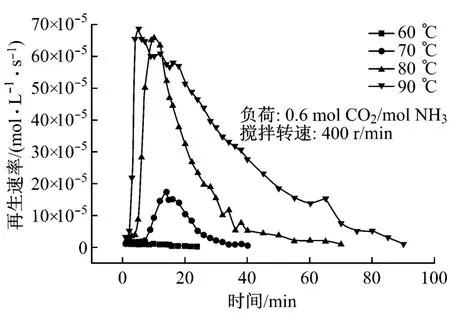
图3 温度对再生速率的影响Fig.3 Influence of temperature on regeneration rate
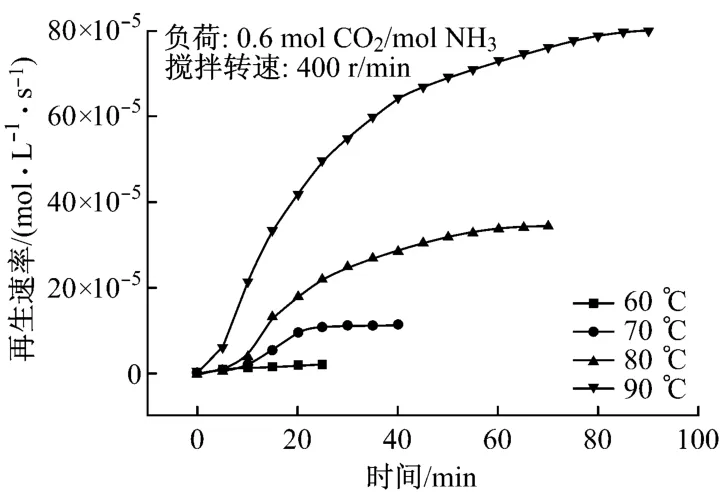
图4 温度对再生程度的影响Fig.4 Influence of temperature on regeneration degree
2.3 负荷对氨水富液再生CO2的影响
图5和图6给出了富液负荷对富液再生过程中再生速率和再生程度的影响.氨水吸收CO2后的主要产物是碳酸盐(NH 4)2CO3和碳酸氢盐NH4HCO3[2],在负荷较低时,溶液中主要形成的是碳酸盐;随着负荷的提高,碳酸盐进一步吸收CO2转化为碳酸氢盐.从图中可以看出,在溶液处于较低负荷(0.2和0.4 mol CO2/mol NH3)时,由于富液中生成的主要是比较难分解的碳酸盐,再生过程中发生的主要是式(4)中的反应,需要耗费较多的能量,导致溶液的再生速率以及再生程度都非常低.负荷为0.2和0.4 mol CO2/mol NH3的富液,其平均再生速率分别为0.8×10-5mol/(L·s)和1.82×10-5mol/(L·s),最终的再生程度也分别只有5.99%和6.33%.而随着溶液负荷的提高,富液中易分解的碳酸氢盐的比例上升,耗能较少的式(2)的反应更容易发生,溶液的再生能力也逐渐提高.负荷为0.5 mol CO2/mol NH3时,溶液平均再生速率为9.35×10-5mol/(L·s),最终再生程度达到21.1%,比负荷为0.4 mol CO2/mol NH3时高出233%.因此负荷0.4 mol CO2/mol NH3可视为氨水富液再生难易的一个“转折点”:当负荷小于0.4 mol CO2/mol NH3时,富液的再生较困难;而当负荷大于0.4 mol CO2/mol NH3时,再生开始变得相对容易.试验中,当负荷分别提高到0.6 mol CO2/mol NH3和0.7 mol CO2/mol NH3时,溶液的平均再生速率分别达到16.39×10-5mol/(L·s)和25.43×10-5mol/(L·s),最终的再生程度也分别达到34.42%和46.6%.图7给出了富液最终再生程度随负荷增长的变化情况.从图中可以明显看出负荷0.4 mol CO2/mol NH3的“转折点”作用,当负荷小于0.4 mol CO2/mol NH3时,增加负荷,富液的最终再生程度基本不发生变化;负荷大于0.4 mol CO2/mol NH3后,最终再生程度随负荷的增加呈线性增长.因此,在实际工程中采用氨水作为吸收剂循环使用时,建议保持氨水贫液负荷在0.4 mol CO2/mol NH3左右,使再生过程中更多地发生反应(2),达到降低能耗的效果.
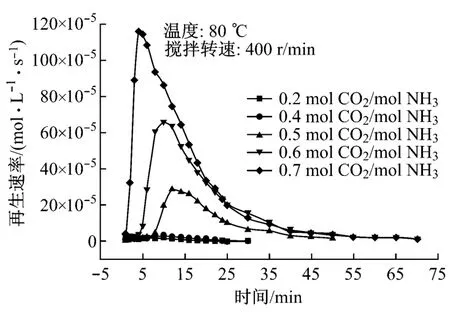
图5 富液负荷对再生速率的影响Fig.5 Influence of load of the CO2-rich solution on regeneration rate

图6 富液负荷对再生程度的影响Fig.6 Influence of load of the CO2-rich solution on regeneration degree

图7 负荷对最终再生程度的影响Fig.7 Influence of load on ultimate regeneration degree
2.4 再生后再生液的吸收性能
图8给出了氨水富液再生后再生液吸收性能研究的结果.试验中使用的富液负荷为0.6 mol CO2/mol NH3,再生液则是由负荷为0.6 mol CO2/mol NH3的富液在常压、80℃和400 r/min的条件下再生30 min后得到的,经测定,再生液的负荷为0.4 mol CO2/mol NH 3.从图8中可以看出,负荷为0.6 mol CO2/mol NH3的氨水富液已经基本丧失了脱碳能力,其初始最高吸收速率仅为同浓度下新鲜氨水的6.44%.经过30 min的再生后,溶液负荷由0.6 mol CO2/mol NH3降至0.4 mol CO2/mol NH3,脱碳能力得到一定的恢复,负荷为0.4 mol CO2/mol NH 3的再生液的初始最高脱碳速率为35.88×10-5mol/(L·s),相当于8%新鲜氨水的67.5%.但是由于再生不彻底和再生过程中氨的挥发损失,再生液的吸收性能并没有得到完全恢复,与新鲜氨水相比,不仅吸收速率较低而且下降更快.为了改善再生液的吸收性能,在再生液中添加少量新鲜氨水,研究其对再生液吸收性能的改善情况.从图8中可以看出,在再生液中添加1%的新鲜氨水后,虽然再生液的初始最高吸收速率并没有发生太大的改变,但是吸收速率的下降速度变缓,60 min内的平均吸收速率提高了21.3%.在添加了3%的新鲜氨液后,不仅再生液的初始最高脱碳速率达到新鲜氨水的94.83%,而且60 min内的平均吸收速率较再生液提高了84.95%,为新鲜氨水的72.9%,吸收性能有了非常明显的改善.因此,在实际运行中,利用新鲜氨水优异的吸收性能,通过在贫液中添加少量新鲜氨水来补充吸收及再生过程中氨的挥发,达到恢复脱碳能力的方法是可行的.
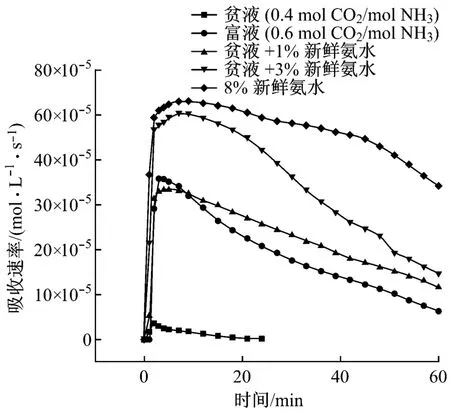
图8 再生后再生液的吸收性能及其改善Fig.8 Absorption performance and improvement of the regenerative solution after regeneration
3 结 论
(1)氨水富液加热再生时,CO2的再生速率和再生程度受温度控制,并随着温度的上升而上升.在60℃和70℃的,富液的再生速率较低,再生程度亦低于11%;在80℃和90℃时,再生程度分别提高到34.42%和80.1%.但是在提高再生温度的同时需要考虑,再生过程中氨的挥发也会随着温度的上升而增加.
(2)负荷对氨水富液的再生有很大影响.在试验条件下,当负荷低于0.4 mol CO2/mol NH3时,增大负荷,富液的再生程度基本不发生变化,都维持在6%左右;当负荷高于0.4 mol CO2/mol NH3时,富液的再生程度随负荷的上升呈线性上升.
(3)负荷为0.6 mol CO2/mol NH3的氨水富液已经基本丧失了脱碳能力,通过加热再生后,再生液吸收性能有了很大程度的恢复.在再生液中添加少量的新鲜氨水能很好地改善再生液的吸收性能.
(4)综合富液再生与再生液吸收的两方面因素考虑,推荐在氨水循环脱碳过程中负荷变化范围为富液0.6 mol CO2/mol NH3,贫液0.4 mol CO2/mol NH3.同时,可通过在贫液中添加少量新鲜氨水的方法来补充吸收及再生过程中氨的挥发损失,达到恢复脱碳能力的目的.
[1] YEH J T,PENNLINE H W,RESNIK K P.Study of CO2absorption and desorption in a packed column[J].Energy Fuel,2001,15(2):274-278.
[2] 项菲,施耀,李伟.混合有机胺吸收烟道气中CO2的实验研究[J].环境污染与防治,2003,25(4):206-225.XIANG Fei,SHI Yao,LI Wei.Study on absorption of CO2into aqueous blends of DETA/TETA and MDEA[J].Environmental Pollution and Control,2003,25(4):206-225
[3] HUANG H P,CHANG S G.Method to regenerate ammonia for the capture of carbon dioxide[J].Energy Fuels,2002,16(4):904-910.
[4] BAI Hsunling,YEH A C.Removal of CO2greenhouse gas by ammonia scrubbing[J].Ind Eng Chem Res,1997,36(6):2490-2493.
[5] YEH A C,BAI Hsunling.Comparison of ammonia and monoethanolamine solvents to reduce CO2greenhouse gas emissions[J].The Science of the Total Environment,2008,228(2):121-133.
[6] RESNIK K P,YEH J T,PENNLINE H W.Aqua ammonia process for simultaneous removal of CO2,SOx,NOx[J].Int J Environmental Technology and Management,2004,4(1/2):89-103.
[7] YEH J T,RESNIK K P,PYGLE K,et al.Semibatch absorbtion and regeneration studies for CO2capture by aqueous ammonia[J].Fuel Processing Technology,2005,86(14/15):1533-1546.
[8] KIM Y J,YOU JK,HONG W H,et al.Characteristics of CO2absorption into aqueous ammonia[J].Sep Sci Technol,2008,43(4):766-777.
[9] 董建勋,张悦,张昀,等.用氨水作为吸收剂脱除燃煤烟气中CO2的实验研究[J].动力工程,2007,27(3):438-440. DONG Jianxun,ZHANG Yue,ZHANG Yun,et al.Experimental study on absorption of CO2in flue gas by hydros ammonia[J].Journal of Power Engineering,2007,27(3):438-440.
[10] DIAO Y F,ZHENG X Y,HE B S,et al.Experimental study on capturing CO2greenhouse gas by ammonia scrubbing[J].Energy Conv Manag,2004,45(13/14):2283-2296.
[11] RESNIK K P,GA RBER W,HREHA D C,etal.A parametric scan for regenerative ammonia-based scrubbing for the capture of CO2[C]//Proceedings of 23rd Annual International Pittsburgh Coal Conference.Pittsburgh,2006.
[12] CORTI Andrea,LOMBARDI Lidia.Reduction of carbon dioxideemissions from SCGT/CC by ammonia solution absorption——preliminary results[J].Int J Thermodynamics,2004,7(4):173-181.
[13] 刘芳,王淑娟,张曦,等.碳酸氢铵溶液解吸二氧化碳研究[J].环境科学学报,2009,29(9):1886-1890. LIU Fang,WANG Shujuan,ZHANG Xi,et al.Study on ammonium bicarbonatedecom position on after CO2separation by ammonia method[J].Acta Scientiae Circumstantiae,2009,29(9):1886-1890.
