复方丹参注射液抗脂多糖诱导的兔弥漫性血管内凝血*
2011-10-24祈洁珍邱鹏新陈家树
林 熙, 祈洁珍, 邱鹏新, 陈家树△
(1暨南大学医学院医学药理学系, 广东 广州 510632;2中山大学中山医学院药理教研室, 广东 广州 510080)
复方丹参注射液抗脂多糖诱导的兔弥漫性血管内凝血*
林 熙1, 祈洁珍2, 邱鹏新2, 陈家树2△
(1暨南大学医学院医学药理学系, 广东 广州 510632;2中山大学中山医学院药理教研室, 广东 广州 510080)
目的研究复方丹参注射液对脂多糖(LPS)诱导的兔弥漫性血管内凝血(DIC)的作用。方法用LPS诱导兔DIC模型。凝固法测定纤维蛋白原含量,全自动凝血分析仪检测活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)和纤维蛋白原含量;全自动血细胞分析仪进行血小板计数;全自动血浆分析仪测定谷丙转氨酶(ALT)以及血尿素氮(BUN);发色底物法测定蛋白C及抗凝血酶Ⅲ的活性。观察复方丹参注射液对LPS诱导的兔DIC的拮抗作用。结果兔耳缘静脉持续滴注LPS,观察到:APTT和PT显著延长;血小板计数和纤维蛋白原含量明显减少;ALT和BUN显著升高;蛋白C和抗凝血酶Ⅲ的活性明显降低。给予复方丹参注射液后,APTT和PT的延长明显缩短;血小板计数和纤维蛋白原的含量均明显恢复;ALT和BUN显著下降;蛋白C及抗凝血酶Ⅲ的活性显著改善。结论复方丹参注射液对LPS诱导的兔DIC有良好的拮抗作用。
复方丹参注射液; 肝素; 脂多糖类; 纤维蛋白原; 血小板
弥漫性血管内凝血(disseminated intravascular coagulation, DIC)是一种由不同原因引起的,以全身性血管内凝血系统激活为特征的获得性综合征。这种改变可致微血管系统的损害,引起全身弥漫性微血栓的产生,严重时可导致器官功能衰竭[1]。目前临床上治疗DIC的手段主要是抗凝治疗-其代表药物为肝素。但应用肝素治疗时,其副作用明显,出血反应较大,需要进行实验室监测。因而国内外学者在治疗DIC方面进行了大量的实验研究,但仍未达到十分满意的效果。
复方丹参注射液由丹参(Salviamiltiorrhiza)和降香(Dalbergiaodorifera)组成,具有活血化瘀、改善微循环和抗凝的作用,能有效预防血栓形成。丹参在大鼠颈动脉血栓模型中可显著抑制血栓形成[2];在实验性大鼠脑梗塞模型中,可改善纤溶系统,抑制脑血栓形成[3,4];在体外可抑制血小板聚集,抑制血小板释放[5]。以上证据表明丹参对凝血系统有很强的抑制作用。同时在本课题组前期研究中发现,复方丹参注射液可抑制脂多糖(lipopolysaccharide,LPS)诱导的肾微血栓[6]。以上结果强烈提示复方丹参注射液可能可以有效地对抗DIC。为进一步探讨复方丹参注射液对DIC的拮抗作用,本课题组采用LPS诱导的DIC家兔模型,观察复方丹参注射液对LPS诱导的兔DIC凝血、抗凝系统的影响以及对器官的保护作用,为临床应用复方丹参注射液预防DIC提供实验依据。
材 料 和 方 法
1材料
1.1动物 健康雄性新西兰家兔60只,体重2.0-2.5 kg,由广东省医学实验动物中心提供,粤检证字[SCXK(粤)2008-0002]。
1.2试剂及仪器设备 复方丹参注射液购于上海第九制药厂,每毫升相当于丹参、降香各1 g。LPS购于Sigma,肝素购于中国医药工业有限公司,蛋白C、抗凝血酶Ⅲ活性检测试剂盒购于上海太阳生物技术公司。Sysmex CA 1500+CA 6000 全自动凝血分析仪(KOBE)。 Sysmex SE-9500 全自动血细胞分析仪(KOBE)。HITACHI 7170全自动血浆分析仪(HITACHI)。
2方法
2.1动物模型的建立 参照Hermida等[7]用LPS诱导兔DIC的方法。3%戊巴比妥钠按30 mg/kg从家兔耳缘静脉注射麻醉,分离右侧颈动脉、插管,以备取血。LPS溶于60 mL生理盐水中,然后以100 μg·kg-1·h-1(10 mL/h)的速度从兔耳缘静脉滴注,连续6 h给药,建立稳定的兔DIC模型。给药后2 h、4 h给予戊巴比妥钠腹腔注射,维持动物的持续麻醉状态。
2.2动物分组 将实验兔随机分6组,每组10只:(1)正常对照组;(2)DIC模型组;(3)低剂量复方丹参注射液治疗组;(4)中剂量复方丹参注射液治疗组;(5)高剂量复方丹参注射液治疗组;(6)肝素对照组。
2.3给药方法
①正常对照组 从兔双侧耳缘静脉以10 mL/h的速度滴注生理盐水(既不注射LPS,也不注射复方丹参注射液和/或肝素),连续6 h给药。
②DIC模型组 从兔一侧耳缘静脉滴注100 μg·kg-1·h-1(10 mL/h)LPS的同时,从对侧耳缘静脉以10 mL/h的速度滴注生理盐水,连续6 h给药。
复方丹参注射液治疗组:把复方丹参注射液溶于60 mL生理盐水中,从兔一侧耳缘静脉滴注LPS的同时,从对侧耳缘静脉分别以0.1 mL·kg-1·h-1、0.2 mL·kg-1·h-1、0.4 mL·kg-1·h-1(10 mL/h)的速度滴注低、中、高剂量复方丹参注射液,连续6 h给药。
肝素对照组:把肝素溶于60 mL生理盐水中,从兔一侧耳缘静脉滴注LPS的同时,从对侧耳缘静脉以6×105IU·kg-1·h-1(10 mL/h)的速度滴注肝素,连续6 h给药。
2.4观察指标和样品的收集 在注射LPS前和注射2 h、6 h后分别予以动脉取血1 mL,置于含有1/10体积的枸橼酸钠抗凝液的塑料管中,3 000 r/min离心10 min,分离血浆,待测血浆-20 ℃保存。
用Sysmex CA 1500+CA 6000 全自动凝血分析仪检测活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、凝血酶原时间(prothrombin time, PT)和纤维蛋白原含量;用HITACHI 7170全自动血浆分析仪测定血浆谷丙转氨酶( alanine aminotransferase, ALT)以及血尿素氮(blood urine nitroge, BUN);用发色底物法测定蛋白C及抗凝血酶Ⅲ的活性;另取1 mL血,用依地酸二钾(EDTA-K2)抗凝,用Sysmex SE-9500 全自动血细胞分析仪进行血小板计数。
3统计学处理
结 果
1复方丹参注射液对LPS诱导的兔DIC凝血系统的影响
1.1APTT及PT的测定 DIC模型组注射LPS 2 h、6 h后,APTT明显延长,分别为(22.53±7.06) s和(34.17±6.81)s,与正常对照组比较差异显著(P<0.05),见表1;同时PT也呈明显增加,分别为(13.42±4.86)s和(20.83±5.21)s,与正常对照组比较差异显著(P<0.05),见表1。
复方丹参注射液治疗组给药2 h后,复方丹参注射液中、高剂量组APTT和PT延长,与DIC模型组比较有明显下降(P<0.05),见表1。给药6 h后,复方丹参注射液各剂量组APTT和PT的延长与DIC模型组比较明显下降,与肝素组抗凝作用相似(P<0.05),见表1。
1.2血小板计数的测定 DIC模型组注射LPS 2 h、6 h后,血小板计数分别为(304.16±47.23)×109/L和(155.47±24.65)×109/L,与正常对照组比较呈进行性下降(P<0.05),见表1。复方丹参注射液中、高剂量组给药2 h后,血小板计数与DIC模型组比较有明显的增加(P<0.05),见表1;给药6 h后,复方丹参注射液各剂量组的血小板计数有明显降低,与DIC组比较有显著差异(P<0.05),与肝素组抗凝作用相似,见表1。
1.3纤维蛋白原含量的测定 DIC模型组注射LPS 6 h后,纤维蛋白原含量为(1.86±0.42)g/L,与正常对照组比较显著下降(P<0.05),见表1。给药6 h后,复方丹参注射液各剂量组的纤维蛋白原含量有明显下降,与DIC对照组比较有显著差异(P<0.05),与肝素组抗凝作用相似,见表1。
2复方丹参注射液对LPS诱导的兔DIC抗凝系统的影响
DIC模型组注射LPS后,血浆蛋白C及抗凝血酶Ⅲ的活性分别为60.21±20.52、82.07±17.31(2 h)以及43.58±14.10、50.28±20.08(6 h),与正常对照组比较均呈进行性下降(P<0.05),见表1。复方丹参注射液中、高剂量组给药2 h后,抗凝血酶Ⅲ的活性以及各剂量组蛋白C活性均明显增高(与DIC模型组比较差异显著,P<0.05),见表1;给药6 h后,复方丹参注射液各剂量组蛋白C及抗凝血酶Ⅲ的活性有明显改善,与DIC对照组比较差异显著(P<0.05),与肝素组抗凝作用相似,见表1。

表1 复方丹参注射液对LPS诱导的兔DIC的凝血系统的作用
*P<0.05,**P<0.01vsLPS group.SM:CompoundSalviamilitorrhizainjection.
3复方丹参注射液对LPS诱导的兔DIC血浆ALT和BUN的影响
兔注射LPS 2 h、6 h后,血浆ALT和BUN水平均有明显升高。复方丹参注射液中、高剂量组给药2 h后,ALT明显下降(P<0.05),复方丹参注射液各剂量组给药6 h后ALT亦显著下降(P<0.01),见图1。 复方丹参注射液中、高剂量组给药6 h后,BUN水平较DIC模型组有显著下降(P<0.01),见图2。
讨 论
LPS(内毒素)是G-杆菌细胞壁上的主要成分,可直接导致凝血因子激活,组织因子释放,引起凝血途径激活,导致微血栓广泛形成,从而诱导动物DIC的发生[8,9]。因此研究者常用LPS诱导、建立DIC动物模型。本课题组用连续静脉滴注LPS诱导兔DIC的发生,结果显示,给予LPS后,APTT和PT呈进行性延长,血小板计数和纤维蛋白原显著降低;血浆蛋白C和抗凝血酶Ⅲ活性也呈明显下降;而血浆ALT和BUN含量则显著增加。这与国外文献报道一致[7],表明建立了稳定的兔DIC模型。
本研究中,复方丹参注射液分别以0.1 mL·kg-1·h-1(低剂量)、0.2 mL·kg-1·h-1(中剂量)、0.4 mL·kg-1·h-1(高剂量)3个剂量滴注。随复方丹参注射液剂量的增加,APTT和PT较DIC模型组有明显缩短;血浆纤维蛋白原含量以及血小板计数较DIC模型组有明显增加;同时血浆蛋白C和抗凝血酶Ⅲ活性也较DIC模型组有明显改善;血浆BUN以及ALT含量较DIC模型组有明显下降。以上结果表明复方丹参注射液能有效拮抗LPS诱导的兔DIC。


图1复方丹参注射液对脂多糖诱导的兔DIC血浆谷丙转氨酶的作用

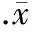
图2复方丹参注射液对脂多糖诱导的兔DIC血浆尿素氮的作用
DIC以全身凝血系统激活、抗凝系统抑制、纤维蛋白沉积、多器官微血栓形成以及多器官功能衰竭为特征。APTT和PT是内源性凝血系统较为敏感、简便和常用的筛选试验。动物注射LPS 2 h、6 h后APTT和PT均显著延长,提示LPS诱发DIC过程中凝血途径被启动;而我们给予复方丹参注射液后,APTT和PT较DIC模型组有明显缩短,提示复方丹参注射液可抑制LPS诱导DIC过程中凝血途径的激活。
血小板是凝血反应的关键点,DIC时血小板数量的减少是由于凝血途径的激活,促进凝血酶大量生成,导致了血小板聚集,从而使血小板减少。纤维蛋白原是凝血反应的最终产物,也是血栓的主要成分。DIC时纤维蛋白原含量减少是由于血浆中纤维蛋白原在凝血酶作用下转变成稳定性纤维蛋白(即微血栓)的结果。本研究中我们发现,给予复方丹参注射液后,均可以在一定程度上阻止兔DIC诱导的血小板和纤维蛋白原进行性下降,同时本课题组前期研究结果亦显示复方丹参注射液可抑制肾组织微血栓的形成,以上结果提示了复方丹参注射液可抑制凝血系统激活,并抑制器官微血栓形成。血管内是否存在栓子与DIC多器官功能衰竭的发生有直接关系[10],ALT和BUN是反映肝、肾功能的重要实验室指标,本实验中我们观察到,复方丹参注射液各组血浆中BUN以及ALT明显下降,甚至高剂量复方丹参注射液给药6 h后,血浆ALT含量恢复到正常水平,这很可能与复方丹参注射液抑制微血栓形成,从而使重要脏器供血得以恢复或改善,脏器功能也随之改善有关。
本研究中复方丹参注射液的这些效应与其抗凝作用有密切关系。因此我们进一步测定了血浆蛋白C和抗凝血酶Ⅲ的活性。蛋白C和抗凝血酶Ⅲ是参与抗凝机制的重要的两个抗凝调节蛋白。DIC时,血浆蛋白C和抗凝血酶Ⅲ呈显著下降,这是由于凝血系统的激活,引起凝血酶大量激活,抑制了蛋白C和抗凝血酶Ⅲ活性;临床上,DIC患者的蛋白C和抗凝血酶Ⅲ活性明显下降,常常可导致患者死亡。本研究中,给予LPS后,实验动物的血浆蛋白C和抗凝血酶Ⅲ的活性显著降低,而给予复方丹参注射液后,可明显恢复两者的活性,甚至随着复方丹参注射液剂量的增加,血浆蛋白C和抗凝血酶Ⅲ的活性可恢复至正常水平。提示复方丹参注射液可通过阻止两者活性的下降,改善抗凝系统,从而达到拮抗DIC的目的。
综上所述,复方丹参注射液可明显防止内毒素血症时的DIC,表现在,与DIC模型组比较,用复方丹参注射液治疗的实验兔的APTT和PT明显缩短;血小板数量和纤维蛋白原增加;血浆ALT和BUN的水平明显下降;蛋白C和抗凝血酶Ⅲ的活性明显改善。这种作用可能是复方丹参注射液抑制凝血系统激活、改善抗凝系统、阻止微血栓形成、促进重要脏器的血供以及恢复脏器功能的结果。本研究提示复方丹参注射液在DIC的治疗中有良好的应用前景。
[1] Thachil J, Toh CH. Disseminated intravascular coagulation in obstetric disorders and its acute haematological management[J].Blood Rev, 2009,23(4):167-176.
[2] 罗晓琴,朱 亮. 复方丹参注射液抗血栓形成及其机理的研究[J]. 中成药,1994,16(10):36-37.
[3] 史莉瑾,刘喜明,毛兴爱,等.丹参素预处理对脑梗死大鼠血浆纤溶激活系统的影响[J].临床神经病学杂志,2010,23(4):278-280.
[4] 刘建东,唐汝愚.丹参酮对大鼠实验性脑梗塞的防治作用[J].中国病理生理杂志,1993,9(3):369-372.
[5] 陈 辉,邵跃斌,黎庆梅,等.灯盏花、丹参液在体外对血小板活化抑制作用的研究[J].国际医药卫生导报,2009,15(21):1-5.
[6] 林 熙,左长清,吴 铁,等.复方丹参注射液对LPS诱导的肾纤维蛋白沉积的作用[J].中国临床药理学与治疗学,2006,11(1):91-94.
[7] Hermida J, Montes R, Paramo JA, et al. Endotoxin-induced disseminated intravascular coagulation in rabbits: effect of recombinant hirudin on hemostatic parameters, fibrin deposits, and mortality[J]. J Lab Clin Med, 1998, 131(1): 77-83.
[8] Asakura H, Suga Y, Ontachi Y, et al. Pathophysiology of disseminated intravascular coagulation (DIC) progresses at a different rate in tissue factor- induced and lipopolysaccharide- induced DIC models in rats[J]. Blood Coagul Fibrinolysis, 2003, 14(3): 221-228.
[9] 谢 军. 组织因子(TF)与弥漫性血管内凝血(DIC)[J]. 中山大学研究生学刊(自然科学、医学版), 2008,29(1):8-14.
[10]Sawamura A, Hayakawa M, Gando S, et al. Disseminated intravascular coagulation with a fibrinolytic phenotype at an early phase of trauma predicts mortality[J]. Thrombosis Res, 2009, 124(5):608-613.
EffectofcompoundSalviamilitorrhizainjectiononLPS-induceddisseminatedintravascularcoagulationinrabbits
LIN Xi1, QI Jie-zhen2, QIU Peng-xin2, CHEN Jia-shu2
(1DepartmentofPharmacology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;2DepartmentofPharmacology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:jiashu_sysu@hotmail.com)
AIM: To evaluate the effect of compoundSalviamilitorrhiza(SM) injection on lipopolysaccharide (LPS)-induced experimental disseminated intravascular coagulation (DIC) in rabbits.METHODSThe LPS-induced DIC model in rabbits was performed by continuous infusion of LPS at 100 μg·kg-1·h-1for 6 h. Treatment with compound SM injection or heparin was begun simultaneously with LPS infusion through the contralateral marginal ear vein.Activated partial thromboplastin time (APTT), prothrombin time (PT), platelet count and fibrinogen concentration were determined. The plasma levels of alanine aminotransferase (ALT) and blood urine nitrogen (BUN) were detected. The activity of protein C and antithrombi III (ATIII) was also measured.RESULTSContinuous infusion of LPS induced gradual impairment of hemostatic parameters and damages in renal and liver functions. The intravenous administration of compound SM injection attenuated the increase in plasma levels of APTT and PT, and the decrease in plasma levels of fibrinogen and platelet induced by LPS infusion. Compound SM injection decreased the levels of ALT and BUN, reduced the damages in the liver and kidney, and also significantly inhibited the decreased plasma levels of protein C and ATIII in LPS- treated animals.CONCLUSIONCompound SM injection has a protective effect against DIC in rabbits.
CompoundSalviamiltiorrhizainjection; Heparin; Lipopolysaccharides; Fibrinogen; Blood platelets
R543.7
A
1000-4718(2011)03-0464-05
2010-10-09
2010-12-31
国家自然科学基金资助项目(No. 81000209);教育部科学技术研究重点资助项目(No. 210255);暨南大学科研培育与创新基金资助项目(No. 21609304)
△通讯作者 Tel:020-87330553;E-mail: jiashu_sysu@hotmail.com
10.3969/j.issn.1000-4718.2011.03.009
