辛伐他汀对尼古丁诱导脐静脉内皮细胞分泌t-PA和PAI-1的影响*
2011-10-24扈丽娟胡晓芸韩葆芬
扈丽娟, 胡晓芸, 杜 艳, 韩葆芬
(山西医科大学第一医院呼吸内科, 山西 太原 030001)
辛伐他汀对尼古丁诱导脐静脉内皮细胞分泌t-PA和PAI-1的影响*
扈丽娟, 胡晓芸△, 杜 艳, 韩葆芬
(山西医科大学第一医院呼吸内科, 山西 太原 030001)
目的研究不同浓度辛伐他汀对尼古丁诱导人脐静脉内皮细胞(HUVECs)分泌组织纤溶酶原激活物(t-PA)和1型纤溶酶原激活物抑制剂(PAI-1)及其基因表达的影响。方法将3-6代体外培养的HUVECs随机分为对照组、尼古丁组及不同浓度辛伐他汀组,辛伐他汀组分别以1、10、100 μmol/L辛伐他汀预处理细胞2 h,再以100 μmol/L尼古丁孵育24 h。酶联免疫吸附双抗体夹心法(ELISA)检测细胞上清液t-PA和PAI-1含量;逆转录聚合酶链反应(RT-PCR)检测细胞t-PA和PAI-1 mRNA的表达。结果尼古丁组PAI-1分泌和mRNA表达较对照组显著升高(P<0.05)。不同浓度辛伐他汀组PAI-1分泌和mRNA表达均较尼古丁组显著降低,且PAI-1分泌和mRNA表达的降低呈浓度依赖性(均P<0.05),以100 μmol/L辛伐他汀组最为显著。100 μmol/L辛伐他汀组PAI-1分泌和mRNA表达与对照组比较,无显著差异(P>0.05)。尼古丁组t-PA mRNA表达较对照组显著降低(P<0.05)。10、100 μmol/L辛伐他汀组t-PA mRNA表达较尼古丁组显著升高(P<0.05),各组间t-PA分泌无显著差异(均P>0.05)。结论在体外,辛伐他汀可降低尼古丁所致的PAI-1分泌和mRNA的表达,并升高t-PA mRNA的表达,从而逆转尼古丁介导的HUVECs纤溶活性减低。
辛伐他汀; 尼古丁; 人脐静脉内皮细胞; 组织纤溶酶原激活物; 纤溶酶原激活物抑制物1
辛伐他汀是一种胆固醇合成抑制剂,可竞争性抑制胆固醇合成的3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutary coenzyme A,HMG-CoA)还原酶,从而减少胆固醇的生物合成,是临床治疗高胆固醇血症的首选药物之一。目前,除了其高效、安全的调脂作用,辛伐他汀的内皮保护、稳定斑块和抗炎等作用也日益受到关注[1]。本实验拟观察不同浓度辛伐他汀对尼古丁诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)分泌组织纤溶酶原激活物(tissue plasminogen activator,t-PA)和1型纤溶酶原激活物抑制剂(plasminogen activator inhibitor 1,PAI-1)及其mRNA表达的影响,探讨其是否能减轻尼古丁所致的HUVECs纤溶损害及其作用机制。
材 料 和 方 法
1材料
辛伐他汀为默沙东公司产品;尼古丁购于Sigma; HUVECs株购于上海门谍塔生物科技发展有限公司,为ATCC来源细胞株;RPMI-1640 培养基、胰蛋白酶和HEPES均购于Gibco;特级胎牛血清(fetal bovine serum,FBS)购于杭州四季青生物制品公司;t-PA和PAI-1含量酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购于上海太阳生物技术公司。Trizol RNA提取试剂盒、逆转录聚合酶链反应(reverse transcript-polymerase chain reaction,RT-PCR)试剂盒均购于北京全式金生物技术有限公司。PCR引物及内参照GAPDH引物由上海生工生物工程公司合成。
2方法
2.1HUVECs 的体外培养 HUVECs复苏,加入含10% FBS 的RPMI-1640培养液,置于37 ℃、5% CO2、相对湿度90%的培养箱中培养,待细胞长至80%-90%融合时,以0.25%胰蛋白酶消化约1.5 min,以1∶2传代,3-6代用于实验。倒置显微镜进行形态学观察并摄片。
2.2实验分组 选择对数生长期的细胞,调整细胞浓度为 5×108cells/L,加入24 孔板,每孔3 mL,每组设立4个复孔。待细胞生长至80%融合状态后,换无血清培养基继续培养24 h,使细胞同步化。贴壁细胞随机分为5组:(1)对照组:培养液中加入与尼古丁相同体积的无菌PBS液;(2)尼古丁组:培养液中加入100 μmol/L尼古丁作用24 h;(3)不同浓度辛伐他汀组:先将脂溶性辛伐他汀片4.3259 mg(40 mg/片,相对分子质量432.59)溶于100 μL无水乙醇,加入150 μL NaOH(1 mol/L)50 ℃孵育2 h,用0.1 mol/L HCl调pH值至7.2,加双蒸水至10 mL,即制得终浓度为1 mmol/L的储存液,经0.22 μm微孔滤膜过滤,4 ℃保存,备用。实验时分别将辛伐他汀储存液用PBS稀释为1、10及100 μmol/L,加入培养液预孵育细胞2 h,然后加入终浓度为100 μmol/L尼古丁作用24 h。于实验终点收集各组上清液,1500 r/min离心, -20 ℃保存,待测。
2.3酶联免疫吸附双抗体夹心法(ELISA)检测t-PA和PAI-1 分别将t-PA和PAI-1标准品准确复溶,用稀释液做6次倍比稀释,t-PA标准品浓度分别为30、15、7.5、3.75、1.875、0.9375 μg/L;PAI-1标准品浓度分别为120、60、30、15、7.5、3.75、1.875 μg/L。其余步骤严格按t-PA和PAI-1测定试剂盒说明书操作。以A490对t-PA和PAI-1的标准品浓度分别在普通坐标系(t-PA)和双对数坐标系(PAI-1)上作标准曲线,待测样品t-PA和PAI-1含量由标准曲线上得出。
2.4RT-PCR检测t-PA和PAI-1 mRNA 5组细胞孵育完成后,弃去培养液,PBS洗涤2-3次,加入1 mL Trizol试剂提取细胞总RNA。RNA提取按说明书进行。提取的RNA溶于DEPC-H2O稀释到1 mL,测定A260/A280值,计算RNA纯度及含量,实验重复3次。取2 μg总RNA用逆转录酶进行反转录合成cDNA,PCR扩增t-PA、PAI-1和GAPDA(作为内参照)。PCR引物分别为:tPA 上游引物5′-CAAGTCTCCTTCCCCTTTCC-3′,下游引物5′-GGGTTGTGGCAACAGAAAGT-3′,目的片段190 bp;PAI-1上游引物5′-TGCCCTCTACTTCAACGG-3′,下游引物5′-GTCGGTCATTCCCAGGTT-3′,目的片段390 bp。内参照GAPDH上游引物5′-TGAACGGGAAGCTCACTGG-3′,下游引物5′-TCCACCACCCTGTTGCTGGA-3′,目的片段307 bp。PCR反应体系为:buffer 5 μL,dNTP 4 μL,目的基因 5 μL,正、反向引物各 1 μL,Taq酶0.5 μL,DEPC-H2O 33.5 μL混匀。PCR反应条件为:94 ℃预变性120s,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共反应32个循环。
3统计学处理
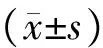
结 果
1HUVECs形态观察
培养2-3 d 后,倒置相差显微镜下可见到细胞由均匀悬浮状态变为大量贴壁生长,形态由圆形变为不规则形,呈扁平、椭圆形、梭形或多角形,为单层鹅卵石镶嵌样排列,细胞单层融合时呈典型的“铺路石”样外观,见图1。
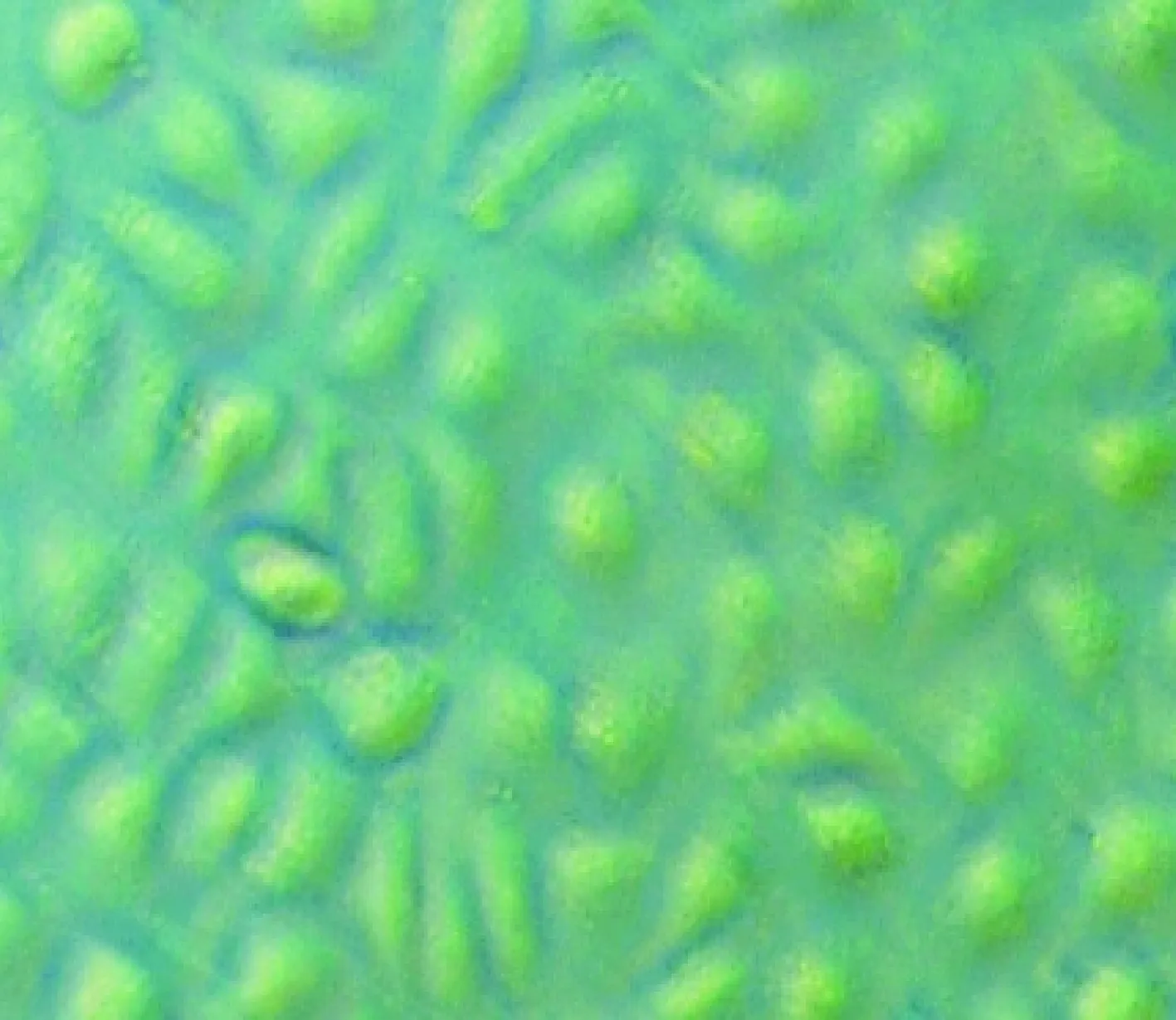
Figure 1. Morphology of HUVECs under inverted phase contrast microscope(×100).
图1倒置显微镜下的HUVECs
2不同浓度辛伐他汀对尼古丁诱导HUVECs分泌t-PA和PAI-1的影响
对照组HUVECs释放少量t-PA和PAI-1。尼古丁刺激后,HUVECs PAI-1分泌增加, 且明显高于对照组。经不同浓度辛伐他汀预处理HUVECs后,其上清液PAI-1含量较尼古丁组降低,且呈浓度依赖性;100 μmol/L辛伐他汀组 PAI-1与对照组无显著差异。t-PA含量各组间无显著差异。各组之间的比较见表1。
表1各组HUVECst-PA与PAI-1含量比较


Groupt-PA(μg/L)PAI-1(μg/L)Control1.082±0.13138.660±1.749Nicotine0.725±0.21166.051±2.890∗1μmol/Lsimvastatin+nicotine0.836±0.25560.788±2.500∗△10μmol/Lsimvastatin+nicotine0.965±0.19654.955±3.971∗△100μmol/Lsimvastatin+nicotine1.100±0.27441.924±4.472△
*P<0.05vscontrol;△P<0.05vsnicotine.
3不同浓度辛伐他汀对尼古丁诱导HUVECs表达t-PA和PAI-1mRNA的影响
图2显示,参照marker,判断PCR产物片段大小,并与内参照带的吸光度作比较,求其比值。应用图像分析系统进行灰度扫描并积分,比较对照组、尼古丁组和不同浓度辛伐他汀组RT-PCR扩增的t-PA/GAPDH和PAI-1/GAPDH目的DNA片段灰度比值,见图3。图像分析仪灰度扫描积分比较可见,尼古丁组 HUVECs PAI-1 mRNA 表达较对照组明显升高,t-PA mRNA表达较对照组明显降低。不同浓度辛伐他汀组PAI-1 mRNA表达均较尼古丁组降低,t-PA mRNA的表达较尼古丁组升高,并在一定范围内呈浓度依赖性,以100 μmol/L辛伐他汀组作用最为显著;100 μmol/L辛伐他汀组 PAI-1 mRNA 与对照组无显著差异。
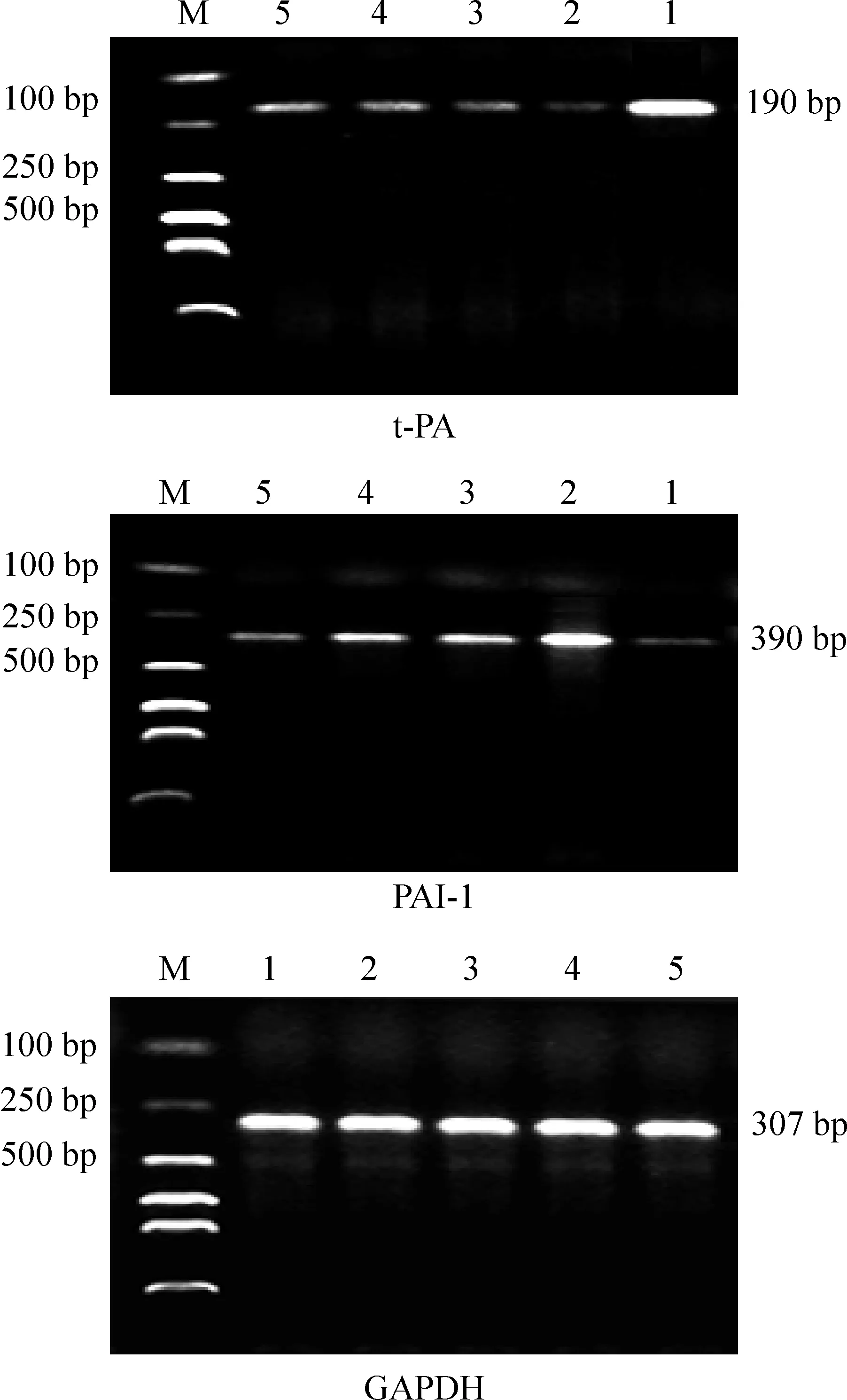
Figure 2. Effects of simvastatin on mRNA expression of t-PA and PAI-1 in HUVECs induced by nicotine. M:marker;1:control;2: nicotine;3:1 μmol/L simvastatin+ nicotine;4:10 μmol/L simvastatin+nicotine;5:100 μmol/L simvastatin+ nicotine.
图2辛伐他汀对尼古丁诱导HUVECs表达t-PA与PAI-1mRNA的影响
讨 论
t-PA和PAI-1是纤溶系统的主要调节因子,主要由内皮细胞合成和分泌。t-PA能与血栓中的纤维蛋白特异性结合,激活纤溶酶原形成纤溶酶(PA),降解纤维蛋白而使血栓溶解,还可抑制血小板的聚集。PAI-1是t-PA的快速抑制物,可与t-PA形成1∶1复合物,隐藏t-PA的结合位点。PAI-1同样也可结合于纤维蛋白,保留其对t-PA的抑制作用[2]。 t-PA/PAI-1比值下降可导致血浆纤溶活性降低,有助于纤维蛋白在血管内膜沉积,是血栓性疾病发生的重要预测因子。我们的前期实验提示,尼古丁可显著增加HUVECs PAI-1 mRNA及蛋白的表达,导致内皮细胞纤溶失衡[3]。辛伐他汀作为一种具有内皮保护及抗炎作用的物质,是否对尼古丁介导的内皮细胞纤溶功能紊乱具有保护作用,目前尚未见报道。
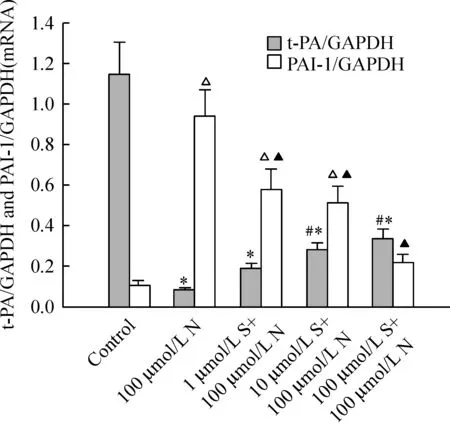
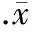
图3辛伐他汀对尼古丁诱导HUVECst-PA与PAI-1mRNA表达的影响
本实验采用不同浓度的辛伐他汀干预HUVECs,结果表明,1、10及100 μmol/L辛伐他汀组PAI-1 mRNA及蛋白表达均较尼古丁组降低,提示辛伐他汀可抑制 HUVECs PAI-1 mRNA表达和蛋白的产生与释放,对尼古丁介导的内皮细胞纤溶损害具有保护作用,与国外类似研究结果一致[4]。文献报道,他汀类药物具有调脂以外的独立抗炎作用,而且还可调节血管内皮细胞分泌细胞因子[5]。PAI-1为一种急性反应性蛋白,其表达是通过PKC依赖途径,消除炎症可改善内皮的纤溶活性[6,7]。研究证实,辛伐他汀对内皮细胞纤溶活性的改善作用是通过抗炎、保护内皮细胞,阻断了细胞骨架介导的胞内信号转导,因此阻断了该信号转导途径PAI-1基因的转录[8]。本文辛伐他汀对尼古丁介导的HUVECs PAI-1 mRNA和蛋白表达的抑制作用可能与阻断PKC途径有关,确切机制尚需进一步研究。
本实验不同浓度辛伐他汀组t-PA mRNA表达均较尼古丁组显著升高,但各组间t-PA蛋白无显著差异。这种基因与蛋白表达不一致现象的可能原因有:PAI-1的生理浓度较t-PA高数十倍,PAI-1与t-PA形成1∶1复活物后灭活了t-PA[9],使细胞上清液中t-PA含量很少或失活;试剂盒灵敏度低不易检出等,拟进一步采用其它方法检测该指标。
总之,血栓性疾病的发生与PAI-1活性升高,t-PA/PAI-1失衡有关。降低高活性的PAI-1对血栓性疾病的防治起重要作用[10、11]。本研究表明,在体外辛伐他汀可以明显改善尼古丁介导的HUVECs纤溶活性减低,为进一步研究吸烟所致纤溶功能紊乱的防治提供理论依据。
[1] 扬中苏,杨新春,那开宪.他汀类药物的临床应用进展[J].世界急危重病医学杂志,2006,3(5):1496-1502.
[2] Ye P, Hu X, Zhao Y. The increase in plasminogen activator inhibitor type-1 expression by stimulation of activators for peroxisome proliferator-activated receptors in human endothelial cells[J].Chin Med Sci J,2002,17(2):112-116.
[3] 杜 艳,胡晓芸,杜永成,等.尼古丁对血管内皮细胞释放t-PA及PAI-1的影响[J].中国病理生理杂志,2010,26(11):2253-2255.
[4] Wiesbauer F, Kaun C, Zorn G,et al. HMG CoA reductase inhibitors affect the fibrenolytic system of human vascular cellsinvitro:a comparative study using different statins[J].Br J Pharmacol,2002,135(1):284-292.
[5] Veillard NR, Braunersreuther V, Arnaud C, et al. Simvastatin modulates chemokine and chemokine receptor expression by geranylgeranyl isoprenoid pathway in human endothelial cells and macrophages[J]. Atherosclerosis,2006,188(1):51-58.
[6] Kaftan AH, Kaftan O.Coronary artery disease and infection with chlamydia pneumonia[J].Jpn Heart J,2000,41(2):165-172.
[7] Grulich-Henn J, Müller-Berghaus G.Regulation of endothelial tissue plasminogen activator and plasminogen activator inhibitor type 1 syntheses by diacylglycerol,phorbol ester and thrombin[J].Blut,1990,61(1):38-44.
[8] 刘永平,郑 兴,秦永文,等.辛伐他汀对冠心病患者血浆纤溶活性的改善作用[J].实用新医药杂志,2006,23(5):539-541.
[9] 杨霄鹏,李秋芳,王金兰,等.急性脑梗死患者血浆t-PA和PAI的变化及临床意义[J].中国实用神经疾病杂志,2006,9(6):33-34.
[10]Fu L, Jin H, Song K,et al. Relationship between gene polymorphism of the PAI-1 promoter and myocardial infarction[J].Chin Med J(Engl),2001,114(3):266-269.
[11]Tsantes AE, Nikolopoulos GK, Bagos PG, et al. Association between the plasminogen activator inhibitor-1 4G/5G polymorphism and venous thrombosis. A meta-analysis[J].Thromb Haemost,2007,97 (6):907-913.
Effectsofsimvastatinonnicotine-inducedt-PAandPAI-1expressioninhumanumbilicalveinendothelialcells
HU Li-juan, HU Xiao-yun, DU Yan, HAN Bao-fen
(DepartmentofRespiratory,TheFirstAffiliatedHospital,ShanxiMedicineUniversity,Taiyuan030001,China.E-mail:huxiaoyunly@sina.com)
AIM: To investigate the effects of simvastatin on nicotine-induced expression of tissue plasminogen activator (t-PA) and plasminogen activator inhibitor-1 (PAI-1) at mRNA and protein levels in human umbilical vein endothelial cells (HUVECs).METHODSCultured HUVECs at passage 3 to 6 were randomly divided into control group, nicotine group and simvastatin groups. The cells in simvastatin groups were treated with simvastatin at the concentrations of 1, 10 and 100 μmol/L for 2 h, and then exposed to nicotine at the concentration of 100 μmol/L for 24 h. The production of t-PA and PAI-1 in the cultured medium was measured by enzyme-linked immunosorbent assay (ELISA). The mRNA expression of t-PA and PAI-1 was determined by reverse transcript-polymerase chain reaction (RT-PCR).RESULTSCompared with the control cells, the secretion and mRNA expression of PAI-1 in the cells treated with nicotine were significantly increased(P<0.05). Simvastatin decreased the secretion and mRNA expression of PAI-1 in HUVECs stimulated by nicotine in a dose-dependent manner, and the most notable inhibitory effect was observed in 100μmol/L simvastatin group, in which the level of PAI-1 was almost the same as that in the control cells (P>0.05). Compared with the control cells, nicotine inhibited the mRNA expression of t-PA in HUVECs (P<0.05), and simvastatin at the concentrations of 10 and 100 μmol/L markedly increased the mRNA expression of t-PA in HUVECs treated with nicotine. However, the production of t-PA remained no significantly different among groups (P>0.05).CONCLUSIONSimvastatin obviously decreases the expression of PAI-1 at mRNA and protein levels, increases the mRNA expression of t-PA, and improves the fibrinolytic function of HUVECs exposed to nicotineinvitro.
Simvastatin; Nicotine; Human umbilical vein endothelial cells; Tissue plasminogen activator; Plasminogen activator inhibitor 1
R363
A
1000-4718(2011)03-0460-04
2011-10-09
2011-01-05
太原市科技兴市资助项目(No.0904051)
△通讯作者 Tel:0351-4639901; E-mail:huxiaoyunly@sina.com
10.3969/j.issn.1000-4718.2011.03.008
