同步放化疗治疗晚期宫颈癌的临床观察
2011-10-09罗俊华胡章华
罗俊华,李 真,曹 霞,胡章华,魏 荣
晚期宫颈癌常采用放射治疗,但5年生存率仍徘徊在30%~50%[1]。为观察同步放化疗对晚期宫颈癌的治疗效果,笔者所在医院2002-02~2004-03将收治的74例晚期宫颈癌患者随机分成单纯放疗组及同步放化疗组,对两组患者治疗反应、5年生存率及不良反应发生情况等方面进行比较,并通过检测两组患者治疗前后宫颈分泌物HPV-DNA表达及血清TNF-α含量,考察其作为判断晚期宫颈癌治疗效果监测指标的可行性。
1 资料与方法
1.1 一般资料 2002-02~2004-03笔者所在医院收治的晚期宫颈癌患者74例,年龄24~73岁,中位年龄为51岁;既往无肿瘤病史。所有患者均经病理证实,病变类型分结节型、菜花型、溃疡型,其中鳞癌64例、腺癌10例。临床分期按国际妇产科协会(FIGO)标准分期为Ⅲ期。按年龄相近、肿瘤大小相似且放疗方案基本一致的条件,将所有患者随机分为两组,单纯放疗组32例,同步放化疗组42例。纳入研究患者均签署知情同意书。
1.2 治疗方法 单纯放疗组采用60Co远距离治疗机体外照射,先盆腔前后,两大野对穿照射25~30 Gy,随后改为盆腔4野照射25~28 Gy,并加用192Ir高剂量后装治疗,1次/周,A点剂量7 Gy/次,5~7次为一疗程,A点总剂量为30~42 Gy。同步放化疗组在同单纯放疗组放疗的基础上联用全身静脉化疗,采用TP方案,即紫杉醇50 mg/m2加顺铂40 mg/m2,静脉滴注,1次/周,共6周。
1.3 宫颈分泌物HPV-DNA及血清TNF-α的检测 分别于治疗前及治疗结束后1个月进行,并设健康空白对照组。HPV-DNA的检测按第二代杂交捕获技术(HC-Ⅱ)的要求暴露宫颈后,用专用小刷子置于宫颈口与黏膜交界处逆时针转3圈,停留10 s,将小刷子放于专用试管中,盖上盖子在室温中保存。采用HC-Ⅱ基因杂交信号放大系统检测HPVDNA的阳性表达情况。血清TNF-α含量的检测在抽取外周静脉血2 ml,分离血清后,采用双抗体夹心酶联免疫吸附(ABC-ELISA)法,试剂盒为上海森雄科技实业有限公司生产,严格按说明书操作。
1.4 疗效评定与随访 分别于治疗后1、3个月,根据妇科检查、B超、MRI及CT检查结果观察肿瘤消退情况,按WHO实体肿瘤疗效评价标准评定两组患者的近期疗效。随访方式有定期门诊复查、通信或电话联系以及家访,前3年随访1次/0.5年,以后随访1次/年。设定随访截止时间为5年。
1.5 不良反应评价 按WHO统一分级标准[2],分为0~Ⅳ度。放化疗期间,每周复查白细胞变化、记录消化道反应情况;每2周复查肝、肾功能。0.5年后观察放射性直肠炎、放射性膀胱炎的发生情况。
1.6 统计学处理 采用SPSS12.0统计软件,计量资料以均数±标准差描述,组间比较采用t检验;计数资料采用百分比描述,组间比较采用χ2检验;生存率的计算采用寿命表法。
2 结 果
2.1 疗效 单纯放疗组与同步放化疗组患者对相应治疗的反应情况见表1。两组相比,同步放化疗组的总有效率优于单纯放疗组(P<0.05)。两组患者的1、3、5年生存情况见表2。同步放化疗组患者的5年生存率,优于单纯放疗组(P<0.05)。
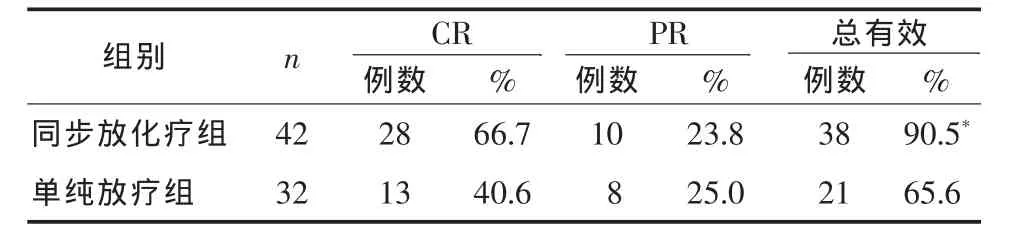
表1 两组患者近期疗效
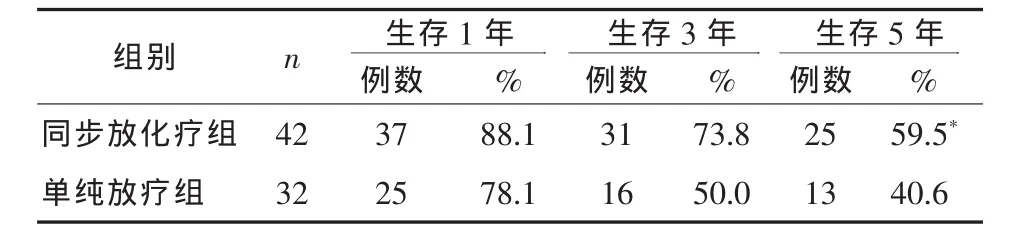
表2 两组患者生存情况
2.2 不良反应及并发症 治疗期间两组患者出现的不良反应及并发症发生情况见表3。同步放化疗组的骨髓抑制和胃肠道反应的发生率均较单纯放疗组高(P<0.05),但均未影响治疗过程,而放射性直肠炎、放射性膀胱炎的发生率两组间比较无统计学差异。
2.3 宫颈分泌物HPV-DNA及血清TNF-α 治疗前宫颈分泌物HPV-DNA阳性率同步放化疗组为95.3%、单纯放疗组为96.4%,两组无统计学差异(P>0.05),但均较健康对照组(19.7%)高 (P<0.05);治疗后HPV-DNA阳性率同步放化疗组为17.6%、单纯放疗组为20.4%,与治疗前比较均明显下降(P<0.01)。治疗后同步放化疗组患者HPV-DNA阳性率略低于单纯放疗组,但无统计学差异(P>0.05)。
治疗前血清TNF-α含量同步放化疗组为(131.15±76.83) pg/ml、 单纯放疗组为 (132.45±76.83) pg/ml,两组无统计学差异(P>0.05),但均高于健康对照组(45.21±12.23) pg/ml(P<0.01);治疗后血清 TNF-α含量同步放化疗组为 (86.15±46.83) pg/ml、单纯放疗组为(97.45±56.83) pg/ml,两组与治疗前比较均显著下降 (P<0.05)。治疗后血清TNF-α含量同步放化疗组略低于单纯放疗组,但无统计学差异(P>0.05)。
3 讨 论
近年来临床研究结果证明,同步放疗与化疗具有协同作用。处于不同细胞周期的肿瘤对放射治疗的敏感性不同,同步放化疗使不同细胞周期的肿瘤细胞同步化,对放射线的敏感性增强。化疗还能通过直接对肿瘤细胞产生毒性、肿瘤细胞周期同步化和抑制亚致死性放射损伤修复,增加放射剂量反应曲线的梯度,促使肿瘤细胞死亡。因此,同步放化疗可明显提高宫颈癌患者的生存率,使病死危险下降30%~50%,提高肿瘤局部控制率,降低远处转移的发生率[2]。据此,美国国立癌症研究所(NCI)推荐放射治疗联合以顺铂为主的化疗为治疗局部进展期宫颈癌的标准治疗方案。本文结果显示,CR单纯放疗组为40.6%,同步放化疗组为66.7%,两组总有效率分别为 65.6%、90.5%,有统计学差异(P<0.05)。且同步放化疗组的5年生存率为59.5%,优于单纯放疗组的40.6%(P<0.05)。尽管治疗期间同步放化疗组骨髓抑制及胃肠道反应的发生率高于单纯放疗组,但均没有影响治疗过程。而放射性直肠炎、放射性膀胱炎的发生率两组之间无统计学差异。
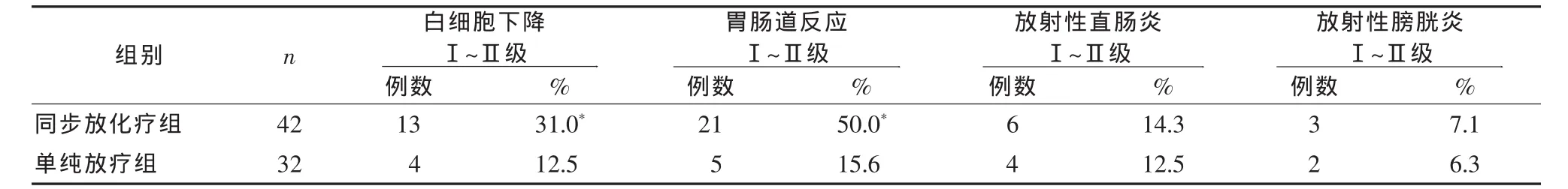
表3 两组患者不良反应发生情况
晚期宫颈癌患者血清TNF-α含量显著增高,这与肿瘤细胞自分泌及刺激机体免疫系统释放TNF-α增多有关[3]。治疗后随着肿瘤细胞的杀灭及HPV感染的清除,血清TNF-α含量下降[4]。本文结果显示两组患者治疗前后HPV-DNA阳性率存有显著差异,治疗后HPV感染率明显下降。同步放化疗组与单纯放疗组比较,前者HPV转阴率略高于后者,但无统计学差异(P>0.05),结合两组患者治疗后的完全缓解率及远期疗效的比较,考虑可能与检测时间有关。两组患者治疗前血清TNF-α含量无统计学差异,但均较健康对照组高(P<0.01);治疗后各组患者血清TNF-α含量均下降,且同步放化疗组略低于单纯放疗组,但无显著性差异,可能与采血时间有关。因此,宫颈分泌物HPV-DNA的阳性表达与血清TNF-α含量的变化可作为监测疗效的指标,但需进一步观察随访,确定更为恰当的检测时机。
目前,无论是回顾性研究还是前瞻性研究均认为同步放化疗对宫颈癌的疗效要优于单纯放疗,以铂类为基础的同步放化疗方案对宫颈癌的疗效较好。因此,大多数学者将同步放化疗作为局部进展期宫颈癌的首选治疗。但具体的治疗方案仍处于研究探索阶段。宫颈分泌物HPV-DNA的表达与血清TNF-α含量的变化可作为治疗效果的监测指标,但具体检测时机及变化趋势有待进一步研究。
[1]孙建衡.妇科恶性肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2002.137.
[2]Pradhan S,Shukla VK,Agrawal S,et al.Sonographic and colour Doppler morphology in carcinoma gallbladder[J].Indian J Cancer,2002,39(4):143-148.
[3]Deshpande A,Nolan JP,White PS,et al.TNF-alpha promoter polymorphisms and susceptibility to human papillomavirus 16-associated cervical cancer[J].J Infect Dis,2005,191(6):969-976.
[4]韩存芝,郑曙民,荆洁线,等.宫颈癌患者病毒感染及其细胞因子水平变化的调查研究[J].肿瘤防治研究,2005,32(7):442-444.
