体外循环中搏动灌注和非搏动灌注对细胞因子影响的比较
2011-10-09王少强魏松洋马志强郑庆杰祁延博
王少强,魏松洋,马志强,郑庆杰,祁延博
体外循环(CPB)是心内直视手术中重要和必须的辅助手段,可引起全身炎症反应和代偿性抗炎反应[1]。传统CPB一般采用非搏动灌注(NPP)方式,搏动灌注(PP)可以模拟机体的自然血流,更符合生理,其对全身炎症反应和代偿性抗炎反应的影响尚需进一步探讨。2008-09~2010-05笔者对比观察了PP和NPP对术后细胞因子的影响。现报告如下。
1 资料与方法
1.1 一般资料 择期需在CPB下行心脏手术的患者 60例,男 36例,女 24例;年龄 36~74岁;体重49~82 kg;其中冠心病23例,瓣膜病37例;合并糖尿病12例,高血压28例;无凝血功能紊乱,无肝、肾、肺功能不全,左室射血分数≥35%,急性心肌梗塞史不短于3个月,无心脏手术及慢性炎症史。采用随机分为PP组和NPP组,每组30例。
1.2 麻醉与CPB方法 患者均采用气管插管和静吸复合麻醉。两组均使用Sarns9000型体外循环机和一次性膜肺。PP组在体外循环机后串联双搏动式心肺辅助装置(韩国 NEWHEARTBIO公司),它主要由2个储血囊和血液驱动装置组成。每个血囊的出入口均有一个单向瓣,使血液单向流动。血液的驱动依靠挤压杆挤压血囊,形成单向搏动血流。血流搏动上升的时间由挤压血囊的速度所决定,流量通过改变挤压频率和挤压幅度来调节。两组均采用浅低温CPB,鼻咽温度维持在31~33℃,主动脉阻断期间两组分别采用搏动灌注和非搏动灌注模式,流量控制在 2.3~2.8 L/min·m2,PP组开放升主动脉后立即恢复非搏动灌注。PP组起始参数设置为:基础流量30%,搏动周期开始点30%,结束点70%,射血时间占泵动周期的40%,搏动频率70~75次/min,调节参数直至桡动脉压力波形出现双峰波或明显的单峰搏动波形,脉压差>30 mmHg(1 mmHg=0.133 kPa)[2]。
1.3 标本的采集与指标测定 分别于术前(T1);CPB 期间 0.5(T2)、1 h(T3);CPB 后 2(T4)、4(T5)、8(T6)、24 h(T7)抽取桡动脉血 6 ml,肝素抗凝,其中2ml用常规法测定红细胞压积(Hct),剩余4 ml全血以3000 r/min离心,取上层血清,置入-20℃冰箱中保存。应用酶联免疫法 (试剂盒由美国ID公司生产)测定肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-8和IL-10浓度。由于CPB使用的血液稀释对TNF-α、IL-8、IL-10血清浓度有影响,用以下公式校正:校正值=测定值×术前Hct/测定时Hct。
1.4 统计学方法 采用SPSS11.0统计软件。计量资料数据以±s表示,组间比较采用两样本t检验,如果方差不齐则采用近似t检验和秩和检验;组内比较采用重复测量设计的方差分析。
2 结 果
2.1 临床指标 两组患者在年龄、性别、身高、体重、心功能(EF、FS)、伴随疾病(高血压、糖尿病)、手术类型、主动脉插管口径、体外循环时间和主动脉阻断时间、机械通气时间、术后ICU时间均无显著性差异(P>0.05),见表1。两组患者均无严重围术期并发症,痊愈出院。
2.2 细胞因子水平 与T1比较,两组TNF-α、IL-8、IL-10 血清浓度在 T2~T7均升高(P<0.01)。与 NPP组比较,PP组TNF-α血清浓度在 T2~T6降低 (P<0.05); IL-8 血清浓度在 T3~T6降低 (P<0.05); IL-10 血清浓度在 T3~T6升高(P<0.05)。 见表2。
3 讨 论
CPB是心脏直视手术必须的辅助手段,大量研究表明CPB引起的全身炎症反应和代偿性抗炎反应是导致术后并发症的主要诱因之一[3]。PP能否成为解决上述问题的有效途径之一,引起了临床医师的重视。笔者选择需在CPB下行心脏手术的患者为研究对象,麻醉、手术和术后监护由同一组医护人员完成。由于执行了严格的患者选择标准和研究方案,两组患者的术前、术中情况具有很高的一致性。两组围术期处理的主要区别在于CPB过程中的灌注模式。笔者根据以往的研究结果采用桡动脉有创监测波形出现双峰波或明显的单峰搏动波形及脉压差>30 mmHg作为搏动灌注有效的指标来实施搏动灌注管理[2]。
表1 两组患者临床指标(n=30,±s)
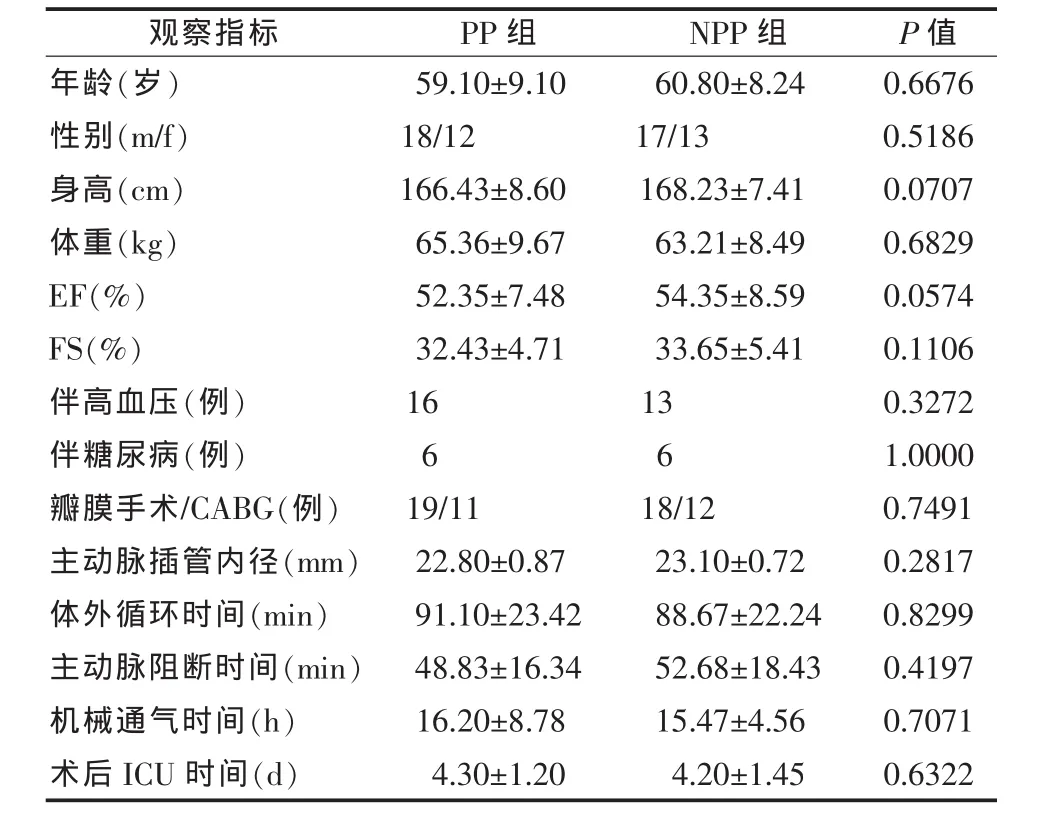
表1 两组患者临床指标(n=30,±s)
观察指标 PP组 NPP组 P值年龄(岁) 59.10±9.10 60.80±8.24 0.6676性别(m/f) 18/12 17/13 0.5186身高(cm) 166.43±8.60 168.23±7.41 0.0707体重(kg) 65.36±9.67 63.21±8.49 0.6829 EF(%) 52.35±7.48 54.35±8.59 0.0574 FS(%) 32.43±4.71 33.65±5.41 0.1106伴高血压(例) 16 13 0.3272伴糖尿病(例) 6 6 1.0000瓣膜手术/CABG(例) 19/11 18/12 0.7491主动脉插管内径(mm) 22.80±0.87 23.10±0.72 0.2817体外循环时间(min) 91.10±23.42 88.67±22.24 0.8299主动脉阻断时间(min) 48.83±16.34 52.68±18.43 0.4197机械通气时间(h) 16.20±8.78 15.47±4.56 0.7071术后 ICU 时间(d) 4.30±1.20 4.20±1.45 0.6322
表2 两组围手术期血清TNF-α、IL-8、IL-10 浓度(n=30,g/ml,±s)
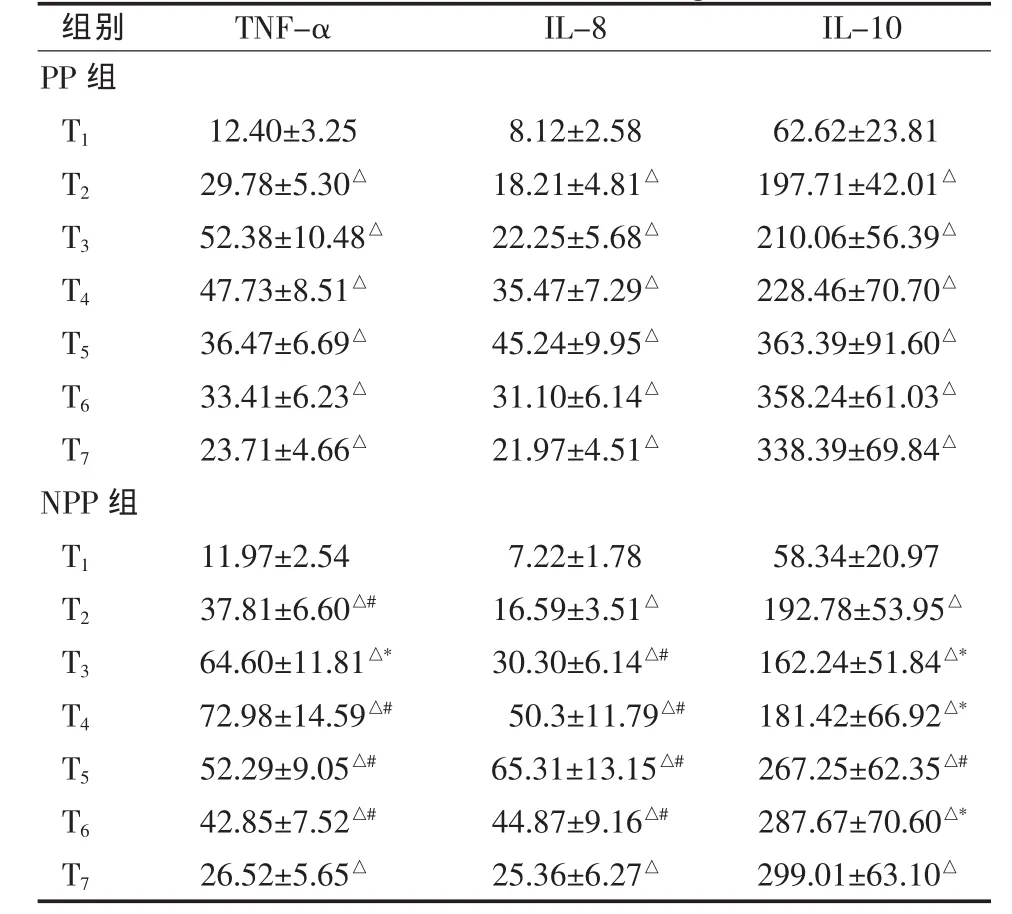
表2 两组围手术期血清TNF-α、IL-8、IL-10 浓度(n=30,g/ml,±s)
与 T1比较,▲P<0.05,△P<0.01;与 PP 组比较,*P<0.05,#P<0.01
组别 TNF-α IL-8 IL-10 PP组T1 12.40±3.25 8.12±2.58 62.62±23.81 T2 29.78±5.30△ 18.21±4.81△ 197.71±42.01△T3 52.38±10.48△ 22.25±5.68△ 210.06±56.39△T4 47.73±8.51△ 35.47±7.29△ 228.46±70.70△T5 36.47±6.69△ 45.24±9.95△ 363.39±91.60△T6 33.41±6.23△ 31.10±6.14△ 358.24±61.03△T7 23.71±4.66△ 21.97±4.51△ 338.39±69.84△NPP组T1 11.97±2.54 7.22±1.78 58.34±20.97 T2 37.81±6.60△# 16.59±3.51△ 192.78±53.95△T3 64.60±11.81△* 30.30±6.14△# 162.24±51.84△*T4 72.98±14.59△# 50.3±11.79△# 181.42±66.92△*T5 52.29±9.05△# 65.31±13.15△# 267.25±62.35△#T6 42.85±7.52△# 44.87±9.16△# 287.67±70.60△*T7 26.52±5.65△ 25.36±6.27△ 299.01±63.10△
细胞因子在机体免疫调节和炎症反应中起着重要作用。研究发现 TNF-α、IL-8、IL-10主要由CPB的刺激而释放,在CPB导致的全身炎症反应和代偿性抗炎反应中起着重要的作用[4,5]。
TNF-α是CPB所致全身炎症反应的主要致炎细胞因子,可以通过测量TNF-α的水平间接监测炎症反应的程度[6,7]。IL-8被认为是组织损伤严重程度的标志物[6,7]。本文结果显示CPB后2~4 h是致炎细胞因子释放较为显著的阶段,此时机体的炎症反应占主导地位。与NPP组比较,PP组TNF-α血清浓度在 T2~T6降低(P<0.05);IL-8 血清浓度在 T3~T6降低(P<0.05),这与 Sezai等[8]研究结果基本一致。表明PP能有效地抑制TNF-α、IL-8的释放,降低全身炎症反应。其机制可能为PP能提高灌注压力,延长毛细血管前动脉开放时间,有利于改善微循环,增加机体组织脏器血供,改善其缺血、缺氧,导致血清 TNF-α、IL-8 浓度下降[9,10]。
IL-10被认为是一种理想的抗炎细胞因子,对炎症反应的调控有非常重要的作用[4,5]。CPB导致机体组织脏器缺血、缺氧时,IL-10产生也随之增多,具有抑制炎症反应的作用[11]。本文结果显示,NPP组IL-10血清浓度在围术期呈 “双峰”变化,这与Kudlová等[5]的研究趋势基本一致。在CPB后8~24 h,IL-10浓度则持续上升,证明了在此期间代偿性抗炎反应占主导地位,将增加机体对感染的易感性[11]。PP组IL-10血清浓度的变化呈“单峰”变化,于CPB后4 h达到峰值。与NPP组比较,PP组IL-10血清浓度在 T3~T6升高(P<0.05)。本文结果提示,PP能在CPB后早期有效的促使IL-10的释放,对抗炎症反应,并能维持全身炎症反应和代偿性抗炎反应的平衡,减轻组织器官损伤。
综上述可见,PP能有效地抑制TNF-α、IL-8的释放,并使IL-10的释放明显上调,可在一定程度上降低全身炎症反应,减轻组织脏器损伤,有利于术后患者的恢复。
[1]Bone RC.Sir Isaac Newton,sepsis,SIRS,and CARS[J].Crit Care Med,1996,24(7):1125-1128.
[2]郭 震,李 欣,徐凌峰.有创血压波形监测下体外循环搏动灌注效果初步评价[J]. 中华外科杂志,2009,47(23):1801-1804.
[3]Halter J,Steinberg J,Fink G,et al.Evidence of systemic cytokine release in patients undergoing cardiopulmonary bypass[J].J Extra Corpor Technol,2005,37(3):272-277.
[4]Gasz B,Lenard L,Racz B,et al.Effect of cardiopulmonary bypass on cytokine network and myocardial cytokine production[J].Clin Cardiol,2006,29(7):311-315.
[5]Kudlová M,Kolácková M,Kunes P,et al.Cardiac surgery operations and their influence on serum level of antiinflammatory cytokine interleukin-10[J].Cas Lek Cesk,2007,146(1):48-55.
[6]Wen S,Wang J,Zhang C.Dynamic change of tumor necrosis factor and endothelin during perioperative period in patients undergoing coronary artery bypass grafting[J].Zhonghua Yi Xue Za Zhi,2001,81(23):1450-1452.
[7]Kawamura T,Wakusawa R,Okada K,et al.Elevation of cytokines during open heart surgery with cardiopulmonary bypass:participation of interleukin 8 and 6 in reperfusion injury[J].Can J Anaesth,1993,40(11):1016-1021.
[8]Sezai A,Shiono M,Nakata K,et al.Effects of pulsatile CPB on interleukin-8 and endothelin-1 levels[J].Artif Organs,2005,29(9):708-713.
[9]Undar A,Rosenberg G,Myers JL.Impact of pulsatile flow on microcirculation[J].ASAIO J,2004,50(6):624-625.
[10]Neuhof C,Wendling J,Dapper F,et al.Endotoxemia and cytokine generation in cardiac surgery in relation to flow mode and duration of cardiopulmonary bypass[J].Shock,2001,16(1):39-43.
[11]Allen ML,Hoschtitzky JA,Peters MJ,et al.Interleukin-10 and its role in clinical immunoparalysis following pediatric cardiac surgery[J].Crit Care Med,2006,34(10):2658-2665.
