安全施行门奇断流术治疗107例门脉高压合并脾亢的初步体会
2011-09-19罗兰云姚豫桐邹海波邓绍平黄孝伦
骆 乐,罗兰云,薛 华,姚豫桐,邹海波,王 冠,邓绍平,黄孝伦
(四川省医学科学院·四川省人民医院肝胆胰脾外科病区细胞移植中心,四川成都610072)
终末期肝脏疾病可由多种原因引起的肝炎后肝硬化、肝功能失代偿、继发门静脉高压症和脾脏功能亢进等一系列的、序贯性的、全身性的病理生理改变,临床表现错综复杂,治疗棘手。多数病人伴有多种激素水平的紊乱、血流动力学的异常、以及肠道黏膜屏障功能的衰竭等将导致手术风险性的增加[1]。因此,合理的、有效的、个体化的围术期管理方案、以及术中操作的要点是提高手术安全性的重要手段。我院从2010年7月至2011年6月对107例肝硬化门静脉高压并脾亢患者采用脾切除加贲门周围血管离断术的方法进行治疗,术前给予全面的评估、精心的准备,术中对患者血流动力学进行有效的管理和监控,术后积极的支持治疗,取得了满意的疗效。
1 资料与方法
1.1 一般资料 107例患者,男86例,女21例;平均年龄(48.5±7)岁。其中乙型病毒性肝炎后肝硬化87例(87/107)、酒精性肝硬化13例(13/107)、经肝穿活检证实的自身免疫性肝炎6例(6/107)、Wilson disease 1例(1/107)。肝功能采用Child-Pugh评分,B级肝功91例;C级肝功16例;均经 B超、CT证实均有肝硬化和脾肿大,常规行胃镜检查;当血小板<50×109/L,伴有胃底、食道中-重度静脉曲张,即诊断为脾功能亢进;当脾脏的直径>20 cm即为巨脾;Bun、Cr:均有不同程度的升高;小-中量腹水,75%的患者有上消化道出血史。
1.2 方法:
1.2.1 术前管理 入院时给予少渣、无网状和带刺的食物或蔬菜、少吃多餐;无团或块状肉食品、多饮柠檬和果汁、低盐(2.5 g/24 h,但不限水)、睡前吃点小吃或一杯多维葡萄糖水。均行抽血实验室指标检验、B超、腹部增强CT(排除肝硬化合并肝癌)、胃镜检查。常规保肝、利尿、补充多种维生素、降门脉压治疗,其中HBV病毒性肝炎患者常规检查HBVDNA的浓度,活动期(HBV-DNA>104)者推迟手术时间,需抗病毒治疗2周。有腹水的病人应常规行腹穿、细胞计数,以此排除自发性细菌性腹膜炎(SBP)。
1.2.2 手术方式及术中管理要点 采用脾切除及贲门周围血管离断术,麻醉开始后,快速补液2.0 L后,给予奥曲肽皮下注射、再给甘露醇250 ml;术中维持足够的尿量(100 ml/h),将收缩压保持在90 mmHg,CVP<5 cmH2O,切脾应先结扎脾动脉,等待5~10 min后脾血回流和脾脏缩小,继续完成脾切除。当脾切除完成后,将收缩压升到120 mmHg,CVP>10 cmH2O,并加大潮气量,再仔细的检查,妥善止血。
1.2.3 术后管理 术后维持血流动力学稳定,保证足够肾灌注,生长抑素24 h持续泵人3~5天。营养支持热卡维持在30~35 kcal/(kg·d),供氮以支链氨基酸为主,热氮比150∶1,术后第二天即给予肠内营养。
1.3 统计学处理 采用PASW Statistics 18.0软件进行统计学处理,组间比较两组数据均先进行方差齐性检验,因方差均不齐(双侧P <0.1),遂采用Wilcoxon两样本比较法,P<0.05为差异有统计学意义;率的比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 术后无一例死亡,99例恢复顺利,平均住院时间(12±3.63)d。随访6月,仅2例于术后3个月发生上消化道再出血,且均以黑便为主,经保守治疗后痊愈出院。
2.2 失血及输血情况 术中失血量平均为(251.40±179.95)ml,其中肝功Child B级者失血量平均为(209.89±109.6)ml,Child C级者失血量平均为(487.50±294.68)ml,两组分布比较差异有统计学意义(如表1,图1),Child C级组失血量明显多于Child B级组(P<0.05);术中11例行输血治疗,输血率为10.28%,平均输血量为(545.45±311.01)ml,其中Child B级组3例,输血率为3.30%,C组8例,输血率50%,两组输血率差异有统计学意义(P<0.05),C组明显高于B组(如表2)。但输血量方面,Child B、C两组比较分布差异无统计学意义(P <0.05)。

表1 不同肝功能分级与失血量比较
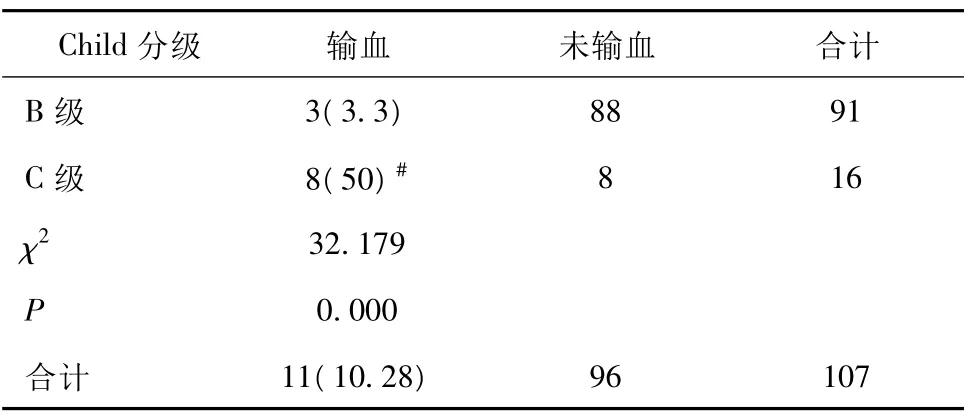
表2 不同肝功能分级与输血率的比较 [n(%)]

图1 不同肝功能分级出血量比较(○ 排除个案秩次,△ P<0.05)
2.3 术后严重并发症 如表3所示,术后6例(均为Child C级肝功)出现肝性脑病,为1~2度,发生率为5.61%;术后2例继发肝肾综合征(1例为Child B级,另1例为C级),且其中一名患者术前即合并肾病综合征,发生率为1.87%;术后无一例并发SBP。

表3 术后严重并发症情况
3 讨论
脾切除+食道、贲门周围血管离断术是目前治疗肝硬化继发门静脉高压并发症,即脾亢和上消化道出血最普遍的对症治疗方法,它能有效减少胃底食道静脉血量,从而达到制止或降低上消化道出血机率的目的。与此同时,将不同程度的增加向肝脏的血流量,有利于促进术后肝功能的恢复[2]。
终末期肝病患者均合并不同程度的门静脉高压症,而后者最为显著的特征就是内脏高动力血流,目的是为了增加向肝血流,代偿硬化结节压迫所引起的肝内血供减少[3]。有研究[4]表明,肝功能处于代偿期血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的分泌增加,介导了内脏血管床面积的增加,从而大大增加了内脏血流量,最终导致肝门静脉血流的增多,保证了肝脏血供。而Fernandez M[5]等人发现VEGF可促进门静脉高压侧支循环形成与建立。在此过程中,血小板源性生长因子[4](platelet-derived growth factor,PDGF)、NAD(P)H氧化酶[6]起重要的协同作用。因此,内脏血流量的增加以及侧支循环的建立常常是导致门脉高压病人术中及术后大出血的主要解剖生理学原因。我们发现,大小网膜内及胃短血管增粗较为明显,脾结肠韧带、脾膈韧带内侧支循环开放,脾蒂附近较多小血管形成,呈团或丛状,均须予以妥善缝扎。术中尽量少用电刀,以小钳分离、小结扎为主。笔者还发现,胰尾部及肾前筋膜往往与脾蒂关系紧密,可能是新生血管形成,引起纤维粘连带的增多所致,因此在分离这些粘连时需格外小心,一旦分破血管,往往可导致顽固性的渗血。同时我们术中注意保护胰腺,术后检测淀粉酶及引流液性状,及早发现胰腺损伤及胰漏,并及时处理。另外,脾静脉的迂曲扩张往往导致脾蒂内动静脉解剖关系的异常,且动脉周围发出较多新生血管至胰腺表面,因此在寻找脾动脉拟预先结扎,脾血回输时,需反复确认,并小心分离血管外包膜,小血管予以缝扎。
有文献[7]表明无创血压在肝硬化曲张静脉出血治疗中有指导意义。郑以山[8]等人证实控制 CVP在4~6 cmH2O范围内,对减少门静脉血流,显著减少门脉高压病人二次出血的风险和器官功能障碍,改善患者的预后有一定意义,且对器官灌注影响较小,并无器官损伤加重的现象。我们在术中通过降低并监测动态血压及CVP来控制病人术中血容量,从而到达到减少门静脉的血流量,减少手术操作过程中出血的目的。结果显示平均失血量及输血量均与严佶祺[9]等人报道接近[(251.40 ±179.95)ml&200 ml;(545.45 ±311.01)ml& 540 ml]。肝功Child B级者出血量及输血率明显低于C级肝功者。说明术前肝功能的保护对于手术安全性影响较大。我们在术前积极维护肝功能,治疗并发症,预期目的与此结果相吻合,也进一步提示术前积极改善肝功能评分的治疗措施或许是减少手术失血的又一保障。另外,我们在脾切除完成后提高血压及CVP,其目的在于二次止血,防止术后发生致命性的大出血而影响生存预后。
肝性脑病及肝肾综合征是终末期肝病常见并发症,麻醉及手术创伤应激可加重肝脏负担,影响肝脏血流,再加上低血容量造成的肠屏障功能的破坏,菌群移位可诱发术后肝性脑病和全身性感染[1],我们的对策是,术后密切检测血氨变化,维持内环境稳定,早期给予肠内营养,促进肠道功能恢复,供氮以支链氨基酸为主,以改善血浆氨基酸谱。结果仅6例出现肝性脑病,经积极治疗后痊愈。另外,因血管收缩及水钠潴留相关激素、菌群移位引起的多种炎症因子释放均可导致肾内血管收缩及肾脏低灌注,引发术后肝肾综合征[1],我们于麻醉开始后给予保护性利尿,术中及术后维持尿量正基于此目的。生长抑素因被发现能够降低肝硬化病人肝静脉压力梯度(hepatic venous pressure gradient,HVPG),缓解门静脉压力并有效增加肝脏血流灌注,因此可用于内脏出血的保守治疗[10,11]。而奥曲肽是合成的血管生长抑素8肽类似物,生物半衰期1~2小时,可减少门静脉压力,短时间降低非成对脏器血流。我们在围术期给予,目的在于减少术中及术后出血,尤其新生小血管的持续性渗血。结果较为满意。本文不足之处在于没有监测病人肝脏储备功能的变化。
作者认为,我们的围术期管理方法和手术要点是手术成功的有力保证,它大大提高了手术的安全性,降低了术后并发症的发生率,促进了病人的快速康复。
[1] Pere Ginès MD,Robert W,Schrier MD.Renal Failure in Cirrhosis[J].N Engl JMed,2009,361:1279-1290.
[2]高峰,孟健,王孟龙.脾切断流术引起的肝脏血流动力学变化及对肝脏功能的影响[J].实用医学杂志,2009,25(17):2864-2866.
[3]Guadalupe Garcia-Tsao MD,Jaime Bosch MD.Management of Varices and Variceal Hemorrhage in Cirrhosis[J].N Engl JMed,2010,362:823-32.
[4]Fernandez M,Mejias M,Garcia-Pras E,etal.Reversal of Portal Hypertension and Hyperdynamic Splanchnic Circulation by Combined Vascular Endothelial Growth Factor and Platelet-Derived Growth Factor Blockade in Rats[J].HEPATOLOGY,2007,46:1208-1217.
[5]Fernandez M,Mejias M,Angermayr B,etal.Inhibition of VEGF receptor-2 decreases the development of hyperdynamic splanchnic circulation and portal-systemic collateral vessels in portal hypertensive rats[J].JHepatol,2005,43:98-103.
[6]Angermayr B,Fernandez M,Mejias M,etal.NAD(P)H oxidase modulates angiogenesis and the development of portosystemic collaterals and splanchnic hyperaemia in portal hypertensive rats[J].Gut,2007,56:560-564.
[7]曹耀军,郑以山,钟正江,等.动态血压心电监测在肝硬化静脉曲张破裂出血治疗中的指导意义[J].东南大学学报(医学版),2004,18(8):1717-1721.
[8]郑以山,顾勤,刘宁.控制性低中心静脉压在肝硬化静脉曲张出血中的应用价值[J].蚌埠医学院学报,2009,34(2):133-135.
[9]严佶祺,杨卫平,周光文,等.门静脉高压症脾切除的手术技巧[J]. 肝胆外科杂志,2010,18(1):24-26.
[10]James SM,Roberto J.Somatostatin in portal hypertension.Digestive Diseases and Sciences[J].1989,34(3):S40-S47.
[11]Abraldes JG,Albillos A,Baares R.Simvastatin lowers portal pressure in patientswith cirrhosisand portalhypertension:a randomized controlled trial[J].Gastroenterology,2009,136(5):1651-8.
