雷帕霉素联合小剂量环孢素在肾移植受者转换治疗后的2年临床观察
2011-09-19林正斌曾凡军陈孝平
朱 兰,陈 刚,黄 伟,林正斌,刘 斌,曾凡军,陈孝平
(华中科技大学同济医学院附属同济医院器官移植研究所,武汉汉口430030)
目前,国内外肾移植术后免疫抑制维持治疗的主流用药还是以钙调磷酸酶抑制剂(calcineur ininhibitors,CNIs)为基础的经典三联治疗,使用雷帕霉素(sirolimus,SRL)的方案主要以取代CNIs而联合霉酚酸酯(mycophenolate mofetil,MMF)为主,采用SRL联合小剂量CNIs方案的研究不多,迄今国内更缺乏这方面报道。由于环孢素(cyclosporine,CsA)和SRL在体内外均有良好的协同免疫抑制作用,SRL联合小剂量CsA可能是一种既能有效避免CNIs毒副作用又能不增加排斥风险的新方案。为探讨肾移植受者从经典CsA三联治疗转换为SRL联合小剂量CsA治疗能否取得较好的临床效果,本研究通过平均2年的随访,观察了46例肾移植术后由经典CsA三联免疫抑制治疗转换为SRL联合小剂量CsA治疗的临床有效性及安全性。
1 资料与方法
本研究从2007年开始,陆续按下述入组标准选取了46例口服CsA+MMF+强的松(Prednisone,Pred)的肾移植受者,进行SRL+小剂量CsA+Pred的转换治疗。入组病例一般资料详见表1,平均随访2年左右。
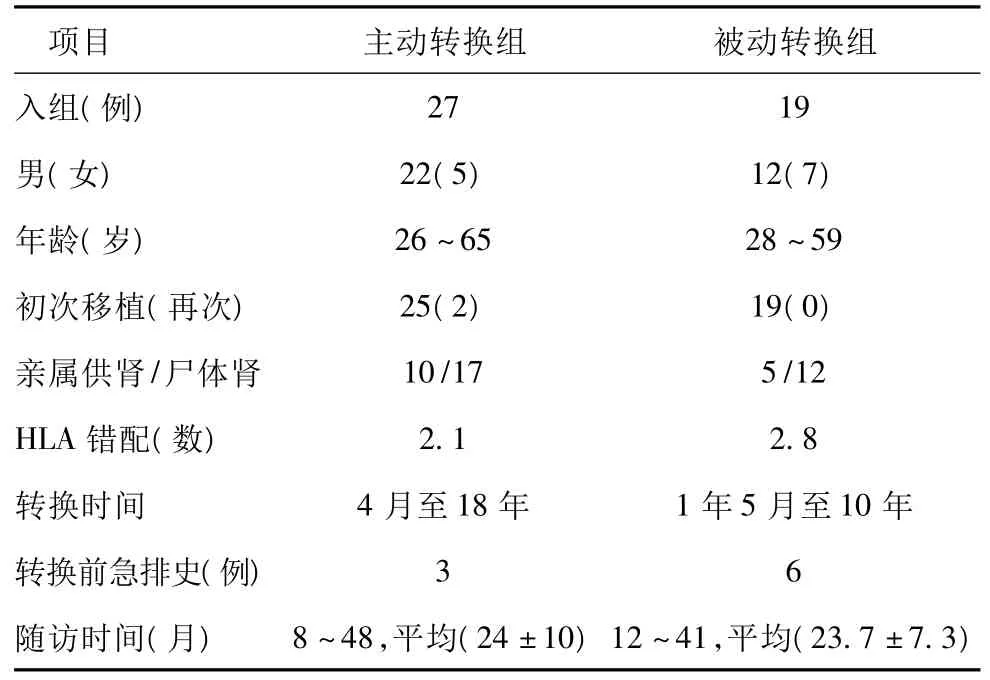
表1 一般资料
1.1 转换标准 ①肾移植后超过3月;②转换前能够耐受MMF 1g/d,无明显骨髓抑制现象发生。
1.2 转换方法 ①转换时给予SRL(雷帕鸣 ,美国惠氏制药)初始剂量2 mg q d,3天后减为1 mg q d,4天后根据血药浓度调整剂量,SRL目标谷浓度为4~7 ng/ml。②转换时先将CsA剂量减半,在SRL浓度达标后再调整剂量,使CsA谷浓度维持在20~50 ng/m l即可。③MMF减药到0.25 q 12 h,待SRL达到目标浓度后停用。④SRL与CsA在早上同时服用(8 Am)。
1.3 分组 根据转换时的基础移植肾功能和蛋白尿水平,分组如下:A.主动转换组(27例):转换前血肌酐(serum creatinie,Scr) <140 μmol/L,无或仅轻微蛋白尿,24小时尿蛋白总量<500 mg;B.被动转换组(19例):转换前Scr>140μmol/L,蛋白尿<2+或24小时尿蛋白总量<1000 mg。
1.4 观察指标 所有病例在转换后(0、3、6、12、24月)观察及比较Scr、由MDRD公式计算的肾小球滤过率(estimated glomerular filtration rate,eGFR)和尿蛋白变化,并动态监测PRA水平,评估B淋巴细胞因免疫抑制不足而激活的风险,同时记录转换后急性排斥反应发生率和SRL相关的副作用(包括血常规和血脂的变化等)。
1.5 统计方法 线型变量以平均值±标准差表示,差异显著性采用t检验。
2 结果
2.1 转换前后用药比较 ①主动转换组:转换前CsA平均剂量为(138±52)mg/d,平均谷浓度为(106±29)ng/ml;转换后3月的平均剂量为(54±16)mg/d,平均谷浓度为(35±16)ng/ml,平均减药幅度为61%(P<0.01)。转换后3月的SRL平均剂量为(0.80±0.36)mg/d,平均谷浓度为(6.4±1.97)ng/ml。②被动转换组:转换前CsA平均剂量为(150±47)mg/d,平均谷浓度为(120±38)ng/ml;转换后3月的平均剂量为(54±16)mg/d,平均谷浓度为(48±8)ng/m l,平均减药幅度为64%(P<0.01)。转换后3月的SRL平均剂量为(1.1±0.53)mg/d,平均谷浓度为(6.1 ±3.8)ng/ml。
2.2 退组情况 ①主动转换组:平均2年的随访期间,27例受者中仅3例(11%)在转换后6~18月退组,原因分别为关节痛症状自觉加重(1例)、慢性腹泻(1例)、及蛋白尿加重(1例),退组时3例受者的移植肾功能均保持良好。②被动转换组:19例受者中10例(53%)在转换后3~32月退组,其中6例因移植肾功能慢性进展而需恢复血液透析。2例受者转换后eGFR虽然有所改善,但因蛋白尿加重而改变免疫抑制方案。另外2例受者肾功能及尿蛋白情况平稳,但因不能坚持随访而退组(见表2)。所有退组病例在转换前eGFR在22~33 ml/min/1.73 m2。
2.3 移植肾功能变化 ①主动转换组:绝大多数病例(25/27)在转换治疗后早期均出现Scr一定程度下降,平均由转换前(109±27)μmol/L降至转换3月后的(97±19)μmol/L(P <0.01),见图1a;eGFR也出现显著改善,由转换前的平均(63±11)ml/min/1.73 m2上升至(71±12)ml/min/1.73 m2(P<0.01),见图1b。在其后的2年随访时,血肌酐和eGFR继续保持平稳,分别为(99±14)μmol/L和(69±9)ml/min/1.73 m2(图1)。②被动转换组:未退组的9例受者在转换时已存在慢性移植肾功能明显受损,血肌酐平均(195±43)μmol/L,eGFR平均(33±8)ml/min/1.73 m2,但转换治疗3月后同样观察到移植肾功能明显好转,血肌酐下降至(165±39)μmol/L,eGFR上升至(41±15)m l/min/1.73 m2(P<0.05)。并且转换2年后维持稳定。
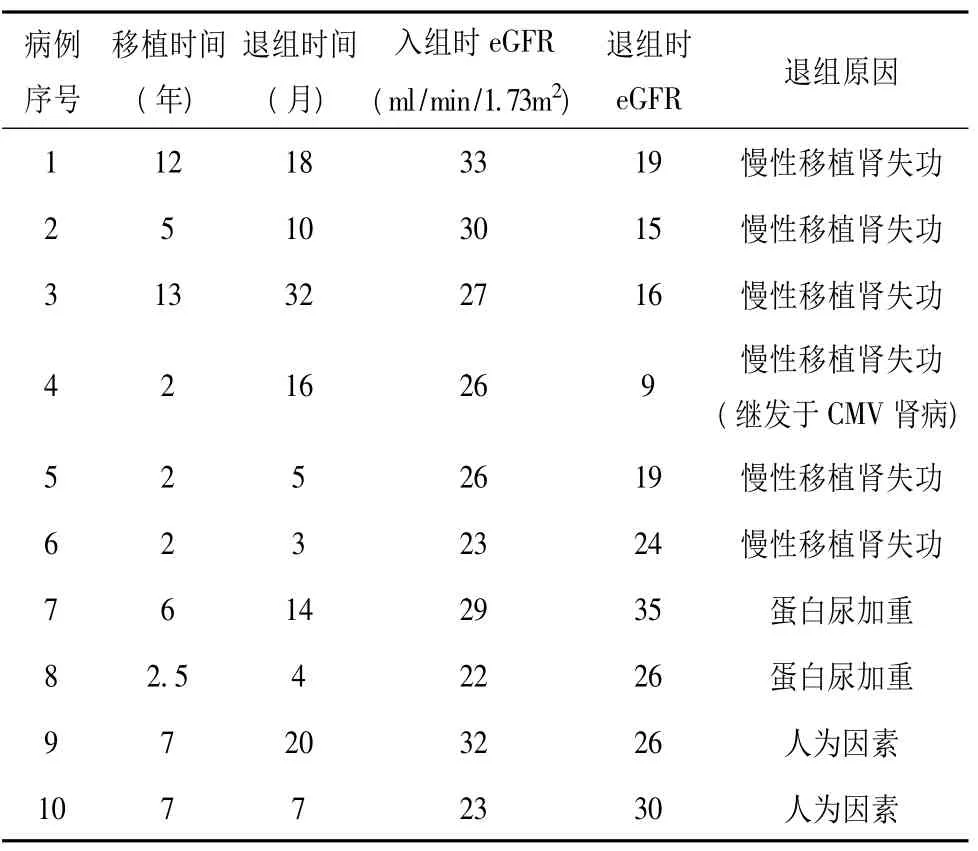
表2 被动转换组退组情况
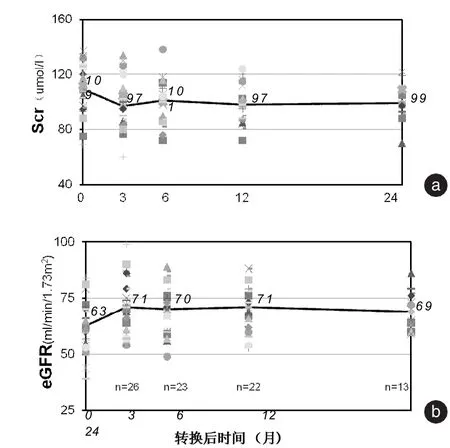
图1 主动转换组移植肾功能变化 a:Scr;b:eGFR
2.4 蛋白尿变化 ①主动转换组:所有27例受者中19例(70%)受者的尿蛋白在转换前后均保持阴性;在转换前已经有轻度蛋白尿的8例受者中:4例(50%)受者在同时应用雷公藤多甙片等辅助治疗下出现蛋白尿好转或消失;3例蛋白尿仅轻微增加(2例:-到±;1例:±到1+)。唯一明显增加的1例受者(合并糖尿病)在转换1年后24小时尿蛋白总量达2.3 g而退组,转为FK506+MMF方案。②被动转换组:退组的10例受者中有8例蛋白尿显著加重,而未退组的9例受者中仅1例出现尿蛋白轻度增加,其余受者均保持尿蛋白稳定。
2.5 转换前后PRA变化 本研究中33例受者接受了动态PRA监测,结果提示:①转换时PRA已经阳性的10例受者中,超过一半的受者(6例)在转换后出现了PRA水平明显下降甚至转阴。其中,PRA-I类抗体平均下降21%,II类抗体平均下降15%(详见表3)。其余4例受者的PRA在转换后也未出现继续升高,水平保持稳定。②转换时基础PRA阴性的22例受者中,除1例在转换后PRA-Ⅱ类抗体由2.3%上升至47.4%外,所有受者都继续保持了PRA阴性,即95%的受者在2年随访期间保持了低PRA水平。
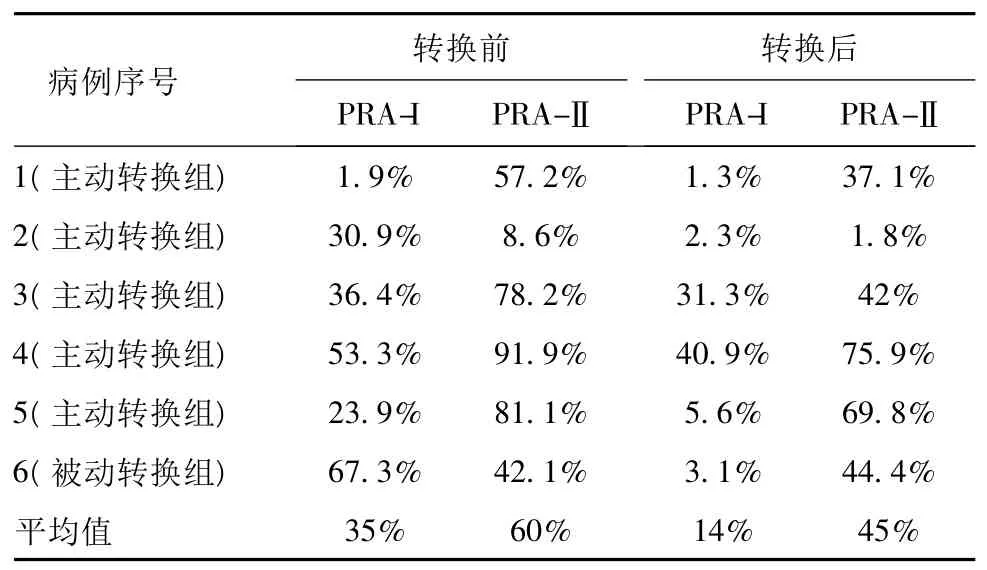
表3 PRA阳性好转病例的前后变化
2.6 急性排斥反应 无论主动转换组还是被动转换组,所有46例受者在随访期间均未出现血肌酐的急性升高,没有发生病理证实的急性排斥反应,提示本方案在预防急性排斥反应方面安全有效。
2.7 血脂变化 随访2年期间,大多数受者出现一定程度的血脂升高现象,其中14例(30%)受者需服用他汀类降脂药物治疗。转换前,所有受者的平均胆固醇和甘油三酯分别为(5.0±0.8)mmol/L和(1.3±0.6)mmol/L,转换后在降脂药物的保护下稳定在(5.2±1.3)mmol/L和(1.9±1.3)mmol/L;虽然轻微上升,但差距无统计学意义。
2.8 其它 本方案中的SRL谷值浓度控制在4~7 ng/ml,在此范围中,没有受者出现白细胞或血小板计数低于正常值下限等骨髓抑制表现,红细胞计数及血红蛋白水平也比较稳定。随访期间也未观察到口腔溃疡、肺部感染及其它严重感染发生。
3 讨论
目前,以CNIs为基础的经典三联免疫抑制方案仍是国内外肾移植术后预防排斥治疗的主流用药。然而,CNIs固有的肾毒性限制了该类药物的长期大剂量使用。SRL相比CNIs而言独具三方面优势,其一是没有肾毒性,其二是有诱导免疫耐受的潜能,其三是独特的抗肿瘤作用。但国外研究表明,若完全撤除CNIs,以SRL替代CNIs和MMF联用,仍有增加肾移植后排斥反应的风险。著名的SYMPHONY研究证实,在接受了抗IL-2R诱导治疗的肾移植受者中,初始治疗选择SRL联合MMF方案组的急性排斥发生率为37%,明显高于正常剂量或低剂量CNIs联合MMF治疗的方案组[1]。除此之外,由于SRL和MMF均有骨髓抑制的副作用,两者联用可能引起较高比例的患者出现逐渐加重的低白细胞血症、贫血或低血小板血症,导致患者不能长期耐受。因此,临床实际工作中,以SRL联合MMF并非肾移植术后免疫抑制初始治疗或维持治疗的首选方案。
我们认为,与SRL联合MMF相比,联合小剂量CNIs可能是SRL的更好选择。其一,从药理机制上SRL和环孢素在体内外均有良好的协同免疫抑制作用,能更加安全的预防急性排斥反应[2];其二,虽然CNIs具有一定肾毒性,但这种毒性作用呈剂量相关性,若能最大程度的降低CNIs药量,则能最大限度的减少CNIs慢性肾毒性,保护移植肾功能。其三,与CNIs联用时,SRL的使用剂量可以比足量稍低,控制在亚治疗剂量(谷值4~7 ng/ml)即可,这样也能同时减少SRL的副作用,如骨髓抑制和高脂血症等。上述观念已在国外的最新报道中得到了初步证实[3]。在去年的第10届美国器官移植年会上,Kahan等在大会作专题报告,联合SRL和减剂量的CsA(减量80%)作为肾移植术后初始治疗能取得良好的临床效果,相比SRL联合足量的CsA(167例)和单用足量 CsA(233例)两种治疗方案,该组病人(192例)的1~5年血肌酐明显降低(P <0.01),5年移植肾存活率也明显增高(P <0.007),提示SRL联合小剂量CsA的方案是一种非常有前途和希望的免疫抑制方案。但该研究的对象是肾移植术后初始免疫抑制治疗的病人,而没有观察术后转化为SRL联合减量CNIs治疗的病例。迄今国内更缺乏这方面报道,对中国人群中的肾移植受者采用转换治疗为SRL联合小剂量CNIs治疗能否取得较好的临床效果还不清楚。
本研究通过平均2年的临床随访表明,在移植肾功能相对正常的主动转换组,几乎所有病例(93%)在转换后早期出现移植肾功能显著改善,随访2年时,移植肾功能仍继续保持稳定。即使在移植肾功能已经明显受损的被动转换组,仍有近50%的受者从转换治疗中收益,其移植肾功能在平均2年的随访期内也得到明显的改善。这个结果充分证实了大幅度降低CNIs药量能减少肾毒性,优化移植肾功能。然而,必须指出的是,当移植肾因各种原因已经出现功能明显受损而被动转换时,临床改善的效果相对比较有限,不少移植肾的慢性病变仍然继续缓慢进展,直至失功。本研究被动转换病例中有6例受者因为不可逆的慢性移植肾功能不全而退组,其转换时的eGFR均较低,即使这些受者在转换后并未出现新发的急性排斥反应,也无PRA水平的增加,但转换治疗已不能明显改善显著受损的移植肾功能。因此,转换治疗时的基础移植肾功能很重要,应把握早期时机,在移植肾功能尚正常或只有早期轻度受损时进行为宜。
SRL可能会导致蛋白尿增加,这是一直以来限制其大量使用的主要因素之一。本研究的结果提示,只要在转换SRL前没有或仅有轻微的蛋白尿,转换后SRL的浓度控制在合理范围,则转换治疗本身不会导致明显的蛋白尿增加。但若受者已经出现明显蛋白尿,则不再适合转换为SRL,否则或迟或早会发生蛋白尿加重,其原因尚难以明确,可能与SRL使用直接相关,但也可能是病变发展所致。此外,若受者存在发生蛋白尿的高危因素时(如合并有糖尿病,或原发病为肾病综合征等),转换SRL治疗时也需谨慎。
任何一种良好的免疫抑制方案都应该能有效预防急性排斥反应的发生。本研究采用的方案中,以并不足量的雷帕鸣为主,辅以极低剂量的CsA,其维持治疗的免疫抑制强度是否足够值得关注。结果显示,所有受者不论转换前是否有过急性排斥病史、PRA是否已经阳性,在转换后的2年随访里,没有出现任何新发的病理诊断的急性排斥反应。这个结果与国外最近文献报道的SRL联合MMF转换治疗的急性排斥反应发生率(17% ~25%)相比[4~5],充分体现了 SRL 联合小剂量CNIs在预防排斥反应方面的优势。
值得一提的是,本研究还发现SRL联合小剂量CsA的转换方案对PRA水平产生了良好的正面影响。动态监测PRA变化提示,从CsA经典三联治疗转换为雷帕鸣联合小剂量CsA后,60%的PRA阳性病例出现了明显的PRA水平下降或转阴,其余病例的PRA水平也几乎未继续升高。而转换时PRA阴性的病例中,几乎所有受者能平稳保持PRA阴性。国外虽已有研究表明,SRL可能通过改变T细胞功能(如增加调节性T细胞比例)和影响树突状细胞分化等途径诱导免疫耐受,但对于其影响体液性免疫反应的研究极少[6]。我们的临床数据首次初步提示,SRL联合小剂量CsA转换治疗后,在没有急性排斥反应发生的同时,可能还对PRA阳性的免疫高风险患者具有降低PRA和体液性排斥反应风险的潜能。这个令人振奋的发现提示我们,对移植后肾功能稳定但PRA出现升高的受者主动进行本方案的转换治疗,可能将取得更令人满意的长期效果。
此外,本免疫抑制方案在经济学方面也具备一定优势。在转换前,本研究中受者平均每日服用环孢素150 mg和MMF 1 g,转换后平均每日服用环孢素50 mg和SRL 0.9 mg。以进口的新山地明、骁悉和雷帕鸣为例,受者的免疫抑制剂药费从转换前平均约4000/月下降到2200/月,在保障用药安全可靠的同时,本方案大幅减轻了我国医保局和移植受者个人的经济负担。
综上,SRL联合小剂量CsA的免疫抑制方案是一种较好的免疫抑制维持治疗方案,但在转换治疗时应把握较理想的适应症。我们建议为:①转换时移植肾功能基本正常:SCr<140μmol/L或eGFR>40 ml/min/1.73 m2;②肾移植后至少3个月以上;③无蛋白尿或24小时尿蛋白总量<300~500 mg;④转换前能耐受MMF 1g/d,而无明显骨髓抑制现象发生。⑤若PRA已出现阳性,可尽早积极转换治疗。
当然,本研究暂时缺乏与同一人群中其他免疫抑制方案(如继续CsA三联治疗组SRL)间的平行对照,也还需要更多的病例加以验证。目前我们正在回顾性收集对照组临床资料,增加符合主动转换条件的病例,并对组内受者序贯进行3~5年的长期随访,以进一步观察本方案的远期疗效。
[1]Ekberg H,Tedesco-Silva H,Demirbas A,etal.Reduced exposure to calcineurin inhibitors in renal transplantation[J].The New England journal ofmedicine,2007,357(25):2562-2575.
[2]Barten MJ,Streit F,Boeger M,etal.Synergistic effects of sirolimus with cyclosporine and tacrolimus:analysis of immunosuppression on lymphocyte proliferation and activation in ratwhole blood[J].Transplantation 2004,77(8):1154-1162.
[3]Kahan BD.Current approaches to the use of sirolimus in renal transplantation[J].Transplantation proceedings,2009,41(8):3011-3015.
[4]Lebranchu Y,Thierry A,Toupance O,etal.Efficacy on renal function of early conversion from cyclosporine to sirolimus3monthsafter renal transplantation:concept study[J].Am J Transplant,2009,9(5):1115-1123.
[5] Guba M,Pratschke J,Hugo C,etal.Renal function,efficacy,and safety of sirolimus and mycophenolate mofetil after short-term calcineurin inhibitor-based quadruple therapy in de novo renal transplant patients:one-year analysis of a randomized multicenter trial[J].Transplantation,2010,90(2):175-183.
[6]Turnquist HR,Raimondi G,Zahorchak AF,etal.Rapamycin-conditioned dendritic cells are poor stimulators of allogeneic CD4+T cells,but enrich for antigen-specific Foxp3+T regulatory cells and promote organ transplant tolerance[J].J Immunol,2007,178(11):7018-7031.
