从钼酸铵溶液中除去砷的研究
2011-09-17
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
近年来,镍钼矿作为一种新型钼矿资源引起了众多研究者们的关注[1−6]。镍钼矿是复杂多金属矿物,约含有钼4%(质量分数,下同),镍3%和砷0.8%等[7]。矿中的钼主要以无定形的胶硫化钼存在[8],因此,镍钼矿具有晶化程度低、化学活性高的特点。鉴于此,Zhao等[9]提出了碱性常压空气氧化法浸出镍钼矿。在浸出过程中,钼、砷、钨、钒一起进入浸出液,镍、铜、锌、镁等则进入渣中。在后续N235萃取提钼过程中,砷与钼一起进入有机相,氨水反萃时,又一起进入反萃液中。从钼酸盐溶液中除砷的方法主要有沉淀法、吸附法、萃取法以及离子交换法等。采用铁盐吸附法[10−11]除砷时,钼损失较大且吸附剂的再生及回收较为困难。采用离子交换法[12]难以处理砷含量较高以及成分复杂的溶液;采用伯铵和 TBP萃取除砷[13]则存在砷萃取率不高且钼损失较大的缺点。本文作者采用铵镁盐沉淀法[14]除砷。反萃液经双氧水氧化后,加入氯化镁,砷以砷酸铵镁沉淀形式除去。除砷后的钼酸铵溶液中残留一定量的镁。采用阳离子交换[15]除去溶液中过量的镁后,可使钼酸铵产品中镁含量不超标。
1 实验
1.1 实验原料
实验原料为六水合氯化镁、724弱酸性阳离子树脂、732强酸性阳离子树脂(使用前均转为铵型)、浓盐酸、氨水以及处理镍钼矿所得的钼酸铵溶液。钼酸铵溶液主要成分(质量浓度)如表1所示。

表1 钼酸铵溶液主要成分Table 1 Chemical composition of ammonium molybdate solution g/L
1.2 实验步骤
取一定体积的钼酸铵溶液,然后加入300 g/L氯化镁溶液,恒温反应一定时间后,抽滤。滤渣用蒸馏水洗涤。除砷后的钼酸铵溶液用盐酸或氨水调节pH,再流入装有30 mL离子交换树脂的交换柱中动态吸附除镁(离子交换柱直径和高分别为1.0 cm和40 cm),收集交后液并分析镁浓度。负载树脂经蒸馏水洗涤后,用一定浓度的盐酸溶液解析,并分析解吸液中镁浓度。砷和镁用ICP-AES检测,钼用硫氰酸盐分光光度法检测。
2 结果与讨论
2.1 铵镁盐沉淀法除砷
2.1.1 氯化镁用量对除砷的影响
取100 mL钼酸铵溶液,其pH为9.3,分别加入氯化镁理论量的1.0,1.2,1.4,1.6,1.8和2.0倍。在温度为297 K、反应时间为30 min的条件下,氯化镁用量(即氯化镁加入量与其理论量之比)对除砷的影响如图1所示。
图1表明:氯化镁用量越大,则钼酸铵溶液中残留的砷质量浓度越小;当氯化镁用量为理论量的 1.2倍时,溶液中残留的砷质量浓度为46.7 mg/L,经分析,钼损失率为0.34%,溶液中残留的镁质量浓度为0.52 g/L;继续增大氯化镁用量,溶液中砷含量下降逐渐趋于平缓,但溶液中残留的镁则几乎呈直线上升;当氯化镁用量为1.6倍理论量时,镁质量浓度达1.8 g/L左右,对后续除镁工序不利。因此,选择加入1.2倍理论量的氯化镁。
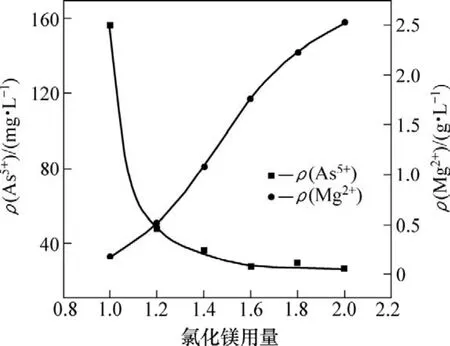
图1 氯化镁用量对溶液砷和镁质量浓度的影响Fig.1 Influence of magnesium chloride dosage on mass concentration of arsenic and Mg
2.1.2 反应时间对砷的影响
取100 mL的钼酸铵溶液,其pH为9.3,加入氯化镁理论值的1.2倍。在温度为297 K时,反应时间对砷质量浓度的影响如图2所示。
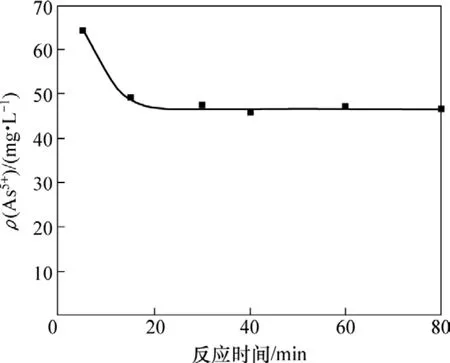
图2 反应时间对溶液砷质量浓度的影响Fig.2 Influence of reaction time on arsenic mass concentration
由图2可知:镁盐沉淀法除砷的反应速度很快;当反应时间为 15 min时,溶液中砷质量浓度下降至50 mg/L左右;继续延长反应时间,砷含量变化不大。为了确保除砷的效果,本实验选取反应时间为30 min。
2.1.3 反应温度对除砷的影响
取100 mL的钼酸铵溶液,其pH为9.3,加入1.2倍理论量的氯化镁。在反应时间30 min时,温度对除砷的影响如图3所示。
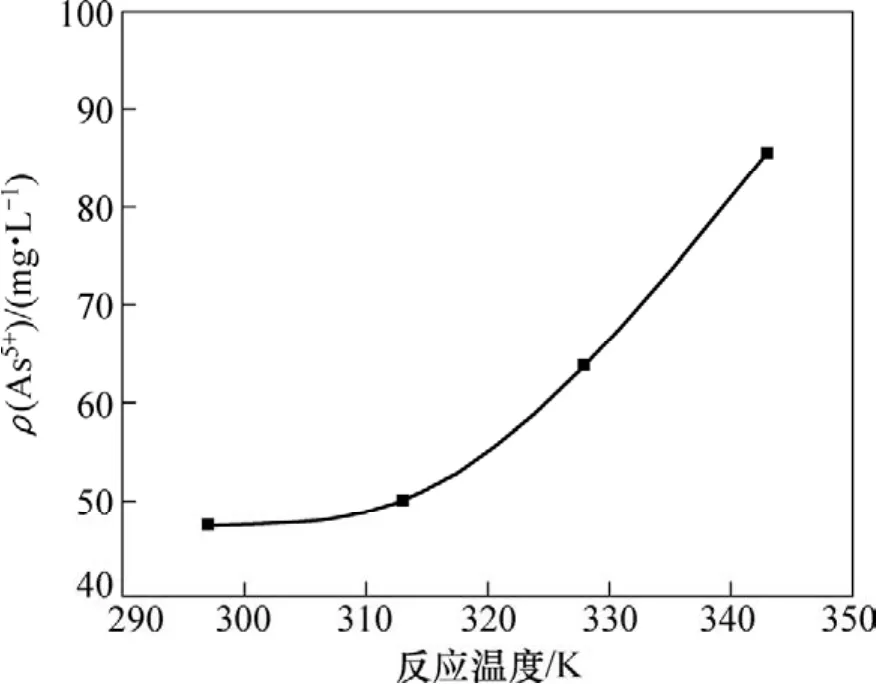
图3 反应温度对溶液砷质量浓度的影响Fig.3 Influence of reaction temperature on arsenic mass concentration
从图3可知:钼酸铵溶液中残留砷的量随反应温度的升高而增大;当反应温度由297 K升高343 K时,溶液中残留砷质量浓度达到由47.6 mg/L增大至85.6 mg/L;温度越高,氨气挥发加剧。因此,反应选择在297 K下进行较好。
2.2 离子交换法除镁
由上述结果可知:加入氯化镁理论量的1.2倍除砷后的钼酸铵溶液中,镁残留质量浓度为 0.52 g/L。溶液中镁质量浓度过高,在酸沉结晶钼酸铵时,会造成产品中镁质量浓度超标。因此,本研究选用离子交换法除去钼酸铵溶液中过量的镁。
2.2.1 树脂的筛选
本实验选用732强酸性阳离子交换树脂和724弱酸性阳离子交换树脂进行吸附除镁实验。钼酸铵料液中,Mo和Mg质量浓度分别为92和0.5 g/L,pH为9.2。2种树脂体积均为30 mL,料液流速为1.0 mL/min。2种树脂吸附镁的流出曲线如图4所示。
由图4可知:732强酸树脂吸附镁的效果远不如724弱酸树脂的效果好。因此,后续离子交换吸附除镁时全部选用724弱酸性树脂进行实验。
2.2.2 料液流速对吸附镁效果的影响
在钼酸铵料液中,Mo和Mg质量浓度分别为92和0.5 g/L,pH为9.2,树脂体积为30 mL,料液流速分别为3.0,1.5和1.0 mL/min,实验结果如图5所示。
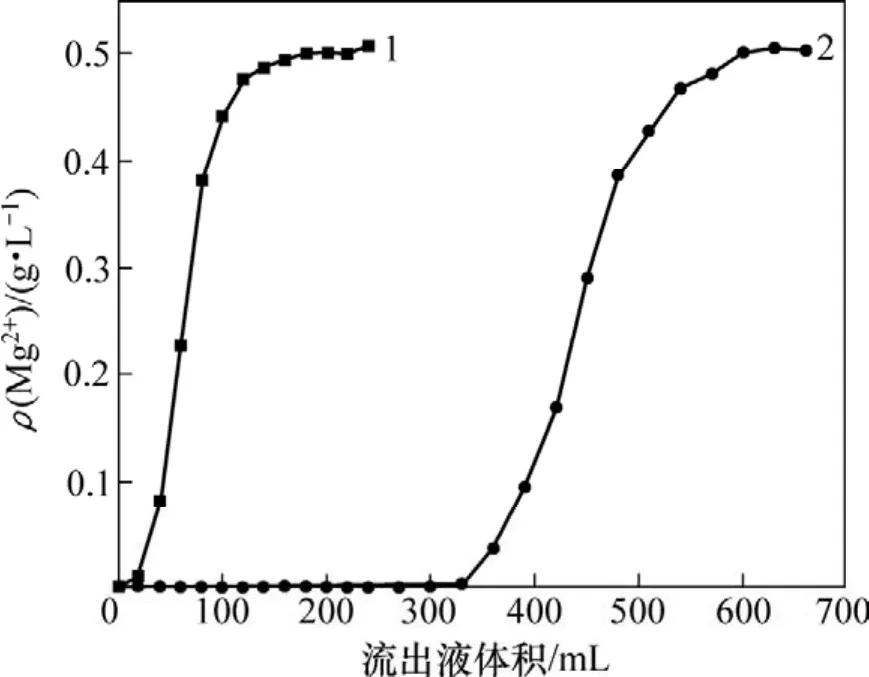
图4 2种树脂的镁流出曲线Fig.4 Adsorption curves of two resins for Mg
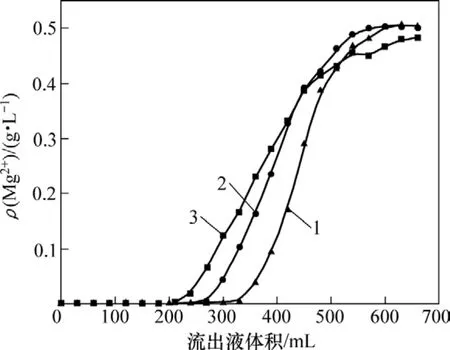
图5 不同料液流速时镁流出曲线Fig.5 Adsorption curves of different flow rates for Mg
从图5可见:料液流速越慢即料液与树脂接触时间越长,则吸附镁的效果越好;料液流速过快,则溶液中的镁离子与树脂上的离子还来不及交换完全,便流入下一层树脂中,从而容易造成过早穿漏。取交后液中镁质量浓度为72 mg/L为穿漏点,则当料液流速分别为1.0,1.5和3.0 mL/min时,树脂的操作交换容量分别6.58,5.72和5.61 g/L。本实验选取流速为1.0 mL/min。
2.2.3 料液pH对吸附镁效果的影响
钼酸铵料液中,Mo和Mg质量浓度分别为92和0.5 g/L,树脂体积为30 mL,料液流速为1 mL/min,pH分别为9.2,8.3和7.2,料液pH对镁吸附效果的影响如图6所示。
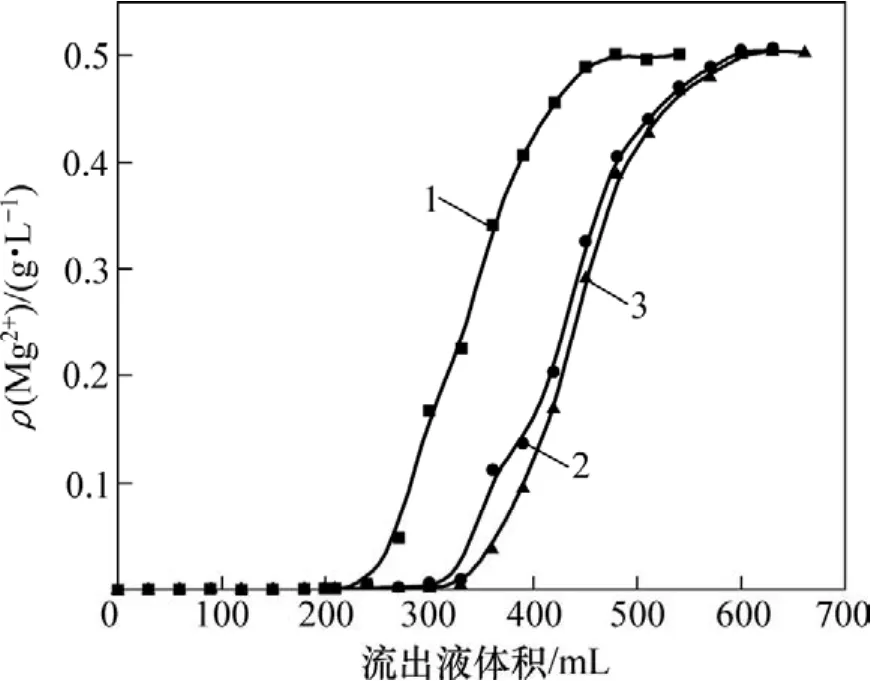
图6 不同pH时镁流出曲线Fig.6 Adsorption curves of different pH values for Mg
由图6可知:随着溶液pH的减小,树脂吸附镁的效果变差。所用树脂为弱酸性树脂,溶液 pH高则有利于树脂上可交换离子的电离,有利于镁的吸附;此外,pH越低,则溶液中竞争离子NH4+质量浓度越高,不利于镁的吸附。除砷后的钼酸铵溶液的pH为9.2左右,因此,选择溶液 pH=9.2时吸附镁效果较好。
2.2.4 HCl浓度对镁解吸效果的影响
吸附镁后的树脂经蒸馏水洗涤后,分别用浓度为0.5,1.0和2.0 mol/L的HCl溶液解吸,解吸液流速为1 mL/min,解吸曲线如图7所示。
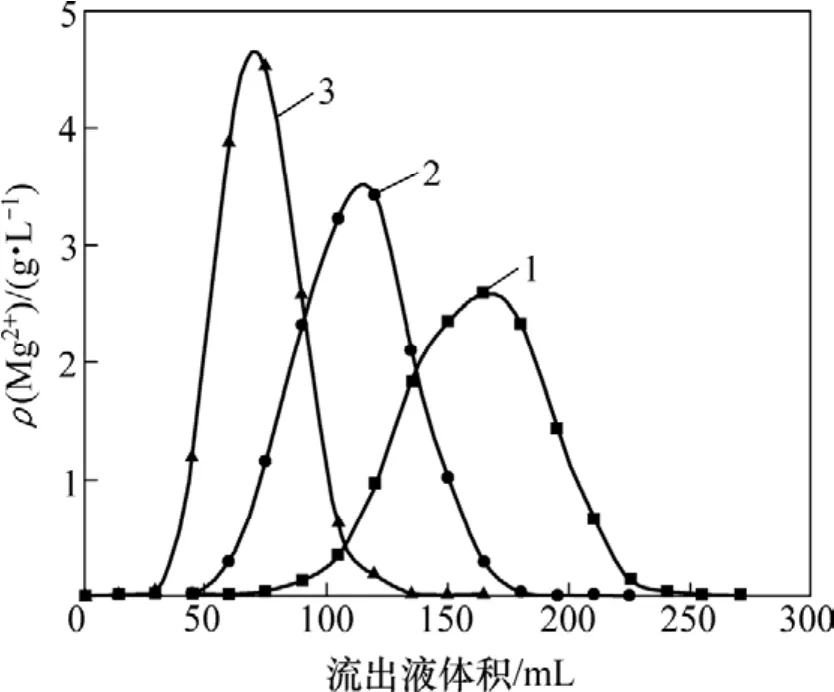
图7 不同浓度HCl时镁的解吸曲线Fig.7 Desorption curves of different HCl concentrations for Mg
由图7可以看出:负载树脂中的镁用0.5 mol/L的盐酸就可以解吸完全,但解吸液体积较大,而且所得解吸液中镁质量浓度较低。解吸液质量浓度越高;解吸曲线峰越窄,所得高峰解吸液中镁质量浓度更高。但解吸剂质量浓度不宜过高,否则树脂容易发生严重缩变而破裂。用2 mol/L HCl解吸时,解吸液树脂体积的5倍可将吸附的镁几乎完全解析,并同时实现树脂的再生。
3 结论
(1) 采用铵镁盐沉淀法除去钼酸铵溶液中的砷是可行的。在氯化镁用量为理论量的1.2倍、反应时间为30 min、反应温度为297 K的条件下,钼酸铵溶液中的砷质量浓度由8.75 g/L降低至46.7 mg/L,溶液中残留的镁质量浓度为0.52 g/L,钼损失率为0.34%。
(2) 选用 724弱酸性阳离子交换树脂吸附除砷后溶液中残留的 Mg2+。当溶液pH为 9.2、镁质量浓度为0.5 g/L,料液流速为1 mL/min,交换后液体积为树脂体积的17倍时,交换后液中镁质量浓度为72 mg/L,树脂的操作交换容量为6.58 g/L湿树脂。负载镁的树脂,用2 mol/L HCl可将吸附的镁几乎完全解吸。
[1] 李青刚, 肖连生, 张贵清, 等. 镍钼矿生产钼酸铵全湿法生产工艺及实践[J]. 稀有金属, 2007, 31: 85−89.LI Qing-gang, XIAO Lian-sheng, ZHANG Gui-qing, et al.Process and practice of ammonium molybdate production from Ni-Mo ore by hydrometallurgy[J]. Chinese Journal of Rare Metals, 2007, 31: 85−89.
[2] WANG Ming-yu, WANG Xue-wen, LIU Wan-li. A novel technology of molybdenum extraction from low grade Ni-Mo ore[J]. Hydrometallurgy, 2009, 97: 126−130.
[3] ZHAO Zhong-wei, LI Jiang-tao, CAO Cai-fang, et al. Recovery and purification of molybdenum from Ni-Mo ore by direct air oxidation in alkaline solution[J]. Hydrometallurgy, 2010, 103:68−73.
[4] HOU Xiao-chuan, XIAO Lian-sheng, GAO Cong-jie, et al.Kinetics of leaching selenium from Ni-Mo ore smelter dust using sodium chlorate in a mixture of hydrochloric and sulfuric acids[J]. Hydrometallurgy, 2010, 104: 76−80.
[5] LI Min-ting, WEI Chang, FAN Gang, et al. Acid leaching of black shale for the extraction of vanadium[J]. Hydrometallurgy,2010, 95: 62−67.
[6] Anjum F, Bhatti H N, Ghauri M A. Enhanced bioleaching of metals from black shale using ultrasonics[J]. Hydrometallurgy,2010, 100: 122−128.
[7] 鲍正襄, 万榕江, 包觉敏. 湘西北镍钼矿床成矿特征与成因[J]. 湖北地矿, 2001, 15(1): 14−21.BAO Zheng-xiang, WAN Rong-jiang, BAO Jue-min.Metallogenic characteristics and genesis of the Ni-Mo deposits in northwestern Hunan[J]. Hubei Geology & Mineral Resources,2001, 15(1): 14−21.
[8] 张爱云, 伍大茂, 郭丽娜, 等. 海相黑色页岩建造地球化学与成矿意义[M]. 北京: 科学出版社, 1987: 172−180.ZHANG Ai-yun, WU Da-mao, GUO Li-na, et al. The geochemistry of marine black shale formation and its metallogenic significance[M]. Beijing: Science Press, 1987:172−180.
[9] ZHAO Zhong-wei, ZHANG Gang, HUO Guang-sheng, et al.Kinetics of atmospheric leaching molybdenum from metalliferous black shales by air oxidation in alkali solution[J].Hydrometallurgy, 2009, 97: 233−236.
[10] Buswell A M, Gore R C, Hudson H E , et al. Water problem in analysis and treatment[J]. Water Works Assoc, 1943, 35:1303−1311.
[11] 吕荧, 孙放. Fe(OH)3吸附法从高钨钼酸钠溶液中分离钨钼的研究[J]. 稀有金属与硬质合金, 2005, 33(3): 1−3.LÜ Ying, SUN Fang. Study of separation of tungsten and molybdenum from high W-containing sodium molybdate solution by Fe(OH)3adsorption[J]. Rare Metals and Cemented Carbides, 2005, 33(3): 1−3.
[12] Suzuki T M, Bomani J O, Matsunaga H, et al. Removal of As( Ⅲ) and As(V) by a porous spherical resin loaded with monoclinic hydrous zirconium oxide[J]. Chemistry Letters,1997(1): 119−125.
[13] ZHAO You-cai, CHEN Jia-yong. Extraction of phosphorus,arsenic, and/or silica from sodium tungstate and molybdate solutions with primary amine and tributyl phosphate as solvents:I. Synergistic extraction and separation of phosphorus, arsenic and silica from tungstate and molybdate solutions[J].Hydrometallurgy, 1996, 42: 313−324.
[14] 李洪桂. 稀有金属冶金学[M]. 北京: 冶金工业出版, 1993:83−85.LI Hong-gui. Metallurgy of rare metalls[M]. Beijing:Metallurgical Industry Press, 1993: 83−85.
[15] Huggins D K, Queneau P B, Ziegler R C, et al. Ion exchange purification of ammonium molybdate solutions[J].Hydrometallurgy, 1983, 6: 63−73.
