以硫酸盐亚型盐湖卤水为原料制备高纯轻质氧化镁
2011-09-17
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
轻质氧化镁是一种视比容大、质轻疏松、难溶于水的白色粉末,在陶瓷、耐火制品、各种黏合剂、油漆填料、橡胶的促进剂与活化剂及医药、玻璃、塑料、食品行业用途较广[1−3]。目前,国内生产轻质氧化镁的主要方法是白云石碳化法,但该方法产品含有较高的CaO,氧化镁的含量(质量分数)一般小于 96%,而进一步提纯又将大幅增加成本,且设备投资大,严重影响了我国轻质氧化镁在国际市场上的竞争力[4−7]。新疆罗布泊盐湖是我国继青海察尔汗盐湖之后又一个大的钾肥(硫酸钾)生产基地, 在生产钾肥的同时排出大量富含氯化镁和硫酸镁的老卤,若不加以利用, 则将给盐湖的生态造成严重破坏,同时造成资源的严重浪费[8−10]。在此,本文作者以新疆罗布泊盐湖卤水为原料,确立了氨法沉镁—碳酸氢铵碳化—煅烧制备高纯轻质氧化镁的新工艺。
1 实验
1.1 基本原理
1.1.1 沉镁
经过滤除去悬浮物杂质后的新疆罗布泊盐湖卤水主要成分是氯化镁和硫酸镁,在氨的作用下生成Mg(OH)2和NH4Cl,主要反应式如下:
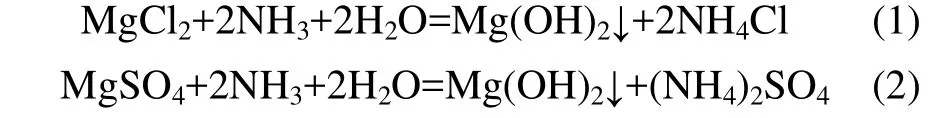
1.1.2 碳化
由于卤水中含有大量的 SO42−和 B4O72−,B4O72−被氢氧化镁吸附,SO42−夹杂在氢氧化镁沉淀中,导致氢氧化镁煅烧得到的氧化镁产品中含有较高的 B和S,达不到国家标准,需进一步碳化除杂。以NH4HCO3为碳化剂,将氢氧化镁转化为碱式碳酸镁,碱式碳酸镁对 B4O72−没有吸附作用,以达到除去 Mg(OH)2中SO42−和 B4O72−的效果。
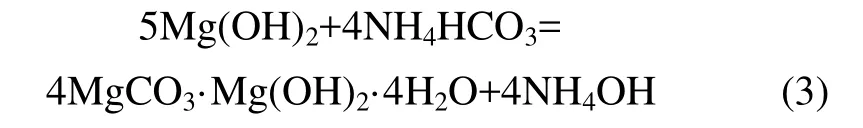
其中式(3)式是分3步进行:
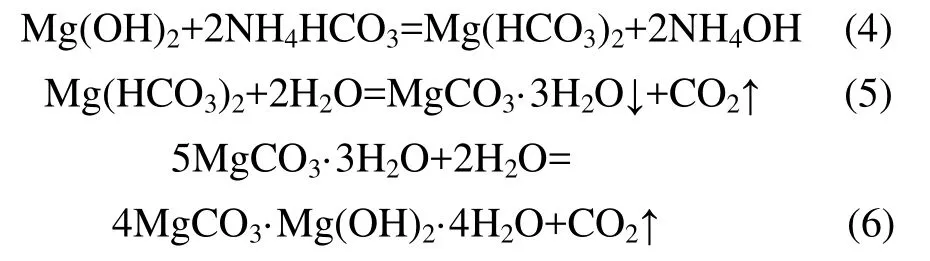
在碳化过程中,Mg(OH)2按照式(4)和(5)转化为MgCO3·3H2O的速度非常快,最后MgCO3·3H2O热解为 4MgCO3·Mg(OH)2·4H2O 为 反应 的 控制 步 骤。Mg(HCO3)2和 MgCO3·3H2O中 MgO的质量分数分别为27.5%和29.1%,比4MgCO3·Mg(OH)2·4H2O的MgO理论质量分数43.1%低,故以产品中MgO的质量分数表示碳化率。
1.1.3 煅烧
碱式碳酸镁在高温下煅烧,可以转变成轻质氧化镁:
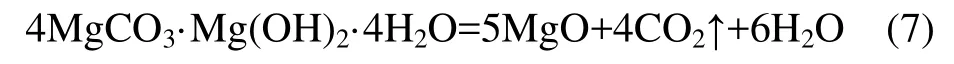
1.2 原料与仪器
原料有:新疆罗布泊盐湖卤水(见表1),氨水、碳酸氢铵、氢氧化钠、碳酸氢钠、乙二胺四乙酸、氯化铵。除了卤水外,其余试剂全部为分析纯试剂。卤水经过过滤除去不溶物后使用。
仪器有:SHIMADZU AUY120电子分析天平(上海肯强仪器有限公司制造);101A−2型鼓风干燥箱(上海新诺仪器有限公司制造);SK3−2−10−4节能程控管式炉(杭州卓驰仪器有限公司制造);DF−1集热式恒温磁力搅拌器(南京创睿仪器有限公司制造);SHZ−D(III)真空过滤机(深圳市三利化学品有限公司制造);Rigaku D·max 2550型X线衍射仪品(日本理学制造)。

表1 新疆罗布泊盐湖卤水成分(质量浓度)Table 1 Composition of Lop Nur Salt Lake brine,Xinjiang g/L
1.3 实验方法
取50 mL经过滤的卤水加入到500 mL三口烧瓶中,在一定温度下,采用滴液漏斗逐滴加入氨水,边加边搅拌。反应一段时间后,过滤、洗涤、烘干得到氢氧化镁。取3 g上述氢氧化镁,加入200 mL左右的纯水调浆,用水浴加热到80 ℃,加入一定量碳酸氢铵溶液进行反应。反应一段时间后,经过滤、烘干得到碱式碳酸镁,然后,在一定温度下放入管式炉中煅烧得到轻质氧化镁,其工艺流程见图1。
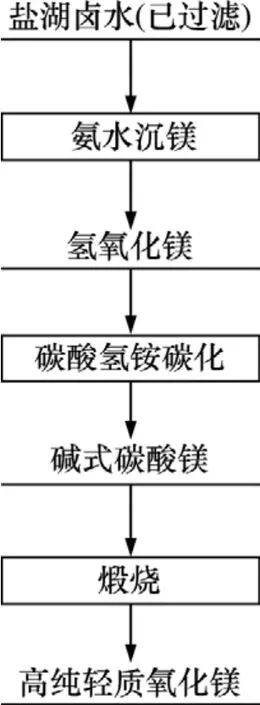
图1 高纯轻质氧化镁制备工艺流程图Fig.1 Flow chart for preparation of high-purity light magnesium oxide
2 实验结果与讨论
2.1 沉镁反应
根据文献和条件试验结果,确定沉淀镁得到氢氧化镁的最佳条件:氨水浓度为2.5 mol/L,反应温度为50 ℃,反应时间为1.5 h。图2所示为所得氢氧化镁的XRD图谱。由图2可知:该产品为Mg(OH)2,无其他杂相峰。氢氧化镁产品经煅烧得到氧化镁,经化学分析,氧化镁的纯度<97%,且氧化镁的视比容只有 4 mL/g左右,不符合轻质氧化镁的要求。因此,需用碳酸氢铵进一步碳化Mg(OH)2。
2.2 碳化反应
2.2.1 碳酸氢铵过量系数与碳化率的关系
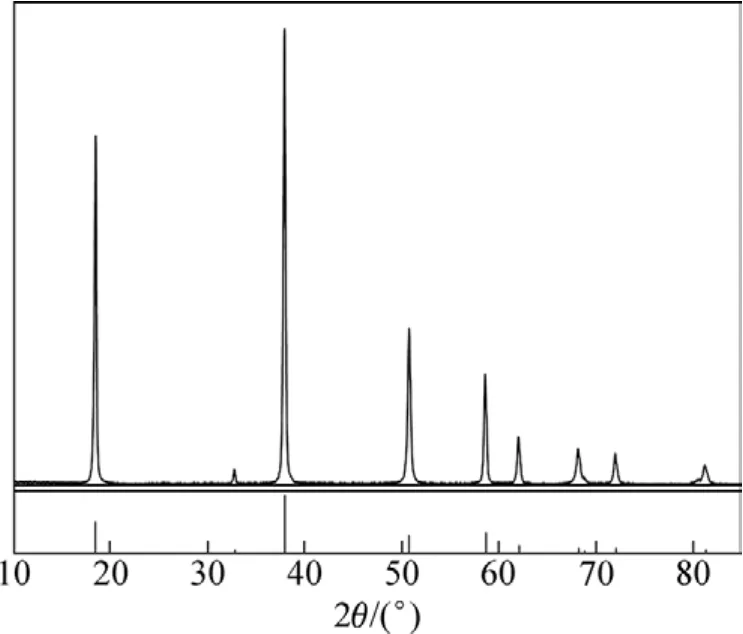
图2 氢氧化镁的XRD图谱Fig.2 XRD pattern of magnesium hydroxide
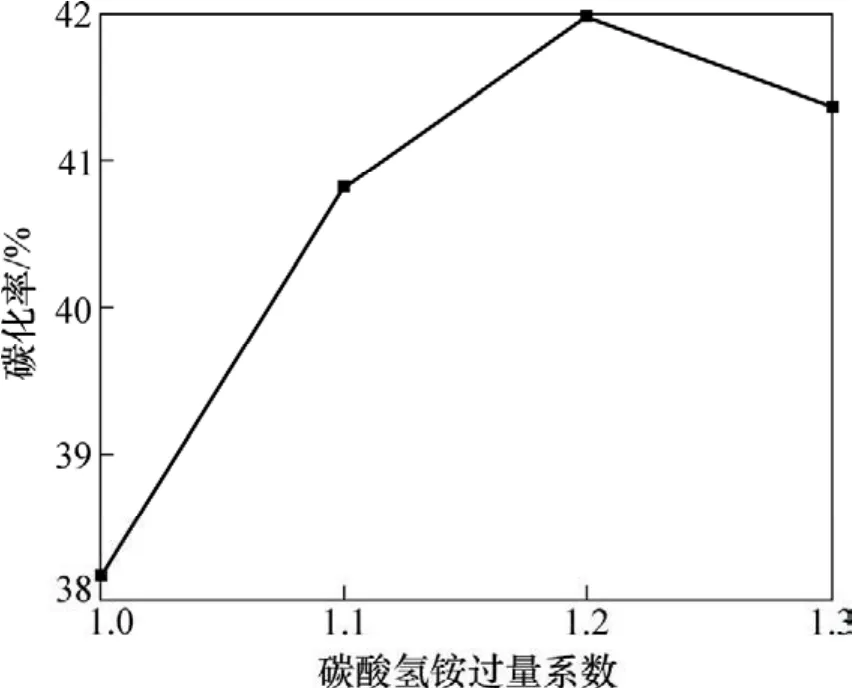
图3 碳酸氢铵过量系数与碳化率的关系Fig.3 Relationship between excessive coefficient of ammonium bicarbonate and carbonization ratio
图3所示为碳酸氢铵过量系数与碳化率的关系。由图3可知:当过量系数为1.0~1.2时,碳化率随过量系数的增加而增加,当过量系数增加到1.3时,碳化率稍有下降。碳酸氢铵不足,氢氧化镁转化不完全,碳酸氢铵过多,碳酸氢铵溶解不完全,影响产品纯度、视比容。实验结果表明:碳酸氢铵过量系数为1.2时比较合适。
2.2.2 碳酸氢铵浓度与碳化率的关系
图4所示为碳酸氢铵浓度与碳化率的关系。由图4可知:碳化率随着碳酸氢铵浓度的升高而降低。因为碳酸氢铵过量系数不变,碳酸氢铵浓度的升高即是液固比的减小,所以,碳化率会随之减小。但是,碳酸氢铵浓度太低,不利于生产高视比容的碱式碳酸镁,不利于制备轻质氧化镁。实验结果表明:碳酸氢铵浓度为1 mol/L时比较合适。
2.2.3 反应温度与碳化率的关系
图5所示为反应温度与碳化率的关系。由图5可知:
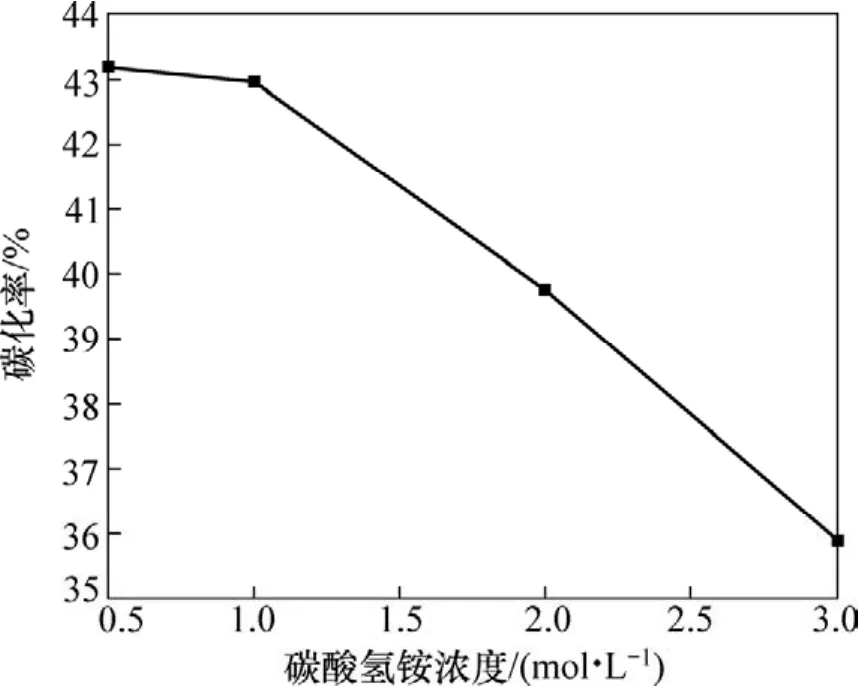
图4 碳酸氢铵浓度与碳化率的关系Fig.4 Relationship between concentration of ammonium bicarbonate and carbonization ratio
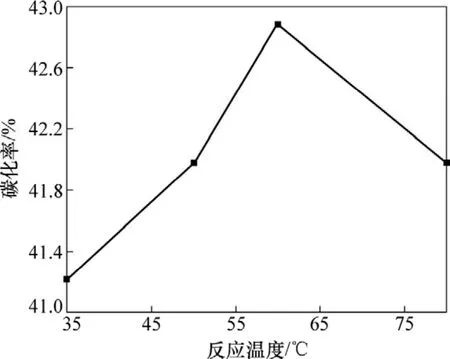
图5 反应温度与碳化率的关系Fig.5 Relationship between temperature of reaction and carbonization ratio
温度在35 ℃到60 ℃时,温度越高,碳化率越高。这是因为碳化反应是吸热反应,温度越高,化学反应速率越快,碳化率越高。当温度升到80 ℃时,过高的温度加速碳酸氢铵分解,导致碳化率降低。实验结果表明:最适宜的反应温度为60 ℃。
2.2.4 反应时间与碳化率的关系
图6所示为反应时间与碳化率的关系。由图6可知:碳化率随着反应时间的延长而增加,而1.5 h之后,碳化率趋于稳定。考虑到生产成本,反应时间为1.5 h时比较合适。
2.2.5 碱式碳酸镁的XRD分析
通过前面的条件试验,确定碳化反应最佳工艺条件为:碳酸氢铵过量系数为 1.2,碳酸氢铵浓度为 1 mol/L,反应温度为60 ℃,反应时间为1.5 h。此工艺条件下所制得的碱式碳酸镁样品XRD图谱如图7所示。由图7可知:得到的产品为碱式碳酸镁,组成为4MgCO3·Mg(OH)2·4H2O,与文献[11−15]中结果吻合。
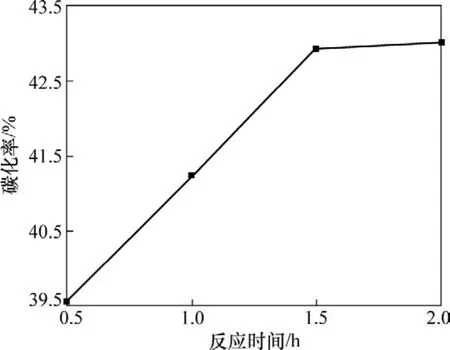
图6 反应时间与碳化率的关系Fig.6 Relationship between time of reaction and carbonization ratio
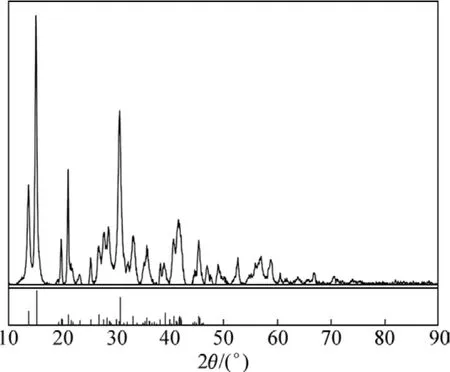
图7 碱式碳酸镁XRD图谱Fig.7 XRD pattern of basic magnesium carbonate
2.3 碱式碳酸镁的煅烧
在煅烧时间为2 h,保温时间为90 min,煅烧温度为950 ℃,升温速率为6 ℃/min的条件下煅烧碱式碳酸镁,图8所示为所得氧化镁的XRD图谱。
由图8可见:得到的产品为氧化镁,晶形好。将氨水沉镁反应制备的 Mg(OH)2进行煅烧得到 MgO,标号为1,经碳化反应后煅烧得到的MgO,标号为2。为了对比,将它们一起进行部分元素的ICP分析检测,结果如表2所示。由表2可见:1号MgO中硼、硫、钠杂质含量较高,经碳化后,硼的量大大减少,硫的量减少了一半。分析1和2号MgO纯度分别为95.95%和99.13%;视比容分别为5 mL/g和10 mL/g。表3所示为 2号轻质氧化镁质量分析检测结果和HG1−324−77特级指标的对比,可知:轻质氧化镁产品质量达到了HG1−324−77特级指标。以上结果说明碳化法是较好的除S 和B的途径。
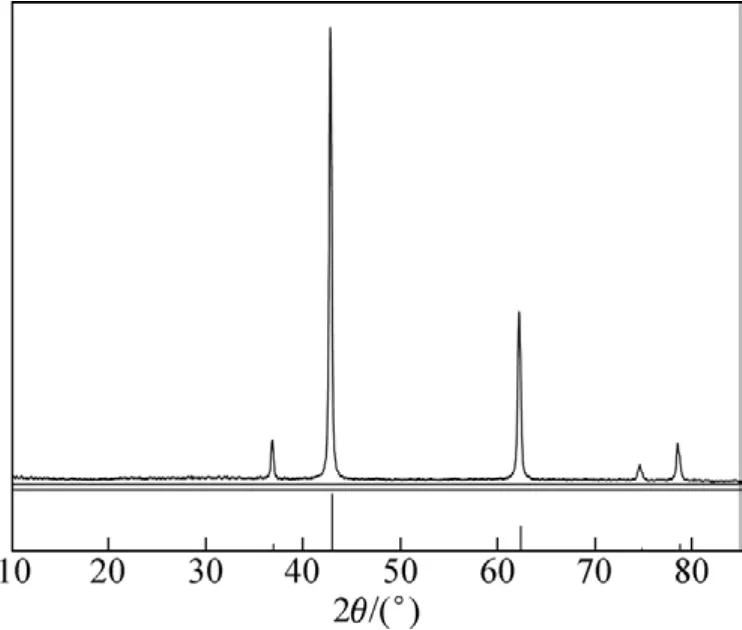
图8 MgO的XRD图谱Fig.8 XRD pattern of magnesium oxide
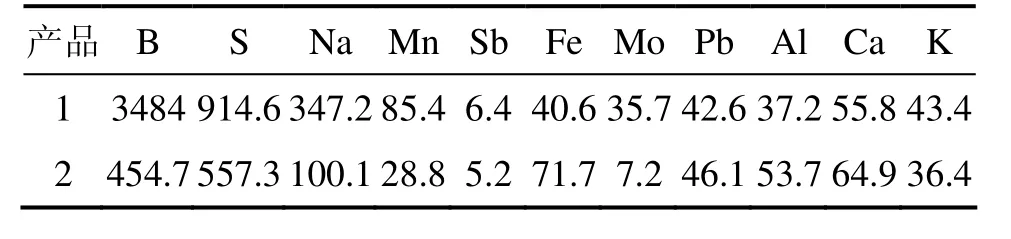
表2 MgO的ICP−AES分析结果Table 2 ICP−AES analysis results of MgO μg/g
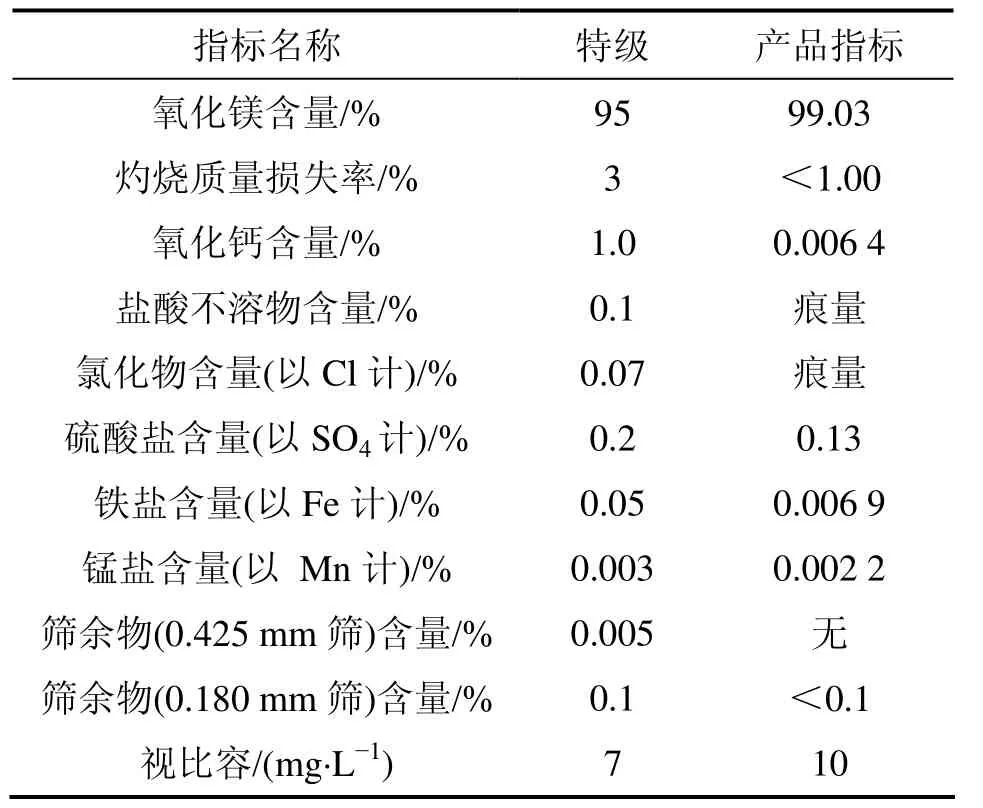
表3 轻质氧化镁的质量分析结果Table 3 Quantity analysis results of light magnesium oxide
3 结论
(1) 以新疆罗布泊盐湖卤水为原料,采用氨法沉镁−碳酸氢铵碳化−煅烧的工艺制备轻质氧化镁。沉镁最佳工艺参数为:氨水浓度为2.5 mol/L,反应温度为50 ℃,反应时间为1.5 h。碳化最佳工艺参数为:碳酸氢铵过量系数为1.2,碳酸氢铵浓度数为1 mol/L,反应温度为60 ℃,反应时间为1.5 h。煅烧最佳工艺参数为:煅烧时间为2 h,保温时间为90 min,煅烧温度为950 ℃,升温速率为6 ℃/min。在上述最佳工艺条件下获得氧化镁产品纯度>99%,视比容为 10 mL/g,主要指标达到HG1−324−77特级指标。
(2) 此工艺路线制备氧化镁,工艺简单,流程短,产品纯度高,容易实现产业化。同时,具有原材料消耗少、镁资源利用率高、产品质量稳定等优点,应用前景广阔。
[1] 胡庆福. 我国轻质碳酸镁、轻质氧化镁生产现状及其发展[J].化工科技市场, 2001(6): 19−22.HU Qing-fu. Production actualities and developments of light magnesium carbonate and light magnesium oxide[J]. Market of Science and Technology of Engineering Chemistry, 2001(6):19−22.
[2] Choudhary V R, Pataskar S G, Zope G B, et al. Surface properties of magnesium oxide obtained from basic magnesium carbonate:influence of preparation conditions of magnesium carbonate[J]. J Chem Tech Biotechnol, 1995, 64: 407−413.
[3] 张从良, 李澎涛, 张子宇, 等. 碳氨双循环法自白云石制备轻质氧化镁[J]. 郑州工业大学学报, 1997, 18(4): 40−46.ZHANG Cong-liang, LI Peng-tao, ZHANG Zi-yu, et al. Making light magnesium oxide from dolomite by recycling CO2and NH3[J]. Journal of Zhengzhou University of Technology, 1997,18(4): 40−46.
[4] 李俊梅, 张志刚, 宋玉军. 轻质氧化镁制备新工艺条件优化[J]. 化工冶金, 1998, 19(1): 68 −72.LI Jun-mei, ZHAO Zhi-gang, SONG Yu-jun. Optimization of the new technology for preparing light magnesium oxide[J].Engineering Chemistry & Metallurgy, 1998, 19(1): 68−72.
[5] 徐徽, 蔡勇, 石西昌, 等. 水镁石制取高纯氧化镁的研究[J].湖南师范大学自然科学学报, 2006, 3(1): 52−55.XU Hui, CAI Yong, SHI Xi-chang, et al. Study on preparation of high-purity magnesia from brucite[J]. Journal of Natural Science of Hunan Normal University, 2006, 3(1): 52−55.
[6] 胡庆福, 宋丽英, 胡晓湘. 卤水−碳酸铵法制取活性氧化镁工艺研究[J]. 盐业与化工, 2007, 36(6): 17−20.HU Qing-fu, SONG li-ying, HU Xiao-xiang. Study on technique of producing active magnesium oxide with bittern-ammonium carbonate method[J]. Journal of Salt and Chemical Industry,2007, 36(6): 17−20.
[7] 陈侠, 陈丽芳. 用六水氯化镁工业化生产高纯氧化镁的新工艺[J]. 盐业与化工, 2008, 37(3): 13−16.CHEN Xia, CHEN Li-fang. New process for industrial production of high-purity magnesium oxide from magnesium chloride hexahydrate[J]. Journal of Salt and Chemical Industry,2008, 37(3): 13−16.
[8] 李浩, 唐中凡, 刘传福, 等. 新疆罗布泊盐湖卤水资源综合开发研究[J]. 地球学报, 2008, 8(4): 517−524.LI Hao, TANG Zhong-fan, LIU Chuan-fu, et al. Comprehensive exploitation and research of brine resources in the Lop Nur Salt Lake, Xinjiang[J]. Acta Geoscientica Sinica, 2008, 8(4):517−524.
[9] 许荣辉, 李海民. 高纯氧化镁制备原理初探[J]. 盐湖研究,2003, 11(4): 39−41.XU Rong-hui, LI Hai-min. The principles in preparing of high purity magnesium oxide[J]. Journal of Salt Lake Research, 2003,11(4): 39−41.
[10] 徐日瑶, 刘宏专. 盐湖水氯镁石制取金属镁及高纯镁砂的生产技术[J]. 盐湖研究, 2003, 11(2): 46−50.XU Ri-yao, LIU Hong-zhuan. Technology for the production of magnesium and high-purity magnesite clinker using bischofite from Salt Lake[J]. Journal of Salt Lake Research, 2003, 11(2):46−50.
[11] 隋升, 曹广益. 氧化镁生产工艺的改进[J]. 上海交通大学学报, 2001, 35(4): 595−598.SUI Sheng, CAO Guang-yi. Improvement on the process of MgO manufacture[J]. Journal of Shanghai Jiaotong University,2001, 35(4): 595−598.
[12] DAI Hou-qian. Studies on the decomposition reaction and molecule composition of light magnesium carbonate with thermal analyzer[J]. Journal of Sichuan Normal University:Natural Science, 1998, 21(5): 545−548.
[13] 王锋, 李稳宏, 刘焕强, 等. 高活性氧化镁生产新工艺研究[J].石化技术与应用, 2002, 20(3): 152−154.WANG Feng, LI Wen-hong, LIU Huan-qiang, et al. A new process for production of high active magnesium[J].Petrochemical Technology & Application, 2002, 20(3):152−154.
[14] 徐徽, 苏元智, 李新海, 等. 盐湖水氯镁石制取轻质氧化镁工艺[J]. 中国有色金属学报, 2004, 14(10): 1776−1781.XU Hui, SU Yuan-zhi, LI Xin-hai, et al. Technology of preparation for light magnesium oxide from bischofite[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(10):1776−1781.
[15] 高洁, 狄晓亮, 李昱昀. 氧化镁的发展趋势及其生产方法[J].化工生产与技术, 2005, 12(5): 36−41.GAO Jie, DI Xiao-liang, LI Yu-yun. Development trend and production methods of magnesium oxide[J]. Chemical Production and Technology, 2005, 12(5): 36−41.
