外源性ADM对肾脏急性机械性损伤早期HPA轴的影响*
2011-09-14王晓梅张淑琴王晓燕孙少华
王晓梅, 张淑琴, 王晓燕, 王 芳, 孙少华△
(1兰州大学第一医院病理科,2甘肃省卫生学校,甘肃 兰州730000;3西安邮电学院,陕西西安710121)
肾脏受到急性创伤因素刺激时,肾组织局部出现缺血、缺氧、氧化应激等病理生理改变,同时还可触发创伤后机体一系列生理应激反应,尤其是下丘脑-垂体-肾上腺皮质(hypothalamus-pituitary-adrenal cortex,HPA)轴的激活,是机体重要的防御反应。肾上腺髓质素(adrenomedullin,ADM)是一种血管源性活性多肽。大量研究已证实在肾损伤及肾脏疾病中运用外源性ADM可起到切实的肾脏保护作用[1,2]。在中枢神经系统内ADM分布于植物神经调节中枢的相关核团,其中在丘脑和下丘脑的含量为最高,内源性ADM作为神经递质或调质发挥生物学作用[3-5]。在急性肾损伤过程中运用外源性ADM,除了肾脏局部的保护作用,对机体应激反应(HPA轴)是否也有影响,起着何种作用,尚未见有文献报道。因此,本实验通过建立肾损伤动物模型,进行相关研究和探讨。
材料和方法
1 动物及分组
3月龄健康清洁级Wistar大鼠104只,雌雄各半,体重(210±30)g,随机分为4组:正常对照组8只。单纯创伤组32只,创伤前给药组32只,创伤后给药组32只。后3组大鼠平均分为4批分别在机械打击后1、6、12、24 h处死。
2 主要试剂及仪器
ADM购自Calbiochem,货号为121703;促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)放免分析试剂盒和皮质醇(cortisol,CORT)放免分析试剂盒均购自北京北方生物技术研究所;促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)Ⅰ抗、SABC免疫组化试剂盒和DAB显色试剂盒购自武汉博士德生物工程有限公司;生物撞击仪由兰州大学第一医院病理研究所自行研制(无专利及批准,暂无型号);上海分析仪器厂生产的721分光光度计;Beckman Coulter AllegraTM64 R低温离心机;西安二六二厂生产的FJ-2008型全自动γ-免疫计数仪;四川大学图像图形研究所Mias图像分析系统。
3 ADM的配制和使用[6]
ADM使用前先用生理盐水稀释成50 nmol/L的母液,置于-20℃保存。实验时按照0.1 nmol/kg计算每只动物所需的量,再以生理盐水稀释为0.5 mL终体积腹腔注射即可。
4 动物肾脏创伤模型的建立[7]
动物不经任何麻醉处理,采用俯卧位将其四肢固定于打击台上,以160 g铁质打击锤从45 cm高度自由下落打击大鼠脊肋区,打击面为圆形,直径1 cm,下压距离0.7 cm。造成双侧肾脏I级损伤(根据美国创伤外科学会器官损伤标准委员会制定的肾脏损伤标准)[8]。创伤前、后给药组分别于打击前后10 min腹腔注射ADM 0.1 nmol/kg。为避免昼夜节律的影响,各组动物均于晨8时在10%水合氯醛(3 mg/kg)深度麻醉下采用快速心脏采血法处死。
5 血浆的制备与检测
取全血2 mL加 EDTA-Na2(1 g/L)和抑肽酶(5×108IU/L)预处理的试管中,3 000 r/min、40℃离心20 min,分离血浆,-40℃冰箱保存,由兰州大学第一医院核医学科用放免分析法检测血浆ACTH和CORT浓度。ACTH放免分析测定盒:标准范围5-405 ng/L,灵敏度<5 ng/L,准确性(回收率:91.7% -101.3%,平均回收率96.5%),精密度(批内变异系数<6%,批间变异系数<12%);CORT放免分析药盒:检测范围为 10-500 μg/L,灵敏度 <2 ng/L,精密度(批内变异系数<10%,批间变异系数<15%)。
6 下丘脑免疫组化
分离下丘脑(视交叉、乳头体为前后界,左右下丘脑沟为左右侧界,深约1-1.5 cm),去除脑膜和血凝块,10%中性甲醛固定,经脱水、透明、包埋后,常规切片(4 μm)。采用SABC法进行CRH免疫组化染色,DAB显色,细胞内出现棕黄色颗粒为阳性结果。采用Mias图像分析系统对CRH的表达进行面积和灰度值测量。
7 统计学处理
采用SPSS 10.0统计学软件分析及处理数据,数据以均数±标准差(±s)表示。各指标均采用单因素方差分析,组间比较采用LSD法。
结 果
实验中大鼠共死亡6只:单纯创伤组1只,创伤前给药组2只,创伤后给药组3只。
1 大鼠创伤后下丘脑CRH表达的改变
单纯创伤组的大鼠下丘脑CRH在创伤后不同时点的表达与正常对照组相比均无显著差异。创伤前注射ADM使CRH的表达在各时点均有所升高,其中1、24 h升高的幅度更大,与正常对照组和单纯创伤组相比均显著差异,6、12 h无明显影响。创伤后注射ADM使CRH的表达在1、6、12 h与正常对照组和单纯创伤组相比均显著升高,24 h无明显影响,见图1。
2 大鼠创伤后血浆ACTH的改变
单纯创伤组的大鼠血浆ACTH浓度在创伤后不同时点的表达与正常对照组相比均无显著差异。创伤前注射ADM使大鼠血浆ACTH浓度在创伤后12 h明显高于正常对照组和单纯创伤组;在创伤后1 h、6 h和24 h,各组之间均无显著差异。创伤后注射ADM则对各组大鼠血浆ACTH浓度均无明显影响,任一时点各组之间均无显著差异,见图2。
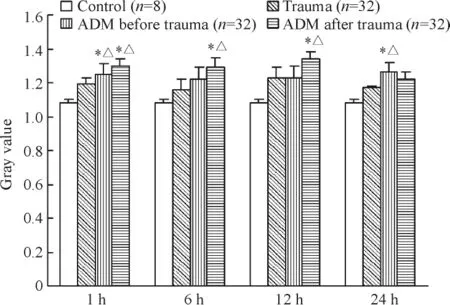
Figure 1.Expression of CRH in rat hypothalamus after trauma.±s.*P <0.05 vs trauma group;△P <0.05 vs control group.图1 大鼠创伤后下丘脑CRH的表达
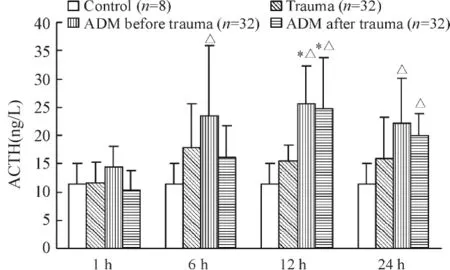
Figure 2.Concentration of ACTH in rat plasma after trauma.±s.*P <0.05 vs trauma group;△P <0.05 vs control group.图2 大鼠创伤后血浆ACTH浓度的改变
3 大鼠创伤后血浆CORT的改变
单纯创伤组的大鼠血浆CORT浓度在创伤后不同时点的表达与正常对照组相比均无差异显著。创伤前注射ADM使大鼠血浆CORT浓度在6、12和24 h均显著升高,与正常对照组相比均差异显著,而在创伤后12 h升高的幅度最大,与单纯创伤组相比也有显著差异;1 h无明显影响。创伤后注射ADM则使大鼠血浆CORT浓度在12、24 h均明显升高,与正常对照组相比均差异显著,而在创伤后12 h升高的幅度最大,与单纯创伤组相比也差异显著;1、6 h无明显影响,与正常对照组和单纯创伤组相比均无显著差异,见图3。
讨 论
1 HPA轴在急性创伤过程中的调节作用

Figure 3.Concentration of CORT in the rat plasma after trauma.±s.*P<0.05 vs trauma group;△P<0.05 vs control group.图3 大鼠创伤后血浆CORT浓度的改变
本实验检测了大鼠下丘脑CRH的表达、血浆ACTH、CORT的浓度,以评价大鼠肾机械性损伤后HPA轴的激活情况。从统计结果来看,单纯创伤后CRH和ACTH在12 h均有升高趋势,但无显著差异。CORT在创伤后6 h、12 h和24 h均有升高趋势,亦无显著差异。其主要原因可能是应激原的强度不足和应激原作用于机体的持续时间较短,不足以引起HPA轴的激活。本实验施加给大鼠的打击强度较弱,只达到I级肾创伤,持续时间短暂,自由落体的打击锤落下时打击到作用部位,打击锤反弹后即刻停止。这样只能引起HPA轴轻微的活动,即CRH、ACTH和CORT在创伤后轻微升高但无统计学意义。
虽然不能得出本次实验中单纯创伤后期肾组织损伤的恢复与HPA轴激活以及肾上腺皮质激素的防御代偿有关的结论,但CRH、ACTH和CORT的变化趋势符合机体遭受创伤时的病理生理过程,即有一定的病理生理意义。
2 外源性ADM对HPA轴的调节作用
2.1 外源性ADM可激活HPA轴的活动 既往的研究表明中枢给予 ADM,可提高血浆 ACTH[7]以及 CORT[8]的水平;在应激性高血压大鼠的HPA轴检测到ADM及其受体基因表达上调[9]。本实验结果为:创伤前、后注射ADM均能使某个时点CRH、ACTH、CORT浓度显著升高,即能不同程度地刺激HPA轴的各个层面,这表明外源性ADM通过其对HPA轴的各个水平的刺激作用加强了HPA轴的活性,在应激激素调节和应激生理反应中起着一定作用,进而发挥了对创伤肾组织的保护作用。
2.2 外源性ADM对HPA轴各个层面的激活作用不同 我们在实验中发现外源性ADM刺激CRH、ACTH、CORT升高的时点不同,并且在高水平持续的时间也不相同。其对下丘脑分泌CRH和肾上腺皮质分泌CORT的刺激作用出现的时点比较早而且持续在高水平的时间比较长,而对腺垂体分泌ACTH的刺激作用只出现在创伤前给药组的12 h。这说明HPA轴的各个层面对外源性ADM的反应性并不相同,即处于HPA轴两端的下丘脑和肾上腺皮质对ADM的反应较敏感,而处于中间位置的腺垂体的反应性相对较差。
2.3 创伤前和创伤后外源性ADM对HPA轴的影响不同创伤前10 min注射ADM,打击肾脏时外源性ADM刚好处于半衰期之内[10],外源性ADM致HPA轴的兴奋性增高,故出现伤后1 h下丘脑CRH的表达显著增高。而该组血浆CORT浓度在6、12和24 h持续升高,一方面,CRH表达的增高,通过HPA轴,促进靶器官CORT产生;另一方面是ADM发挥局部保护作用,使肾脏创伤初期的组织缺血缺氧减轻,从而能更好应答应激激素水平的调节。伤后6 h及12 h中枢CRH表达水平的回落一方面考虑是外源性ADM的消耗减少;另一方面此时点血浆CORT浓度的升高产生负反馈效应。至创伤后24 h,内源性ADM生成增加,致CRH再次升高。
创伤后10 min注射ADM使CRH的表达在创伤早期显著增高并且持续时间较长(1 h、6 h、12 h),一方面创伤后即刻的血管反应和交感活性的增加已经对组织造成了一定的损伤,引起HPA轴轻微的活动,并产生一定水平的内源性ADM,与外源性ADM产生的生理效应相叠加,促进中枢CRH表达增加,并在创伤后12 h达到最高峰。创伤后注射的外源性ADM对已经产生的组织损伤无逆转作用,致创伤局部反应减弱,因而血浆CORT水平的升高在创伤后期(12、24 h)才出现。
据此分析,创伤后注射ADM对下丘脑分泌CRH的激活作用更强,但创伤前注射ADM比创伤后注射ADM能更好刺激肾上腺皮质分泌CORT,发挥对创伤肾组织的保护作用。
通过以上实验,我们发现急性肾损伤后运用外源性ADM可活化HPA轴,提高机体的应激防御水平,再加上其在肾脏局部的扩血管、抗氧化、减少内皮细胞渗漏等效应,对创伤机体发挥调控和保护作用。
[1]Chao J,Chao L.The role of adrenomedullin in cardiovascular and renal function[J].Drug News Perspect,2002,15(8):511-518.
[2]黄小段,孙少华,钟翠萍.肾上腺髓质素的分子生物学意义及对肾脏损伤的影响[J].第四军医大学学报,2007,28(20):1915 -1916.
[3]Takahashi K.Adrenomedullin from a pheochromocytoma to the eye:implications of the adrenomedullin research for endocrinology in the 21st century[J].Tohoku J Exp Med ,2001,193(2):79 -114.
[4]Serrano J,Alonso D,Fernandez AP,et al.Adrenomedullin in the central nervous system[J].Microsc Res Tech,2002,57(2):76 -90.
[5]毕国荣,张 辉,张贺敏,等.肾上腺髓质素在正常大鼠大脑的分布[J].解剖科学进展,2006,12(3):206-208.
[6]李 霞,李著华,邹 平,等.肾上腺髓质素在大鼠肾缺血再灌注损伤中的作用研究[J].中国现代医学杂志,2003,13(6):4- 7.
[7]蒙伶俐,孙少华,张军荣,等.经体表创伤后肾组织中HIF-1α表达的调控[J].第四军医大学学报,2005,26(14):1311-1314.
[8]Moore EE,Shackford SR,Pachter HL,et al.Organ injury scaling:spleen,liver,and kidney[J].J Trauma,1989,29(12):1664-1666.
[9]Shan J,Krukoff TL.Intracerebroventricular adrenomedullin stimulates the hypothalamus- pituitary- adrenal axis,the sympathetic nervous system and production of hypothalamic nitric oxide[J].J Neuroendocrinol,2001,13(11):975 -984.
[10]Beltowski J,Jamroz A.Adrenomedullin-what do we know 10 years since its discovery?[J].Pol J Pharmacol,2004,56(1):5-27.
