CREG基因沉默诱导小鼠ESCs来源的EBs自发性凋亡*
2011-09-14韩雅玲田孝祥彭程飞闫承慧
张 娜, 韩雅玲, 田孝祥, 李 杰, 彭程飞, 闫承慧
(沈阳军区总医院,全军心血管病研究所,辽宁 沈阳110016)
胚胎干细胞(embryonic stem cells,ESCs)是从胚胎早期内细胞团分离得到的全能干细胞[1]。在小鼠ESCs分化过程中,去除ESCs的饲养层细胞和白血病抑制因子(leukemia inhibitory factor,LIF)并将其悬浮培养,ESCs可聚集成团,自发地分化形成具有3个胚层的胚胎小体(embryoid bodies,EBs)[2]。胚胎发育早期,EB内层细胞自发性凋亡是三胚层结构发生及胚胎发育的重要过程之一。如果EB细胞自发性凋亡现象出现异常,则可能引起胚胎早期发育过程紊乱致使胚胎发育受到抑制或发生早期胚胎死亡。因此,探讨ESCs分化过程中EBs抗凋亡和促凋亡机制,可能为阐明胚胎发育机制提供新的思路。
E1A激活基因阻遏子(cellular repressor of E1A-stimulated genes,CREG)是从子宫颈内膜癌HeLa细胞cDNA文库中克隆的一个新的转录相关调控因子[3]。已有研究表明,CREG促进胚胎细胞或不成熟细胞的分化成熟,在成熟组织和细胞中高表达,而在未成熟细胞如干细胞、人胚胎瘤细胞及未分化的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)中低表达[4-7]。我们新近研究发现,CREG在体外培养的骨髓间充质干细胞中过表达时能够有效抑制缺氧诱导的细胞凋亡现象的发生[8,9];在损伤血管中过表达CREG能够维持VSMCs的分化表型,对抗损伤后VSMCs凋亡的发生;CREG对抗VSMCs凋亡的作用是通过其下游 p38 MAPK信号转导通路介导的[10]。另外,CREG在胚胎发育早期E5.5 d表达,提示其参与了胚胎发育的调控[6]。但CREG基因沉默对于ESCs早期发育中细胞凋亡的调控作用尚不清楚。因此,本实验以ESCs衍生的EBs为研究模型,探讨CREG基因沉默在EBs凋亡中的作用。
材料和方法
1 材料
昆明小鼠购自沈阳军区总医院动物中心;小鼠胚胎干细胞株R1(SCRC-1011TM)和小鼠成纤维细胞株STO(CRL-1503TM)购自ATCC;pEN_mH1c和pDS_hpEy载体由美国新泽西州立大学李少华教授馈赠;ES级胎牛血清(FCS)和DMEM干粉培养基购自Gibco;胰蛋白酶、EDTA、非必需氨基酸、β-巯基乙醇、丙酮酸钠、Triton X-100和明胶购自Sigma;谷氨酰胺购自Gibco;重组人白血病抑制因子购自Chemicon;丝裂霉素C购自日本协和株式会社;Annexin VFITC凋亡检测试剂盒购自BD;抗cleaved caspase-3抗体和抗CREG抗体购自RD;碱性磷酸酶(alkaline phosphatase,AKP)染色试剂盒购自 Invitrogen;RTPCR检测试剂盒及引物合成为TaKaRa。
2 方法
2.1 CREG基因shRNA载体的构建 小鼠CREG基因沉默表达载体pDS-shCREG由本室构建。简述如下:应用RNA干扰在线设计工具设计4对可与小鼠CREG基因cDNA结合的短发夹RNA,具体序列如下:CREG-shRNA1:正义链5'-GATCCCCCAAGACAGAAGAGGACTATTTCAAGAGAATAGTCCTCTTCTGTCTTGTTTTTC -3',反 义 链 5'-TCGAGAAAAACAAGACAGAAGAGGATCTATTGAAATAGTCCTCTTCTGTCTTGGGG-3';CREG-shRNA2:正义链 5'-GATCCCCTCGCGGACATCATCTCAATTTCAAGAGAATTGAGATGATGTCCGCGATTTTTC-3',反义链 5'-TCGAGAAAAATCGCGGACATCATCTCAATTCTCTTGAAATTGAGATGATGTCCGCGAGGG-3';CREG-shRNA3:正义链5'-GATCCCCCTGGCCACTATCTCCACAATATTCAAGAGATATTGTGGAGATAGTGGCCAGTTTTTC -3',反义链 5'-TCGAGAAAAACTGGCCACTATCTCCACAATATCTCTTGAATATTGTGGAGATAGTGGCCAGGGG-3';CREG-shRNA4:正义链 5'-GATCCCCGAATGAATCCTTCAGTCGAGGTTCAAGAGACCTCGACTGAAGGATTCATTCTTTTTC -3',反义链5'-TCGAGAAAAAGAATGAATCCTTCAGTCGAGGTCTCTTGAACCTCGACTGAAGGATTCATTCGGG-3'。通过化学合成法合成并克隆至pEN_mH1c载体中,与目的载体pDS-hpEY进行LR重组得到4种表达不同shCREG片段的表达载体 pDS - shCREGs[11]。
2.2 ESCs培养、转染及阳性克隆的筛选 ESCs用含15%FCS的DMEM培养基,37℃、5%CO2,恒温培养箱中培养。STO为饲养细胞,培养基中加入LIF以保持细胞全能性。用LipofectamineTM2000将pDS-shCREG干扰载体转染R1细胞,37℃ 培养24 h,去掉转染试剂后继续培养72 h,加入G418进行抗性筛选,G418筛选最适浓度为400 mg/L,挑取筛选获得稳定表达的细胞克隆R1-shCREG。以正常组R1和阴性对照质粒GFP转染的R1细胞(R1-GFP)为对照组进行下列实验。
2.3 EBs制备 ESCs培养至亚融合状态,用0.25%胰酶及0.53 mmol/L EDTA消化后,接种到明胶包被的培养皿中实施选择性筛选,3 h后大部分STO细胞已贴壁。将未贴壁的ESCs稀释后接种于细菌培养皿中,培养液除无LIF外与ESCs培养液相同。连续培养3 d,中间不换液。第4 d,弃去7.5 mL原培养液,加入7.5 mL新鲜的EB细胞培养液。以后每天换液。
2.4 AKP染色 配制bufferⅢ缓冲液,其配方为:100 mmol/L Tris·HCl(pH 9.5),100 mmol/L NaCl,50 mmol/L MgCl2,将 BCIP/NBT 和 bufferⅢ按1∶100比例配制工作液。将3组ESCs接种到35 mm预先铺有处理好的STO的组织培养皿中培养,2 d后弃掉培养液,PBS洗3遍。1%多聚甲醛4℃ 固定20 min,PBS洗3遍。加入1 mL配好的工作液,置于37℃孵育20 min后,取出于相差显微镜下观察染色效果,当出现紫色时,以PBS终止显色反应。
2.5 小鼠荷瘤实验 胰酶消化ESCs,注射入小鼠心肌,细胞数量为(1-4)×106,注射3周后将小鼠处死,取出心脏,4%多聚甲醛4℃ 固定20 min,PBS洗3遍。冰冻切片HE染色观察成瘤情况。
2.6 RT-PCR Trizol一步法提取细胞总 RNA,各取 1 μg RNA 按 TaKaRa RNA PCR kit说明书,以GAPDH为内参照,行cDNA合成及PCR扩增,引物序列如下:CREG上游引物为5'-GGGGGCCCAGTGTCACCAGGAAC-3',下游引物为 5'-CGGGGGAGGCCATGACGGGAGTG-3';GAPDH上游引物为5'-ATCTGGCACCACACCTTCTACAAT -3',下游引物为5'-CCGTCACCGGAGTCCATCA-3';caspase-3上游引物为 5'-CAGTGGGCTCACTCTGAAGACC-3',下游引物为 5'- ACGCGTTACTGGCATTGAGG-3';GAPDH上游引物为5'-TATTGGGCGCCTGGTCACCA -3',下游引物为 5'-CCACCTTCTTGATGTCATCA-3'。CREG扩增条件如下:25℃ 50 min,95℃ 10 min,95 ℃ 45 s,42 ℃ 30 s,48 ℃ 1 min,进行45个循环,最后48℃ 2 min,得到CREG产物片段长度为 670 bp,GAPDH产物片段长度为 750 bp;caspase-3的扩增条件如下:50℃ 1 h,96℃ 5 min,96℃ 30 s,65 ℃ 30 s,69 ℃ 1 min,进行35个循环,最后69℃ 2 min,得到caspase-3产物片段长度为560 bp,GAPDH产物片段长度为650 bp。
2.7 Western blotting分析 按文献[12]将全细胞提取物进行SDS-PAGE、转膜、抗体结合及显色。分离胶浓度为 12%;I抗分别为抗cleaved caspase-3和CREG抗体。经辣根过氧化物酶标记的II抗孵育后,按ECL试剂盒说明书曝光处理。
2.8 Annexin V/PI双染色检测细胞凋亡 胰酶消化,收集细胞。按照Annexin V-FITC凋亡检测试剂盒说明书操作。以1×binding buffer重悬细胞,加入5 μL Annexin V-FITC及5 μL PI。室温避光孵育15 min后,经260目滤网过滤,行流式细胞仪检测[13]。
3 统计学处理
结 果
1 获得稳定转染CREG基因沉默R1细胞株(R1-shCREG)
倒置显微镜下观察显示,R1和R1-GFP均形成致密的细胞克隆,细胞克隆边缘锐利清楚,以长椭圆形或圆形为主,细胞体积小;而R1-shCREG细胞生长速度相对较慢,以长椭圆形为主,R1-shCREG细胞边缘与滋养层细胞分界相对模糊,细胞培养基中代谢废物明显增多,见图 1A。R1-GFP、R1-shCREG和R1细胞的AKP染色发现,3组ESCs染色均为紫色,无明显分化现象,提示CREG基因沉默不影响ESCs的“干性”,见图1B。
2 R1-shCREG组来源的EBs中CREG表达受到明显抑制
RT-PCR结果表明R1-shCREG/EB组的mRNA表达量明显下降,与其它2组比较有显著差异,见图2A。Western blotting结果显示,R1-shCREG/EB组 CREG的蛋白表达量较 R1/EB组和 R1-GFP/EB组分别下降了(78.0±1.3)%和(84.0±2.4)% ,P<0.05。而R1-GFP/EB组与正常R1/EB组相比无显著差异(P>0.05),见图2B。
3 CREG基因沉默抑制ESCs分化
EBs分化实验显示,CREG基因沉默组ESCs来源的EBs在体外培养过程中不能自发分化成三胚层结构,见图3A。同时,小鼠心肌荷瘤实验显示,注射R1-shCREG组小鼠心肌内不能形成畸胎瘤结构,见图3B。
4 CREG基因沉默诱导ESCs来源的EBs凋亡
用Annexin V-FITC/PI双染色行流式细胞术检测ESCs分化7 d的 R1/EB、R1-GFP/EB及 R1-shCREG/EB的细胞凋亡率。结果显示,R1-shCREG/EB组细胞凋亡率明显高于R1/EB组(P<0.05);而R1-GFP/EB组细胞的凋亡率与R1/EB组比较无显著差异(P>0.05),见图4A。
RT-PCR和Western blotting检测发现,与R1/EB组相比,ESCs分化7 d的R1-shCREG/EB细胞中caspase-3 mRNA和蛋白表达明显增多(P<0.05),见图4B、C。上述结果证实CREG基因沉默诱导ESCs来源的EBs自发性凋亡增多。
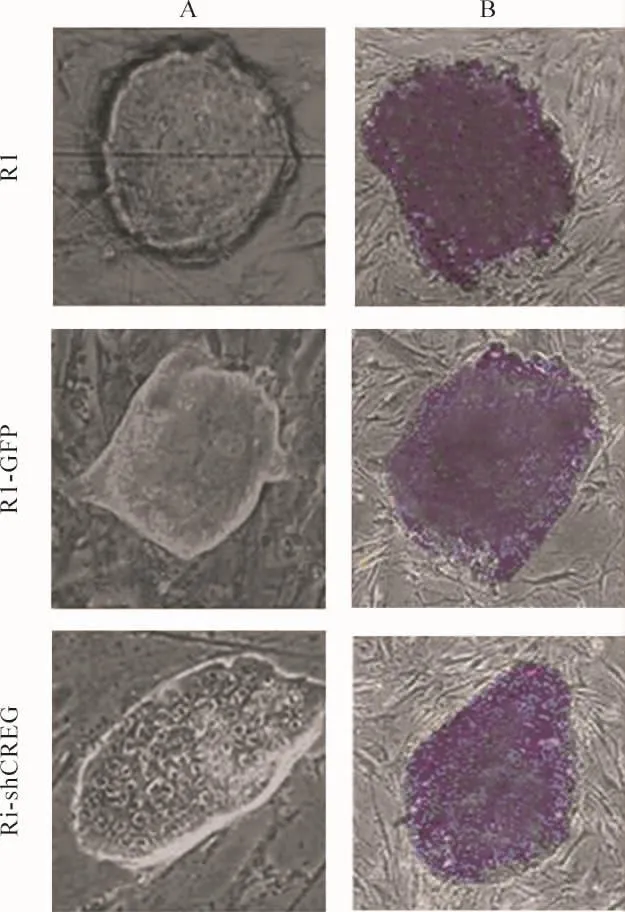
Figure 1.Establishment of stably-transfected R1 cells(R1-shCREG and R1-GFP)and verification of stemness of transfected ESCs(×200).A:R1 was transfected with GFP and pDS-shRNA-CREG under phase-contrast microscope;B:alkaline phosphatase(AKP)staining.R1-GFP:R1 transfected with GFP;R1-shCREG:R1 transfected with pDS-shRNA- CREG.图1 稳定转染pDS-shRNA-CREG和GFP质粒细胞克隆株的建立及碱性磷酸酶染色鉴定ESCs细胞全能性
讨 论
胚胎的稳定发育是指各个发育阶段组织形态的稳定,凋亡是确保这一稳定的重要细胞学基础。EB细胞自发性凋亡是三胚层结构发生及胚胎发育的重要过程之一。若细胞自发性凋亡异常增加,导致组织细胞构成失常,则无法维持胚胎的正常发育。我们前期研究证实,CREG是一种分泌型糖蛋白,可以与胰岛素样生长因子II竞争性结合细胞膜胰岛素样生长因子受体II,以自分泌和旁分泌2种方式诱导并维持组织或细胞分化;在胚胎发育早期E9.5 d,血管内皮细胞(endothelial cells,ECs)和血管平滑肌细胞分化始动过程中即伴有CREG表达,并持续整个胚胎血管发生过程。这一研究提示了CREG可能是血管发育过程中调控血管形成的重要因子。但本室前期研究也提示,降低成熟血管平滑肌细胞和骨髓间充质干细胞中CREG的表达,引起细胞大量的自发性凋亡发生。
因此,本研究应用逆转录病毒载体转染,获得稳定的CREG基因沉默的胚胎干细胞株(R1-shCREG),从胚胎发育入手,利用我们已经建立的离体胚胎干细胞体外分化模型,研究CREG基因沉默对ESCs来源的EBs自发性凋亡的影响。结果发现,CREG基因沉默抑制了ESCs的分化,同时促进EBs自发性凋亡。中胚层的分化、结构稳定及成熟是胚胎发生的基础,R1-shCREG/EB在发育过程中,细胞凋亡的控制介质caspase-3明显增多,在多种凋亡信号刺激下经蛋白水解作用被激活成活化形式,可对多种蛋白底物进行降解,影响三胚层的发育,不能形成典型的三胚层结构使其结构异常或者分化不成熟,EBs发生受到影响,胚胎发育被抑制。本研究证实,下调CREG表达可以抑制ESCs分化,促进细胞凋亡的发生。但进一步的分子机制研究仍有待阐明。
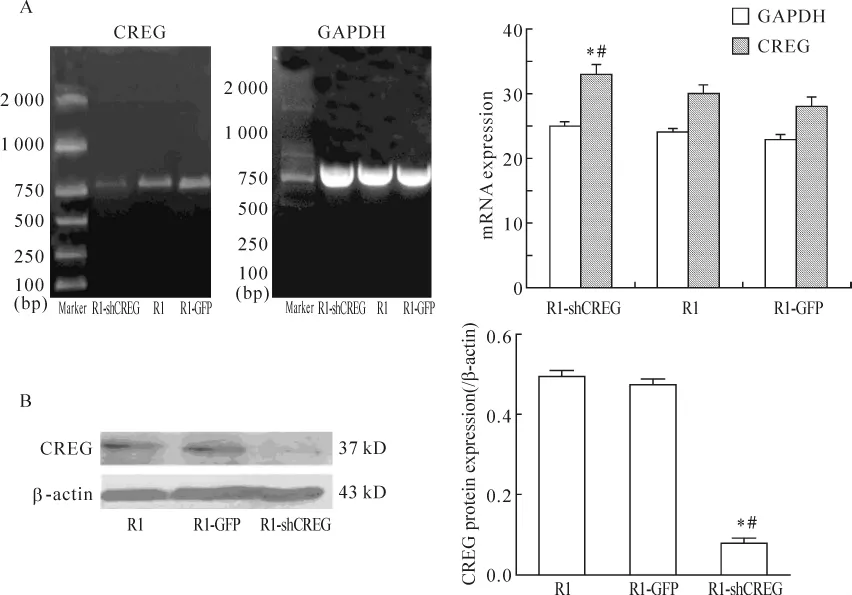
Figure 2.The mRNA and protein expression of CREG in 3 kinds of EBs cultured for 7 d.A:the mRNA expression of CREG was assayed by RT-PCR;B:the protein expression of CREG was assayed by Western blotting.*P<0.05 vs R1;#P<0.05 vs R1-GFP.图2 3组EBs培养7 d时检测CREG mRNA和蛋白表达量
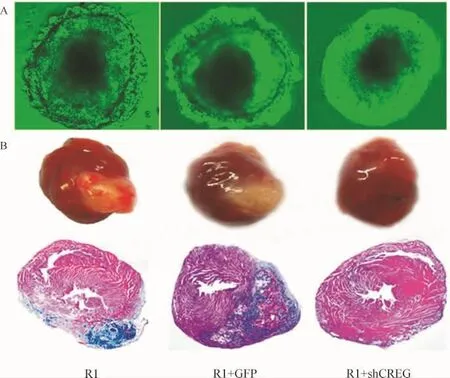
Figure 3.CREG gene silencing inhibited ESCs differentiation.A:differentiation of the 3 kinds of EBs on day 7 under phase-contrast microscope(×200);B:tumor formation assay inoculated in mouse myocardium.图3 CREG基因沉默抑制ESCs分化
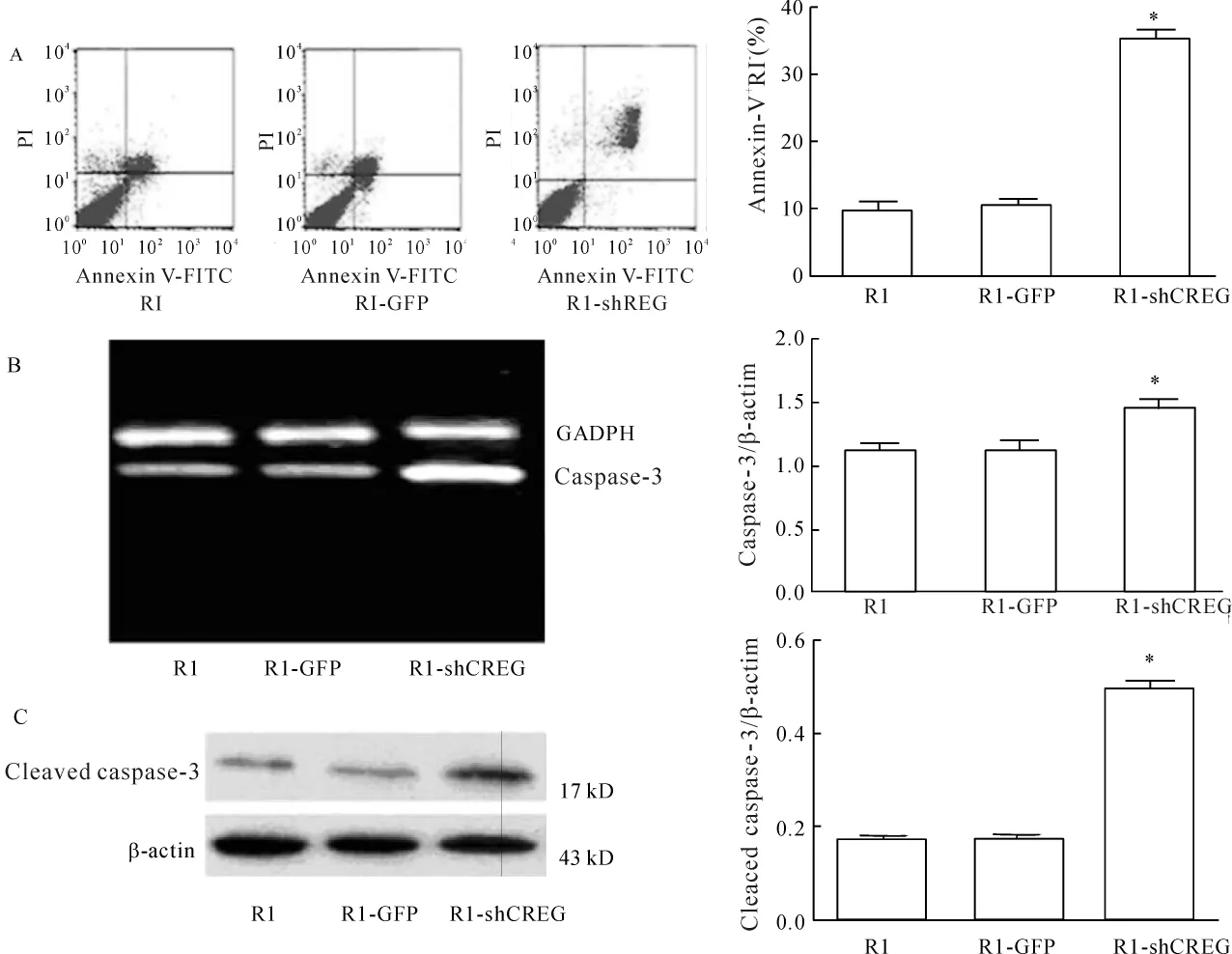
Figure 4.Apoptotic rate and the expression of caspase-3 mRNA and cleaved caspase-3 protein in 3 kinds of EBs on day 7.A:percentages of apoptotic cells were tested by Annexin V/PI dual-color flow cytometry;B:expression of caspase-3 mRNA in 3 kinds of ESCs were detected by RT-PCR;C:Western blotting was employed to test the protein expression of cleaved caspase-3.*P<0.05 vs R1 or R1-GFP.图4 EBs培养7 d细胞凋亡率检测及caspase-3 mRNA和蛋白表达
[1]Evans MJ,Kaufman MH.Establishment in culture of pluripotential cells from mouse embryos E1A [J].Nature,1981,292(5819):154-156.
[2]Karbanova J,Mokry J.Histological and histochemical analysis of embryoid bodies[J].Acta Histochemica,2002,104(4):361-365.
[3]Kunita R,Otomo A,Ikeda JE.Identification and characterization of novel members of the CREG family,putative secreted glycoproteins expressed specifically in brain[J].Genomics,2002,80(5):456 -460.
[4]Parker LH,Schmidt M,Jin SW,et al.The endothelial-cell-derived secreted factor Egfl7 regulates vascular tube formation [J].Nature,2004,428(6984):754 -758.
[5]Ribatti D,Conconi MT,Nussdorfer GG.Nonclassic endogenous regulators of angiogenesis[J].Pharmacol Rev,2007,59(2):185-205.
[6]韩雅玲,杨桂棠,闫承慧,等.E1A激活基因阻遏子表达与小鼠胚胎血管发生的关系[J].中国组织化学与细胞化学杂志,2007,16(5):595 -601.
[7]Fischer C,Schneider M,Carmeliet P.Principles and therapeutic implications of angiogenesis,vasculogenesis and arteriogenesis [J].Handb Exp Pharmacol,2006,176(2):157-162.
[8]Han Y,Wu G,Deng J,et al.Cellular repressor of E1A-stimulated genes inhibits human vascular smooth muscle cell apoptosis via blocking P38/JNK MAP kinase activation[J].J Mol Cell Cardiol,2010,48(6):1225 -1235.
[9]Deng J,Han Y,Yan C,et al.Overexpressing cellular repressor of E1A-stimulated genes protects mesenchymal stem cells against hypoxia-and serum deprivation-induced apoptosis by activation of PI3K/Akt[J].Apoptosis,2010,15(4):463 -473.
[10]韩雅玲,徐红梅,邓 捷,等.E1A激活基因阻遏子过表达抑制体外人血管平滑肌细胞凋亡[J].生理学报,2006,58(4):324 -330.
[11]郭 鹏,闫承慧,郭 亮,等.小鼠E1A激活基因阻遏子RNA干扰表达载体的构建[J].中国组织工程研究与临床康复,2008,12(37):7277 -7281.
[12]Han Y,Qi Y,Kang J,et al.Nerve growth factor promotes formation of lumen-like structures in vitro through inducing apoptosis in human umbilical vein endothelial cells[J].Biochem Biophys Res Commun,2008,366(3):685-691.
[13]Vermes I,Haanen C,Steffens-Nakken H,et al.A Novel assay for apoptosis.Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescsein labelled Annexin V[J].J Immunol Methods,1995,184(1):39-51.
