普伐他汀与华法林联合应用对兔激素性股骨头坏死的影响*
2011-09-14李挺松肖增明詹新立
李挺松, 肖增明, 詹新立
(广西医科大学第一附属医院脊柱骨病外科,广西南宁530021)
临床上长期使用糖皮质激素的患者,如系统红斑狼疮、肾病综合征、肾移植等病人,激素性股骨头坏死(steroid-induced osteonecrosis of femoral head,SIONF)发生率较高(22% - 44%)[1,2],不少患者需行关节置换术,因此从可能的发病机理上予以干预显得尤其重要。究其原因,多数学者认为综合因素所致[3],其中高脂血症和高凝状态所致股骨头营养血管脂肪栓、血栓栓塞,从而引起股骨头缺血坏死的说法更受关注[4,5]。动物实验显示他汀类降脂药能减少SIONF发生率[6];单独使用抗凝药华法林有降低SIONF倾向,但无统计学上差异[5]。降脂抗凝联合使用干预SIONF发生率情况如何,鲜有报道。本研究探讨普伐他汀联合华法林的降脂抗凝共同作用对兔SIONF的影响,旨在为临床防治SIONF提供一途径。
材料和方法
1 材料
健康成年雌性日本大白兔,年龄28-32周,体重2.8-3.4 kg,由广西医科大学动物实验中心提供。所有动物按标准动物饲料分笼喂养,自由饮水。甲基强的松龙(methylprednisolone,MPSL;Upjohn),普伐他汀(中美上海施贵宝制药有限公司提供),华法林(Orion Corporation)。总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)测试盒(上海执诚生物技术有限公司),凝血酶原时间(prothrombin time,PT)和活化部份凝血活酶时间(activated partial thromboplastin time,APTT)测 试 盒 (Instrumentation Lab.)。7170A血生化全自动分析仪和500 mA X线摄片机(HITACHI),ACL TOP全自动凝血分析仪(Beckman Coulter)石蜡切片机和DMR-Q550病理图文分析系统(Leica),H-500透射电镜(TOSHIBA)。
2 方法
2.1 SIONF动物模型建立 以左髋部股骨头关节作实验观察。兔SIONF动物模型建立参照Yamamoto等[7]造模方法进行。检疫观察1周后,所有动物随机分为3组,CTR组(对照组)12只,等量生理盐水右臀部肌肉注射1次。SIONF组(实验组)18只,甲基强的松龙20 mg/kg右臀部肌肉注射1次。PW组(干预组)18只,造模方法同SIONF组,口服普伐他汀 2.5 mg·kg-1·d-1及华法林 1.5 mg·kg-1·d-1,与饲料混合服用,密切观察不能漏服。整个实验间期0-12周。
2.2 血脂、凝血指标测定 各组动物分别于实验前及实验后第 2、4、6、8、10、12 周,早晨抽空腹静脉血6 mL,取血前禁食12 h。测定血清 TC、TG及血浆PT、APTT。
2.3 X线摄片及骨组织形态学检查 在实验第4、6、8、10周,随机抽取2只动物,第12周处理剩下动物。首先予氯胺酮2.5 mg/kg肌注麻醉后,行双侧髋关节X线摄片,然后耳缘静脉空气栓塞法处死兔子。双侧股骨头标本取材,观察大体病理。将左侧股骨头沿冠状面切开,10%甲醛固定24 h,8%甲酸溶液中脱钙48-72 h,梯度乙醇脱水,常规石蜡包埋,5 μm切开后行HE染色,病理图像分析仪测量股骨头软骨下区平均骨陷窝空虚率作为评价骨组织坏死程度。
2.4 透射电镜细胞超微结构观察 将左股骨头沿冠状面切开,在股骨头软骨下1.5-3.0 mm处取2 mm×2 mm×2 mm大小骨块,于2.5%戊二醛4℃环境下前固定,10%EDTA 4℃环境下脱钙1周,1%铁酸后固定,常规包埋,制成超薄切片,醋酸铀和柠檬酸铝双染色,透视电子显微镜观察。
2.5 判断骨坏死组织学改变依据 骨小梁骨陷窝空虚程度,骨细胞核固缩,骨细胞碎片存在情况[8]。
3 统计学处理
数据用SPSS 10.0软件进行统计分析,数据以均数±标准差±s)表示,组间比较采用单因素方差分析。
结 果
1 一般体征
实验前后,CTR组动物无死亡,兔子精神、食欲正常,毛泽光亮,体重明显增加,活动如常。SIONF组兔子精神萎糜,食欲不振,毛泽枯槁,消瘦,4周后有3只出现蹒跚步态,至第12周每只兔子出现不同程度跛行,行动受限,易于感染,于第5、7周因腹泻、肺炎各死亡1只。PW组动物精神稍差,食欲有减,毛色稍灰暗,体型消瘦,但运动跳跃动作仍较好。于第4、8周因肺炎、皮肤感染各死亡1只。
2 实验前后血脂及凝血变化
从实验第6周开始持续到实验终点,PW组TC水平较CTR组高(P<0.05),但较SIONF组低(P<0.05),而 SIONF组 TC显著高于 CTR组(P<0.01)。TG水平从实验第8周开始,3组之间有类似血清TC变化,见表1、2。
从实验第2周开始到实验终点,PW组动物血浆PT较CTR组及SIONF组明显延长(P<0.01),相反SIONF组PT较CTR组及PW组显著缩短(P<0.05)。APTT结果3组之间亦有类似PT变化,见表3、4。
表1 各组不同时点血清TC变化Table 1.Serum TC changes at different time points(mmol/L.±s)

表1 各组不同时点血清TC变化Table 1.Serum TC changes at different time points(mmol/L.±s)
*P <0.05,**P <0.01 vs control group;#P <0.05,##P <0.01 vs SIONF group.
Group n Pre-experiment 2nd week 4th week 6th week 8th week 10th week 12th week Control 12 1.75 ±0.20 1.72 ±0.21 1.730 ±0.23 1.70 ±0.18 1.72 ±0.17 1.69 ±0.24 1.70 ±0.27 SIONF 16 1.79 ±0.24 1.82 ±0.21 2.240 ±0.25* 3.10 ±0.19** 3.34 ±0.22** 3.55 ±0.18** 4.12 ±0.29**PW treatment 16 1.81 ±0.23 1.80 ±0.19 1.84 ±0.22 2.02 ±0.21# 2.13 ±0.14# 2.21 ±0.16*#2.42 ±0.19*##
表2 各组不同时点血清TG变化Table 2.Serum TG changes at different time points(mmol/L.±s)

表2 各组不同时点血清TG变化Table 2.Serum TG changes at different time points(mmol/L.±s)
*P <0.05 vs control group;#P <0.05 vs SIONF group.
Group n Pre-experiment 2nd week 4th week 6th week 8th week 10th week 12th week Control 12 1.44 ±0.21 1.40 ±0.18 1.45 ±0.21 1.39 ±0.23 1.40 ±0.20 1.42 ±0.19 1.38 ±0.20 SIONF 16 1.42 ±0.20 1.44 ±0.19 1.63 ±0.21 1.70 ±0.18 2.14 ±0.20*2.40 ±0.22*3.10 ±0.23*PW treatment 16 1.41 ±0.23 1.42 ±0.24 1.52 ±0.19 1.58 ±0.22 1.62 ±0.24 1.74 ±0.18#2.10 ±0.23*#
表3 各组不同时点血浆PT变化Table 3.Plasma PT changes at different time points(s.±s)

表3 各组不同时点血浆PT变化Table 3.Plasma PT changes at different time points(s.±s)
*P <0.05,**P <0.01 vs control group;##P <0.01 vs SIONF group.
Group n Pre-experiment 2nd week 4th week 6th week 8th week 10th week 12th week Control 12 14.11 ±2.13 14.78 ±3.01 14.50 ±2.01 13.91 ±1.90 14.01 ±2.10 15.01 ±2.30 14.22 ±2.10 SIONF 16 14.86 ±2.20 13.35 ±2.90 13.01 ±1.90 11.11 ±2.01 12.02 ±1.91 10.14 ±1.89* 9.98 ±1.83*PW treatment 16 13.96 ±2.23 22.13 ±1.94**##24.51 ±2.81**##28.34 ±2.91**##29.12 ±2.82**##31.98 ±3.08**##30.01 ±31.40**##
表4 各组不同时点的血浆APTT变化Table 4.Plasma APTT changes at different time points(s.±s)

表4 各组不同时点的血浆APTT变化Table 4.Plasma APTT changes at different time points(s.±s)
*P <0.05 vs control group;#P <0.05,##P <0.01 vs SIONF group.
Group n Pre-experiment 2nd week 4th week 6th week 8th week 10th week 12th week Control 12 36.33 ±3.10 35.82 ±3.01 36.14 ±2.87 36.41 ±2.90 35.78 ±2.51 36.04 ±2.64 36.12 ±3.02 SIONF 16 35.30 ±3.41 33.16 ±3.05 30.21 ±2.50 29.24 ±2.40* 28.02 ±2.11* 27.19 ±2.61* 24.47 ±3.10*PW treatment 16 36.55 ±3.51 40.11 ±4.12 42.01 ±3.92*# 48.12 ±4.01*##48.56 ±3.96*##49.08 ±3.84*##49.10 ±3.15*##
3 股骨头X线表现
CTR组股骨头各时点抽样检查X线表现无异常。SIONF组从第6周开始股骨头出现骨小梁模糊,不规则透亮区,到实验终点绝大部分有不同程度软骨面塌陷。PW组股骨头可见骨质疏松,少部份软骨面塌陷。
4 骨组织形态学检查发现
CTR组各时点抽样的股骨头组织形态正常,见图1。SIONF组实验第6周开始髓内脂肪细胞增大,软骨下区骨陷窝空泡点状分布。第12周髓基质大量脂肪化,髓腔内血管受压,管腔变窄,血栓形成,见图2,骨细胞核固缩、溶解,成骨细胞几乎消失,可见骨细胞碎片,骨陷窝空虚率明显增加。PW组从8周到实验终点髓内基质脂肪转化率低,少量骨陷窝空泡出现,骨小梁排列规则,无明显的骨髓细胞碎片,髓内血管走向基本正常,未见血栓形成,见图3。
5 透射电镜观察
实验终点时显示,CTR组股骨头骨细胞膜周围伸出细小绒毛进入基质中,细胞核清晰,粒浆比例1∶1,胞浆内细胞器完整,见图4。SIONF组细胞膜突起消失,核膜不清,胞浆内细胞器溶解,细胞核固缩,并有自溶现象,见图5。PW组骨细胞突起尚存核膜较清晰,胞浆内细胞器溶解及核固缩现象显著较SIONF组减轻,见图6。
6 3组SIONF发生率
以骨坏死的组织改变为依据判断,3组SIONF发生率分别为:CTR组0%(0/12),SIONF组63%(10/16)和PW组31%(5/16),PW组较SIONF组显著减少(P<0.05)。

Figure 1.Normal bone tissues in control group 12 weeks after experiment(HE staining,×20).图1 实验12周后CTR组正常骨组织

Figure 2.12 weeks after experiment,bone tissues in SIONF group showed large numbers of adipose cells and intravascular thrombosis(→)(HE staining,×20).图2 实验12周后SIONF组骨组织可见大量脂肪细胞及血管内血栓

Figure 3.12 weeks after experiment,bone tissues in PW treatment group showed less adipose cells and no significant intravascular thrombosis(HE staining,×20).图3 实验12周后PW组骨组织可见少量脂肪细胞,无明显血管内血栓

Figure 4.12 weeks after experiment,bone cells in control showed normal form of rough endoplasmic reticulum(→)(TEM,×7 700).图4 实验12周后CTR组骨细胞中正常粗面内质网的形态

Figure 5.12 weeks after experiment,bone cells in SIONF group showed phagocytosis of fat droplets(→)and karyopyknosis(TEM,×7 700)图5 实验12周后SIONF组骨细胞吞噬脂肪小滴,细胞核固缩
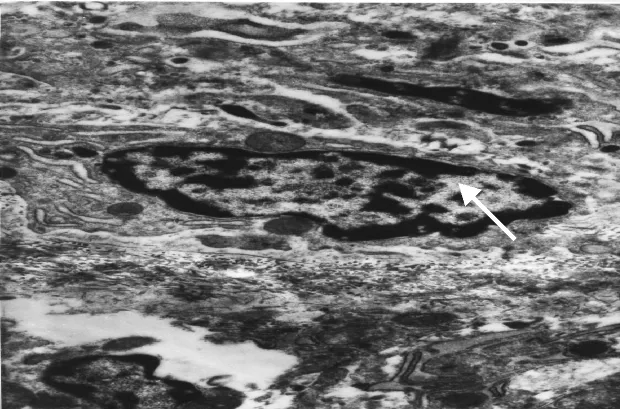
Figure 6.12 weeks after experiment,bone cells in PW treatment group showed clear nuclear membrane(→)and significantly-reduced nuclear condensation(TEM,×7 700).图6 实验12周后PW组骨细胞核膜清晰,核固缩显著减轻
讨 论
激素诱导的股骨头坏死SIONF是临床长期应用糖皮质激素患者如系统红斑狼疮、器官移植后等的严重并发症[1,9]。迄今为止 SIONF发病机制仍不明潦,多数学者认为与多因素有关,如高脂血症、高凝状态、髓内营养血管内皮受损、血管炎症等[10,11]。正由于这原因,临床或动物实验对SIONF研究较有限且结论不一致[6,12]。本文以兔SIONF动物模型进行探讨,采用高剂量(20mg/kg)甲基强的松龙单次肌肉注射造模方法[7]。激素肌肉注射后第6周开始骨组织发生形态上病态改变,与既往文献报道发生于使用激素后 2-20周[4,10],基本相符。采用软骨下骨小梁陷窝空虚率或骨细胞核固缩、溶解程度为标准判断骨坏死[8,13]。由于高脂高凝状态为目前SIONF机制中研究热点,本文以降脂抗凝联合应用干预SIONF进行研究。普伐他汀为最常用的他汀类降脂药,华法林为目前最有效的口服抗凝药。普伐他汀联合华法林应用对SIONF兔的股骨头影响结果显示,PW组SIONF发生率为31%(5/16),而SIONF组为63%(11/16)(P<0.05),这结果与 Nishida等[8]报道结果较一致。
本研究通过检测血清TC和TG来f反映实验动物脂肪代谢状态,其结果显示,从实验第6周开始到实验终点,SIONF组TC、TG逐渐显著高于CTR组及PW组,而PW组TC、TG虽然高于CTR组,但仍然低于SIONF组(P<0.05),这样的血脂代谢情况使实验动物体循环形成高脂、高黏状态。由于激素诱导的骨缺血坏死主要发生于股骨头而不在长骨或其它关节[7],所以股骨头骨髓内将出现高脂代谢状态,本研究结果支持这观点。SIONF组实验第6周开始股骨头骨髓内脂肪细胞增大,髓质大量脂肪化,而PW组髓内脂肪化明显减弱,CTR组髓内组织形态正常,与最近Nishida等[8]研究结果较一致。本文没有直接确定普伐他汀预防SIONF发生发展机制,但认为可能与通过降低体循环高脂、高黏状态从而改善股骨头骨髓内异常血脂有关。他汀类药为羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,竞争性抑制体内胆固醇合成过程中限速酶(HMG-CoA还原酶)活性,从而阻断胆固醇的生成,继而上调细胞表面低密度脂蛋白(LDL)受体,加速血浆LDL的分解,从而降低TC、LDL及TG。他汀类药为应用已久疗效肯定,且目前仍最广泛使用的降脂药,临床治疗各种高脂血症、动脉粥样硬化、冠状动脉粥样硬化心脏病等疗效明确[14]。动物试验及临床观察分析他汀类降脂药可降低SIONF的发生率及发展[6]。但他汀类药物干预SIONF发生、发展机制未明。大多数学者认为高脂血症、凝血功能异常导致髓内营养血管脂肪栓子、血栓子机械阻塞[8,11],而他汀类药可降低血脂、减少脂肪栓子形成,从而改善髓内血供[6]。另有学者认为,他汀类药对干预SIONF的有益作用可通过非降脂作用起效[15],这种非降脂作用包括改善血管内皮细胞功能、抗血栓作用、减少血管炎症、抗氧化功能[16-18]。最近还有学者研究发现,他汀类药物通过抑制骨髓基质细胞表达脂肪细胞特异性转录分化因子PPARγ2,促进成骨细胞特异性分化与转录因子Cbfa1/Runx2表达,从而抑制脂肪分化,促进骨髓基质细胞向成骨细胞分化[19]。他汀类药物上述多种因素可能对预防SIONF的发生、发展起着重要作用。
本研究发现,与SIONF组比较,PW组从实验第2周开始PT显著延长(P<0.01),持续到实验终点。相反,与CTR组比较,SIONF组从实验第8周开始PT显著缩短(P<0.05),持续至实验终点,APTT结果亦类似变化,这与 Nagasawa等[5]报道结果较吻合。SIONF组股骨头营养血管内血栓形成、而PW组未见明显血栓。华法林有直接全身抗凝作用,普伐他汀降脂药也有抗血小板作用[15],从而改善了SIONF动物全身凝血功能紊乱导致的高凝状态,减少血栓栓塞、降低髓腔内压力,减轻股骨头低氧血症、缺血坏死。临床上虽然华法林常用于治疗静脉系统的血栓防治,例如下肢静脉血栓形成,肺动脉栓塞,而SIONF多发生于髓内营养血管或微小动脉内血栓,但华法林是通过改善SIONF动物循环高凝状态从而减少骨髓内血管血栓而获益。Asada等[20]报道自身骨髓细胞移植干预兔SIONF获益,其机制也是改善外周循环的凝血、纤溶系统而起作用。最近有报道,长期服糖皮质激素系统红班狼疮病人,同时口服华法林能有效减少SIONF发生,特别是无症状的 SIONF患者,但仍无显著差异(P >0.05)[5],其原因可能为SIONF是多种危险因素所致,包括血管内高凝、血脂代谢紊乱、氧自由基作用及血管内皮受损等[18,21],它们之间相互关联促进作用,这多因素对股骨头损害超过华法林有益效果。但对SIONF而言高脂、高凝状态至关重要,有学者提出抗凝、降脂联合应用对SIONF的防治或许收益更大[5]。
本研究应用普伐他汀联合华法林共同干预兔SIONF动物实验初步结果显示,降脂抗凝能降低兔SIONF发生率,而且没有明显的出血倾向发生,这可能与改善实验动物体内高脂高凝状态有关,但SIONF发生有多种危险因素参与,具体机制仍不明了。再者,Motomura等[11]认为,SIONF 的发生与个体对激素的“阈值”有关,糖皮质激素使用超过“阈值”才有可能发生股骨头坏死。另外,本实验没有设立与单用普伐他汀进行比较。这些都值得进一步探讨。
[1]Gladman DD,Urowitz MB,Chaudhry-Ahluwalia V,et al.Predictive factors for symptomatic osteonecrosis in patients with systemic lupus erythematosus[J].J Rheumatol,2001,28(4):761 -765.
[2]Oinuma K,Harada Y,Nawada Y,et al.Osteonecrosis in patients with systemic lupus erythematosus develops very early after starting high dose cordicosteroid treatment[J].Ann Rheum Dis,2001,60(12):1145 -1148.
[3]Assouline - Dayan Y,Chang C,Greenspan A,et al.Pathogenesis and natural history of osteonecrosis[J].Semin Arthritis Rheum,2002,32(2):94-124.
[4]Miyanishi K,Yamamoto T,Yamushita A,et al.Bone marrow fat cell enlargement and a rise in intraosseous pressure in steroid-treated rabbits with osteonecrosis[J].Bone,2002,30(1):185-190.
[5]Nagasawa K,Tada Y,Koarada S,et al.Prevention of steroid-induced osteonecrosis of femoral head in systemic lupus erythematosus by anti- coagulant[J].Lupus,2006,15(6):354-357.
[6]PriTCett JW.Statin therapy decreases the risk of osteonecrosis in patients receiving steroids[J].Clin Orthop Relat Res,2001,(386):173 -178.
[7]Yamamoto T,Irisa T,Sugioka Y,et al.Effects of pulse methylprednisolone on bone and marrow tissues:corticosteriod - induced osteonecrosis in rabbits[J].Arthritis Rheum.1997,40(11):2055-2064.
[8]Nishida K,Yamamoto T,Motomura G,et al.Pitavastatin may reduce risk of steroid-induced osteonecrosis in rabbits:a preliminary histological study[J].Clin Orthop Relat Res,2008,466(5):1054-1058.
[9]Lieberman JR,Scaduto AA,Wellmeyer E.Symptomatic osteonecrosis of the hip after orthatopic liver transplantation[J].Arthroptosty,2000,15(9):767 -771.
[10]Miyanishi K,Yamamoto T,Irisa T,et al.A high low -density lipoprotein cholesterol to high-density lipoprotein cholesterol ratio as a potential risk factor for corticosteroid-induced to orteonecrosis in rabbits[J].Rheumatology(Oxford),2001,40(2):196-201.
[11]Motomura G,Yamamoto T,Miyanishi K,et al.Combined effects of an anticoagulant and lipid-lowing agent on the prevention of steroid-induced osteonecrosis in rabbits[J].Arthritis Rheum,2004,50(10):3387-3391.
[12]Ajmal M,Mates AJ,Kuskowski M,et al.Does statin usage reduce the risk of corticosteroid-related osteonecrosis in renal transplant population?[J].Orthop Clin North Am,2009,40(2):235-239.
[13]Ichiseki T,Kaneuji A,Katsuda S,et al.DNA oxidation injury in bone early after steroid administration is involved in the pathogenesis of steroid-induced osteonecrosis[J].Rheumatology(Oxford),2005,44(4):456 -460.
[14]Scandinavian Simvastatin Survival Study Group.Randomised trial of cholesterol lowing in 4444 patients with coronary heart disease:the Scandinavian Simvastain Survival Study(4S)[J].Lancet,1994,344(8934):1383 -1389.
[15]Liao JK.Isoprenoids as mediators of the biological effects of statins[J].J Clin Invest,2002,110(3):285 -288.
[16]Meroni PL,Raschi E,Testoni C,et al.Statins prevent endolthelial cell activation induced by antiphospholipid(anti-β2-glycoprotein I)antibodies:effect on the proadhesive and proinflammatory phenotype[J].Arthritis Rheum,2001,44(12):2870 -2878.
[17]Sowers J.Effects of statins on the vasculature:implications for aggressive lipid management in the cardiovascular metablic syndrome[J].Am J Cardiol,2003,91(2):14-22.
[18]Massaki K,Mikihiro F,Kennji AT,et al.Vitamin E prevents steroid-induced osteonecrosis in rabbits[J].Acta Orthopaedica,2010,81(1):154 -160.
[19]Li X,Cui Q,Kao C,et al.Lovastatin inhibits adipogenic and stimulates osteogenic differentiation by suppressing.PPAR γ2 and increasing Cbfa1/Runx2 expression in bone marrow mesenchymal cell cultures[J].Bone,2003,33(10):652-659.
[20]Asada T,Kushida T,Umeda M,et al.Prevention of corticosteroid-induced osteonecrosis in rabbits by intra-bone marrow injection of autologous bone marrow cells[J].Rheumatology,2008,47(5):591 -596.
[21]Zhang G,Qin L,Sheng H,et al.A novel semisynthesized small molecule icaritin reduced incidence of steroid-associated osteonecrosis with inhibition of both thombosis and lipid-deposition in a dose-dpendent manner[J].Bone,2009,44(2):345-356.
