HDL3抗脂多糖诱导的人脐静脉内皮细胞损伤*
2011-09-14姚树桐杨娜娜司艳红于凤秀商战平秦树存
桑 慧, 姚树桐, 杨娜娜, 司艳红, 于凤秀, 商战平, 秦树存,△
(泰山医学院 1病理生理学教研室,2动脉粥样硬化研究所,山东泰安271000)
血管内皮损伤是动脉粥样硬化等心血管疾病发病的重要环节。革兰氏阴性细菌外膜成份脂多糖(lipopolysaccharide,LPS)进入血液循环后,可启动炎症反应,刺激大量炎症因子合成释放,趋化炎症细胞并促使其向血管内皮细胞黏附聚集,进而导致血管内皮受损,功能紊乱。流行病学调查表明心血管疾病与高密度脂蛋白(high-density lipoprotein,HDL)水平降低密切相关。HDL是血液中密度最高、颗粒最小的一种脂蛋白,其抗炎活性、胆固醇的逆向转运及抗氧化活性已成为心血管疾病预防的重要靶点[1]。内毒素血症时,HDL与 LPS结合,中和其活性,减少炎症介质的释放,显著改善LPS所致内毒素血症动物模型的损伤[2]。但HDL结构、代谢、功能具有高度异质性,超速离心将人HDL分离为HDL2(1 063-1 125 g/L)和 HDL3(1 125-1 210 g/L)两个亚群,HDL3接受胆固醇、酯化后转化为HDL2。蛋白质组学研究[3]表明 HDL3 富含 apoA-I、apoF、apoJ、apoL-I、PLTP、PON1、PAF-AH 和 LCAT,脂质组学研究[4]表明HDL3含有丰富的鞘氨醇-1-磷脂。炎症或脂质代谢异常时HDL2及中等大小的HDL明显降低,而HDL3水平无明显变化[5]。研究表明HDL3颗粒较 HDL2具有更强的抗氧化性[6]。因此在炎症、血脂代谢异常时HDL3抗动脉粥样硬化的作用至关重要[1,7]。本研究在LPS致人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤模型上,研究富含apoA-I的HDL3对HUVECs炎症性损伤及核因子-κB(nuclear factor kappa B,NF-κB)活化的影响,以进一步探讨HDL的抗炎机制。
材料和方法
1 材料
1.1 主要药品及试剂 人脐静脉内皮细胞株由南京凯基生物工程公司提供,LPS(E.coil O55∶B5)以及噻唑蓝(MTT)购自Sigma;RPMI-1640培养基及胎牛血清购自Gibco;0.25%胰蛋白酶购自Merck;Annexin-Ⅴ/碘化丙啶(propidium iodide,PI)双标记试剂盒购自BD;ELISA试剂盒购自RD;NF-κB p65抗体购自Santa Cruz;增强化学发光(enhanced chemiluminescence,ECL)试剂盒为 Pierce产品;2',7'-二(2-羧乙基)-5(6)-羧基荧光素乙酰氧甲基酯[2',7'-bis(2-carboxyethyl)-5(6)-carboxyfluorescein acetoxylmethyl ester,BCECF-AM]为北京泛博生化产品;其它试剂均为国产分析纯。
1.2 主要仪器 Sanyo CO2培养箱,Olympus倒置显微镜,721分光光度计,Bio-Rad 550酶标仪、流式细胞仪及电泳仪,Beckman超速离心机。
2 HDL3的提取制备
收集正常人新鲜血浆50 mL,根据文献[6]报道方法制备。用 NaBr调整血浆密度为1 006 g/L,于4℃、40 000 r/min离心24 h,去除上层白色絮状物即极低密度脂蛋白;以NaBr调整下层液体密度为1 063 g/L,相同条件下离心48 h,取出上层淡黄色液体后,再以NaBr调整下层液体密度为1 125 g/L,相同条件下离心48 h,取出上层淡黄色液体即HDL2。继续以NaBr调整下层液体密度为1 210 g/L,相同条件下离心48 h,取出上层淡黄色液体即HDL3。将HDL3装入透析袋用含0.1%EDTA的 PBS透析24 h,0.22 μm 微孔滤膜过滤除菌,4℃ 保存备用。BCA试剂盒定量蛋白,调蛋白浓度至1 g/L用于实验。
3 HUVECs的培养及分组
HUVECs株复苏后,用含10%胎牛血清RPMI-1640培养液在37℃、5%CO2培养箱孵育,选用对数生长期细胞用于实验。实验分5组:(1)对照(control)组:正常培养的 HUEVCs;(2)LPS组:1 mg/L的LPS作用6 h;(3)HDL3+LPS组:分别用50 mg/L(HDL3-50)、100 mg/L(HDL3-100)和200 mg/L(HDL3-200)HDL3预孵育HUVECs 18 h后加入1 mg/L LPS作用6 h。
4 检测指标
4.1 HUVECs活力测定 采用MTT比色法检测。常规消化,调整细胞密度为5×108/L,每孔加入200 μL单细胞悬液传至96孔板上,每组6孔。细胞贴壁后吸去培养基,根据分组进行处理;培养终止前4 h,每孔加入5 g/L MTT 溶液 20 μL,2 000 r/min 离心5 min,吸去上清液;加200 μL二甲基亚砜(dimethyl sulfoxide,DMSO)振荡混匀30 min,使结晶完全溶解;全自动酶标仪上,以λ=490 nm,测吸光度值(absorbance,A)。
4.2 流式细胞仪检测细胞凋亡 常规消化,调细胞密度为5×108/L,将细胞传6孔板上,每孔加入1.5 mL,细胞贴壁后吸去培养基,根据分组进行处理。收集各组细胞并以PBS洗涤后,用Binding Buffer悬浮细胞,加入 5 μL Annexin V/FITC混匀,然后加入5 μL PI,混匀后室温避光反应15 min,用流式细胞仪(Ex=488 nm;Em=530 nm)上机检测细胞凋亡情况。实验重复4次。
4.3 单核细胞与HUVECs的黏附实验 在24孔板孔内培养HUVECs至80%汇合,根据分组进行处理。于实验结束前1 h标记THP-1细胞。将THP-1细胞离心洗涤2遍,加入含1 μmol/L的BCECF-AM的无血清RPMI-1640培养基,37℃避光孵育1 h,孵育结束后,离心去除未结合的BCECF-AM;RPMI-1640重悬标记后的THP-1细胞,密度为5×109/L。以RPMI-1640洗涤HUVECs 2次后,加入0.5 mL荧光标记的THP-1细胞,于37℃避光孵育1 h,孵育结束后,吸弃上清,PBS轻轻洗涤3次,去除未结合的THP-1细胞,在倒置荧光显微镜下观察。每孔采图4张,用Image-Pro Plus 6.0图像处理系统计数结合的THP-1细胞数。
4.4 ELISA法检测血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1)蛋白表达 收集各组细胞培养液上清,严格按照ELISA试剂盒操作步骤进行。用Bio-Rad 550型酶联免疫监测仪测量吸光度值A(λ=450 nm),计算培养液中VCAM-1蛋白的量。
4.5 免疫细胞化学法检测NF-κB p65 将细胞接种于放有无菌盖玻片的6孔板中,细胞处理后,冷丙酮固定,按照SABC试剂盒说明操作:3%过氧化物酶灭活内源性过氧化氢酶;BSA封闭,滴加1∶200稀释兔抗NF-κB p65单克隆抗体,室温孵育2 h后加入生物素标记的山羊抗兔Ⅱ抗20 min;SABC溶液孵育15 min后DAB避光显色,蒸馏水冲洗;苏木素轻度复染,脱水,透明,封片。以PBS代替Ⅰ抗孵育作为阴性对照,以细胞核内或核周边出现棕黄色颗粒为阳性表达,每张爬片随机取4个视野、放大400倍采图,用Image-Pro Plus 6.0图像处理系统测量阳性染色部位的累积吸光度(integrated absorbance,IA)进行半定量分析。实验重复4次。
4.6 Western blotting检测NF-κB p65的表达 按照核蛋白提取试剂盒说明书提取细胞核蛋白,BCA法蛋白定量,将蛋白浓度调成一致,并加入5×上样缓冲液,沸水中5 min变性,置-80℃保存。取上述蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE,8%分离胶)电泳(上样量为 50μg),将电泳分离后的蛋白质电转移至PVDF(polyvinylidene difluoride)膜上,经封闭、洗脱后加入兔抗人NF-κB p65单克隆抗体(1∶200),4℃过夜,洗膜后以辣根过氧化物酶标记Ⅱ抗室温孵育1 h,并以兔抗β-actin(1∶8 000)单克隆抗体同上操作,作为上样内参。ECL显色,暗室 X光胶片曝光。采用 Image-Pro Plus图像分析软件分析蛋白条带的IA(IA=平均吸光度值×面积),以靶蛋白IA值与β-actinIA值的比值反映靶蛋白相对水平。
5 统计学处理
结 果
1 HUVECs增殖活性的变化
正常对照组的吸光度值为0.689±0.043,LPS作用于HUVECs 6 h后细胞增殖活力降低(0.626±0.026),与正常对照组比较降低了9.22%(n=6,P<0.01);HDL3显著抑制LPS所致的细胞活力降低,其100 mg/L和200 mg/L预处理组A值(0.692±0.021和0.704±0.034)分别较LPS处理组增加了10.66%和12.61%(n=6,P<0.01),而与对照组无显著差异(n=6,P >0.05)。
2 HUVECs凋亡分析
正常对照组细胞凋亡率为2.32%±0.06%;LPS作用后细胞凋亡率(11.62% ±1.16%)较对照组明显上升(n=4,P<0.01);HDL3预处理后细胞凋亡率明显降低,其100和200 mg/L HDL3预处理组细胞凋亡率分别下降至6.68%±0.78%和4.58%±0.62%,与LPS组比较有统计学差异(n=4,P<0.05或 P <0.01),见图1。

Figure 1.Annexin V/PI double staining was used to detect cell apoptosis by flow cytometry.Control:HUVECs;LPS:1 mg/L LPS+HUVECs;HDL3-50:50mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-100:100mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-200:200mg/L HDL3+1 mg/L LPS+HUVECs.图1 Annexin V/PI双标和流式细胞术检测细胞凋亡
3 单核细胞与HUVECs黏附的比较
在1 mg/L LPS作用6 h后,THP-1细胞与HUVECs黏附增加(P<0.01),较正常对照组增加2.77倍;HDL3预处理显著抑制LPS所诱导的THP-1细胞与HUVECs间的黏附,50、100和200 mg/L HDL3预处理后THP-1细胞黏附数量相对于模型组分别降低了31.84%、47.68%和53.53%(P<0.01),且200 mg/L HDL3预处理后THP-1细胞黏附数量与正常对照相比无显著差异(P>0.05),见图2、3。

Figure 2.THP-1 cells adhenent to HUVECs were observed after HDL3 treatment under fluorescence microscope.Scale bar:250 μm.Control:HUVECs;LPS:1 mg/L LPS+HUVECs;HDL3-50:50 mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-100:100 mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-200:200 mg/L HDL3+1 mg/L LPS+HUVECs.图2 荧光显微镜下观察HDL3处理后THP-1细胞黏附于HUVECs变化

Figure 3.The numbers of THP-1 cells adherent to HUVECs after HDL3 treatment.±s.n=4.#P<0.05,##P<0.01 vs control group;**P <0.01 vs LPS group.图3 HDL3处理后THP-1细胞黏附于HUVECs的数量分析
4 培养液中VCAM -1蛋白的改变
LPS是刺激黏附分子及炎症介质表达的有力的刺激因子,在它的作用下,VCAM-1蛋白表达增加,较正常对照增加1.53倍(P<0.01);HDL3预处理可显著抑制VCAM-1蛋白表达上调,50、100和200 mg/L HDL3预处理后VCAM-1蛋白量分别较模型组降低了19.29%、25.19%和32.72%(P<0.05或P<0.01);200 mg/L HDL3预处理后VCAM-1蛋白与正常对照相比无显著差异(P>0.05),见图4。

Figure 4.Expression of VCAM-1 protein in media after HDL3 treatment.±s.n=4.#P<0.05,##P<0.01 vs control;*P < 0.05,**P < 0.01 vs LPS group.Control:HUVECs;LPS:1 mg/L LPS+HUVECs;HDL3-50:50 mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-100:100 mg/L HDL3+1 mg/L LPS+HUVECs;HDL3-200:200 mg/L HDL3+1 mg/L LPS+HUVECs.图4 HDL3处理后细胞培养液中VCAM -1蛋白表达的变化
5 NF-κB p65表达的检测
5.1 免疫细胞化学检测NF-κB p65的变化 胞核或胞浆出现棕黄色为阳性表达。对照组细胞核蓝染,胞浆着色不明显,即NF-κB p65表达较低;LPS刺激后不仅胞浆着棕黄色,大部分胞核也阳性表达,IA值与对照组相比差异显著(P<0.01);而HDL3预处理后胞浆胞核着色随HDL3作用浓度的增高而逐渐减弱,IA值较模型组分别下降了26.24%、48.76%和60.56%(P<0.05或P<0.01),见图5。

Figure 5.Expression of NF-κB p65 in HUVECs after HDL3 treatment examined by immunocytochemical staining.Scale bar:20 μm.图5 免疫细胞化学染色检测HDL3处理后NF-κB p65蛋白表达
5.2 Western blotting检测NF-κB p65的变化 正常对照组细胞核NF-κB p65表达水平较低;LPS刺激后核内NF-κB p65水平显著增高,较对照组增加14.92倍(P<0.01);HDL3预处理则明显抑制NF-κB的激活,且呈浓度依赖性,其细胞核内NF-κB p65蛋白水平较模型组分别降低28.00%、68.35%和80.79%(P<0.05或P<0.01),见图6。
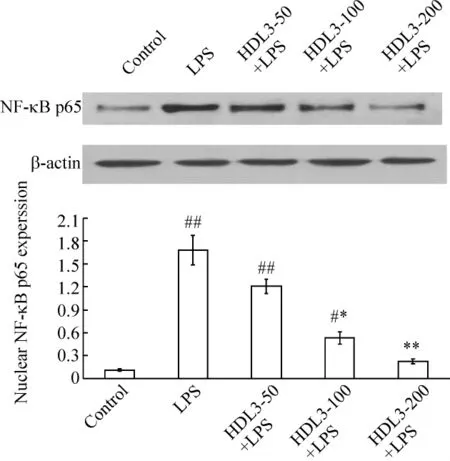
Figure 6.Levels of NF-κB p65 in the nucleus of HUVECs in each group detected by Western blotting.±s.n=4.#P <0.05,##P <0.01 vs control;*P <0.05,**P <0.01 vs LPS group.图6 Western blotting检测各组细胞核内NF-κB p65蛋白表达
讨 论
LPS是导致全身炎症反应的关键介质,进入机体后通过LPS结合蛋白,与CD14阳性细胞结合后,激活细胞内信号转导通路如NF-κB通路,导致炎性介质和细胞因子的过度释放,引发炎性瀑布反应[8],趋化炎症细胞并促使其向血管内皮细胞黏附聚集,进而导致血管内皮受损,功能紊乱。本实验中1mg/L LPS作用于HUVECs后细胞增殖活性降低、凋亡数增加,VCAM-1分子表达增加,NF-κB p65向核内转移,表明LPS诱导HUVECs炎症性损伤。
HDL具有拮抗LPS所诱导的炎症作用,可与LPS结合,直接被肝细胞上的SR-B1受体结合而降解[9,10],还可以通过 HDL 脂质转运、抗氧化作用移除或灭活炎症脂质,进而抵消 LPS的炎症介质作用[11]。但HDL是颗粒大小、密度、组成、功能极不均一的脂蛋白,HDL3相对于HDL2体积小、胆固醇含量低而蛋白含量高。炎症或血脂异常时,HDL结构改变,胆固醇含量减少而甘油三酯增加,这种HDL颗粒apoA-I结合松、易脱落,结果循环中HDL2及中等大小的HDL明显降低,而HDL3颗粒水平相对稳定[5]。富含甘油三酯的HDL2颗粒向肝细胞转运胆固醇功能也受到影响,HDL介导的胆固醇转向了巨噬细胞[7]。因此炎症时HDL3颗粒承担了主要的抗炎作用。
本实验中HDL3预处理HUVECs可显著恢复细胞活力,且呈浓度依赖性。AnnexinV/PI双染法检测细胞凋亡,进一步证实HDL3预处理可以减轻LPS对血管内皮细胞的损伤作用。与Ashby等[12]报道HDL3抑制 VCAM-1的表达一致,我们发现经HDL3处理18 h后,VCAM-1的表达降低,单核细胞与内皮细胞黏附减少。Thaveeratitham等[13]证明贫脂HDL能显著抑制LPS诱导的白细胞黏附,而脂质成分却没有此效应,因此HDL3减轻LPS的损伤作用与HDL3蛋白含量密切相关。LPS的生物学活性中心lipidA的结构非常保守,是LPS分子中最稳定的部分,HDL与LPS结合时LPS的 lipidA插入到HDL分子外壳的磷脂层,有效地封闭LPS的活性中心。HDL3抑制黏附分子表达的能力不仅与HDL3内丰富的载脂蛋白如apoA-I、apoA-IV有关,还与HDL3中存在的磷脂,如鞘氨醇-1-磷脂、磷酯胆碱有关[3,4,9,12]。
NF-κB是已知的调控VCAM-1等炎症因子表达的诱导型核转录因子,静息状态下多以p50和p65二聚体与其抑制蛋白IκB相结合而存在于胞浆中,呈无活性状态。当细胞受到LPS、氧化应激等外源性刺激后,通过信号转导引起IκB降解,导致NF-κB-IκB复合物解体,NF-κB活化进入细胞核,与靶基因特异序列结合并启动转录,介导诸多炎症介质如 VCAM-1、TNF-α、IL-1、IL-6 等过度表达,进而引起炎症细胞黏附聚集,导致组织细胞级联放大的炎症损伤反应[14]。本实验免疫细胞化学染色及Western blotting检测均表明HDL3预处理可抑制NF-κB p65向细胞核中转移,进一步证实HDL3降低了LPS介导的炎症反应。尽管有报道[15]HDL在急性炎症反应时,可转化为促炎介质,但本实验中的得到的数据仍支持HDL的抗炎作用,其中HDL3可能起了决定性的作用。
综上所述,HDL3可通过抑制NF-κB所介导的炎症反应减轻HUVECs损伤。但有关HDL3抗炎机制的研究尚需从其结构组成进一步深入探讨。
[1]Kontush A,Chapman MJ.Functionally defective highdensity lipoprotein:a new therapeutic target at the crossroads of dyslipidemia,inflammation,and atherosclerosis[J].Pharmacol Rev,2006,58(3):342-374.
[2]黄 英,顾 玲,王树人,等.人血浆高密度脂蛋白对大鼠内毒素血症的治疗及防护作用研究[J].中国病理生理杂志,2002,18(10):1169-1172.
[3]Davidson WS,Silva RA,Chantepie S,et al.Proteomic analysis of defined HDL subpopulations reveals particlespecific protein clusters:relevance to antioxidative function[J].Arterioscler Thromb Vasc Biol,2009,29(6):870-876.
[4]Kontush A,Therond P,Zerrad A,et al.Preferential sphingosine-1-phosphate enrichment and sphingomyelin depletion are key features of small dense HDL3 particles:relevance to antiapoptotic and antioxidative activities[J].Arterioscler Thromb Vasc Biol,2007,27(8):1843-1849.
[5]Watanabe H,Söderlund S,Soro-Paavonen A,et al.Decreased high-density lipoprotein(HDL)particle size,prebeta-,and large HDL subspecies concentration in Finnish low-HDL families:relationship with intimamedia thickness[J].Arterioscler Thromb Vasc Biol,2006,26(4):897-902.
[6]Zerrad-Saadi A,Therond P,Chantepie S,et al.HDL3-mediated inactivation of LDL-associated phospholipid hydroperoxides is determined by the redox status of apolipoprotein A-I and HDL particle surface lipid rigidity:relevance to inflammation and atherogenesis[J].Arterioscler Thromb Vasc Biol,2009,29(12):2169-2175.
[7]Kontush A,Chapman MJ.Antiatherogenic small,dense HDL-guardian angel of the arterial wall?[J].Nat Clin Pract Cardiovasc Med,2006,3(3):144-153.
[8]Zhang G,Ghosh S.Molecular mechanisms of NF-κB activation induced by bacterial lipopolysaccharide through Toll-like receptors[J].J Endotoxin Res,2000,6(6):453-457.
[9]Ulevitch RJ,Johnston AR,Weinstein DB.New function for high density lipoproteins:isolation and characterization of a bacterial lipopolysaccharide-high density lipoprotein complex formed in rabbit plasma[J].J Clin Invest,1981,67(3):827-837.
[10]Guo L,Song Z,Li M,et al.Scavenger receptor BI protects against septic death through its role in modulating inflammatory response[J].J Biol Chem,2009,284(30):19826-19834.
[11]Galbois A,Thabut D,Khalid A,et al.Ex vivo effects of high density lipoprotein exposure on the lipopolysaccharide-induced inflammatory response in patients with severe cirrhosis[J].Hepatology,2009,49(1):175-184.
[12]Ashby DT,Rye KA,Clay MA,et al.Factors influencing the ability of HDL to inhibit expression of vascular cell adhesion molecule-1 in endothelial cells[J].Arterioscler Thromb Vasc Biol,1998,18(9):1450-1455.
[13]Thaveeratitham P,Khovidhunkit W,Patumraj S.Highdensity lipoproteins(HDL)inhibit endotoxin- induced leukocyte adhesion on endothelial cells in rats:effect of the acute-phase HDL[J].Clin Hemorheol Microcirc,2007,36(1):1-12.
[14]张 钧,范小兵,沙大年,等.核因子-κB在心血管疾病中的作用及在治疗中的潜在意义[J].中国病理生理杂志,2004,20(3):493-496.
[15]Thompson PA,Kitchens RL.Native high-density lipoprotein augments monocyte responses to lipopolysaccharide(LPS)by suppressing the inhibitory activity of LPS-binding protein[J].J Immunol,2006,177(7):4880-4887.
