NCA增加心肌收缩力的作用研究*
2011-09-14贾洪丽侯俊青王育文李志韬
钟 鑫, 贾洪丽, 侯俊青, 王育文, 时 飒, 李志韬
(哈尔滨医科大学1病理生理教研室,黑龙江生物医药工程重点实验室,2附属第二医院检验科,黑龙江哈尔滨150081)
NO影响心脏功能的作用已经被广泛报导,而作为它的去电子形式 -硝酰基(nitroxyl,HNO)对心脏功能的影响最近才被关注[1]。HNO在正常及衰竭[2,3]心脏都起到正性、非负荷依赖性肌力作用。研究表明HNO具备β受体激动剂的作用且不被β受体阻滞剂所阻断。NO或硝酸盐所产生的HNO在体内对心血管活动作用非常明显,因为后者在静息心肌上只表现适度的正性肌力效应[4]。与NO不同的是,如果细胞内还原当量的含量增加,HNO活性则明显减低甚至消失[10],该结果支持了HNO基本化学作用中以硫基为靶点的论断[1]。
HNO生理作用表明其可以作为心衰的一种新型治疗手段,同时增加了对心衰细胞和分子机制进一步的理解。HNO能够刺激钙离子从心肌及骨骼肌[5]的ryanodine受体 (RyR)释放。在心肌细胞,最初研究资料表明此作用是不依赖cGMP及cAMP的信号转导方式[6]。除对钙离子影响之外,HNO也可能与原肌球蛋白(tropomyosin,Tm)相互作用改变其收缩反应。NO及其相关物质如过亚硝酸盐[7,8]则以cGMP依赖的方式减低肌原纤维对钙离子的反应能力。HNO在可调节性细肌丝和/或肌原纤维蛋白上可能作用于巯基靶点改变张力的产生。
以往研究使用HNO供体,Angeli’s salt(AS)。AS不是纯HNO供体,而是同时释放HNO和亚硝酸盐[9]。亚硝酸盐不刺激心肌产生收缩性反应,在体内主要导致血管舒张[3]。乙酸1-亚硝基环已酯(1-nitrosocyclohexyl acetate,NCA)不释放亚硝酸盐,是较纯的HNO供体,其发展将对HNO生化作用及机制进行更有效的分析。目前的研究用来检测NCA是否改变了肌原纤维对钙离子的反应能力。应用完整的大鼠梳状肌,观察了HNO供体NCA对心脏兴奋 -收缩偶联的影响。我们发现NCA以剂量依赖的方式增加[Ca2+]i水平及心肌收缩力,同时增强肌原纤维对钙离子的反应性。NCA效应被还原剂二硫苏糖醇 (dithiothreitol,DTT)阻断,支持硫醇盐在此过程中发挥靶点角色的论断。
材料和方法
1 动物及试剂
20只Sprague-Dawley大鼠,体重250-300g,由哈尔滨医科大学实验动物中心提供;NCA由美国约翰霍普金斯大学高卫东实验室赠予。
2 梳状肌制备
大鼠腹腔注射戊巴比妥 (100 mg/kg)麻醉,沿胸骨中部切开暴露心脏,迅速摘除心脏并将其放置在标本盘中。室温下(21-22℃)进行主动脉插管并用含有95%O2及5%CO2的解剖Krebs-Henseleit(K-H)液逆行灌流。K-H液组成(mmol/L):NaCl 120,NaHCO320,KCl 5,MgCl21.2,葡萄糖10,CaCl20.5 及2,3 - 丁二酮 20,pH 7.35 - 7.45。取自于右心室的梳状肌置于张力换能器和刺激电极之间。然后,对其进行K-H液表面灌流(10 mL/min),同时给予频率为0.5 Hz的刺激。解剖显微镜下 (×40,分辨率10 μm)标准刻度线测量梳状肌的尺寸。
3 张力及肌小节长度的测定
应用张力换能系统 (KG7,Scientific Instruments GmbH)对收缩力进行测量并以mN/mm2横断面积来表示。肌小节长度通过激光衍射法[10]进行测量。通过网状二极管线阵系统 (RC0100-RG512,EG&G Reticon)检测肌肉中部衍射光线。衍射的初级光强度被整合,应用定制的肌小节长度检测系统(University of Calgary)测出光强度分布中值,从而决定肌小节长度。实验过程中静息肌小节长度设定为2.2 -2.3 μm。
4 [Ca2+]i测定
应用Fura-2游离酸的形式对[Ca2+]i进行测定[11]。Fura-2钾盐采用离子透入法用玻璃电极显微注射入一个细胞,经缝隙连接扩散至整个肌组织。微电极顶端 (直径0.2 μm)充满Fura-2盐溶液 (1 mmol/L),其余部分用150 mmol/L KCl充满。在静息肌组织中成功用微电极刺入表面细胞后,不间断传送5-10 nA超极化电流15 min。在一些肌组织不同部位可以重复注射 (最多3-4次),每个部位注射持续时间 <10 min以达到较好的信噪比。如前所述:此负载不影响张力发展[11]。Fura-2回波荧光在380 nm及340 nm激发并测定,在510 nm用光电倍增管 (R1527,Hamamatsu)收集荧光并进行数字化分析。通过下列方程得出[Ca2+]i(减去自发荧光):[Ca2+]i=K’d(R - Rmin)/(Rmax-R)。R是实测的荧光率 (340/380),K’d是表观解离常数,Rmax是[Ca2+]i饱和时340 nm/380 nm 比率,Rmin是[Ca2+]i为 0时 340 nm/380 nm 比率。K’d,Rmax及 Rmin的值由前述体内校准法[11]所决定。
5 梳状肌稳态激活作用及去肌膜心肌组织收缩力的测定
Ryanodine(1.0 μmol/L)应用于稳态激活作用。暴露于 ryanodine 15 min后,在多种[Ca2+]o(0.5-20.0 mmol/L)下以10 Hz频率刺激肌组织,不同水平的强直被暂时(4-8 s)诱导出现。1%Txiton X-100应用于梳状肌去肌膜反应。心肌组织被1%Txiton X -100作用10 min后,膜性结构破坏,仅保留蛋白质骨架结构进行实验。实验过程均在室温下(20-22℃)进行。
6 Western blotting检测
取右心室心肌组织蛋白提取液,室温下SDSPAGE电泳,4℃转膜,5%脱脂奶粉室温封闭1 h,常规洗脱,相应Ⅰ抗 (1∶3 000稀释)和Ⅱ抗 (1∶2 000稀释)孵育,反复洗膜后碱性磷酸酶试剂显色。Quality图像分析系统对免疫印记结果进行定量分析。
7 统计学处理
结 果
1 NCA增加完整大鼠梳状肌收缩力的作用强于增加[Ca2+]i效应
图1可见,给予NCA出现典型的收缩力及相应的[Ca2+]i变化。收缩力的增强不是由于K -H缓冲液的碱化所致,因为检测缓冲液pH不发生变化。图1显示收缩力增强而舒张力变化不明显,同时,收缩期[Ca2+]i增加而舒张期[Ca2+]i不变。两者均增加的情况下,收缩期力的增加比收缩期[Ca2+]i变化更为显著,该结果支持NCA增加肌原纤维对钙离子的敏感性。
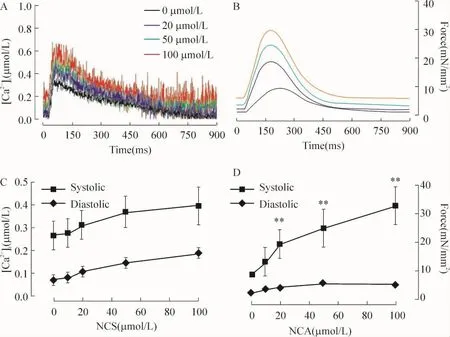
Figure 1.Changes of force(B,D)and[Ca2+]itransient(A,C)treated with various concentrations of NCA.A,B:time-course changes;C,D:changes in systolic and diastolic phases.Temperature:22 ℃;sarcomere length=2.2 μm;[Ca2+]o=0.5 mmol/L±s.n=8-9.*P<0.05,**P<0.01 vs before drug.图1 收缩力与[Ca2+]i的变化
不同频率条件下 (0.5-3.0 Hz)同对照组相比,NCA处理组始终表现明显更高的收缩力(P<0.01),而[Ca2+]i变化则无明显差别 (P >0.05),见图2。
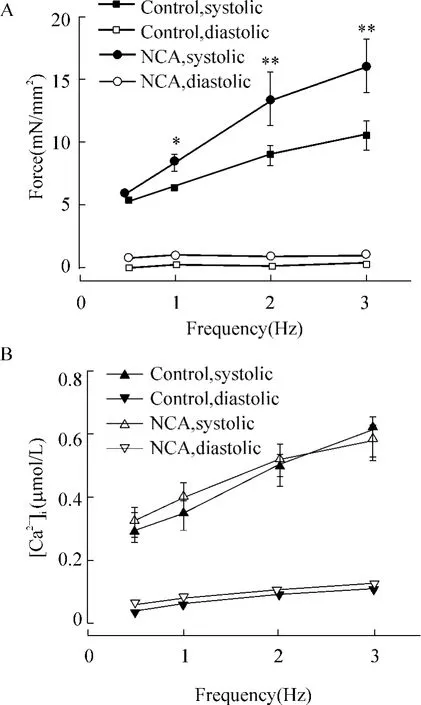
Figure 2.Changes of force(A)and[Ca2+]itransient(B)at different frequencies(0.5-3.0 Hz)before and after NCA treatment.Experimental temperature was 22℃.Sarcomere length was set at 2.2 μm and[Ca2+]o=0.5 mmol/L.±s.n=9.*P<0.05,**P<0.01 vs control.图2 收缩力-频率相互关系
2 NCA增加完整大鼠梳状肌对钙离子的反应性
对照组最大钙离子活化张力为(90.0±4.2)mN/mm2,达到 50% 活性需要[Ca2+]i(Ca50)为(0.57±0.03)μmol/L。给予NCA后,心肌收缩力峰值增加[(124.0±15.0)mN/mm2,P < 0.05 vs control],达到 50% 活性需要[Ca2+]i明显降低[(0.39±0.01)μmol/L;P < 0.01 vs control]。给予NCA的心肌组织,其希尔系数没有受到影响 (3.94±0.18 vs 4.92 ±0.84,P>0.05)。由此可见,NCA/HNO可以增强最大钙离子活化张力。给予NCA后,不同细胞外钙浓度 (0.01 -100 μmol/L)去肌膜心肌组织心肌收缩力峰值增加,Ca50降低[NCA - group,Ca50=0.3 μmol/L,P < 0.01 vs control(1.35 μmol/L);Fmax=(90.1 ± 1.6)mN/mm2,P <0.05 vs control[(85.2 ± 1.2)mN/mm2],见图3。
3 NCA诱导下张力发展对细胞内还原当量的敏感性

Figure 3.Steady-state force-Ca2+relations in intact(A)and skinned(B)muscles.±s.n=9(A)or n=6(B).*P <0.05 vs control.图3 NCA增加心肌纤维对Ca2+反应性
DTT对于基本的收缩力无效;然而,它能阻断NCA(20 μmol/L)诱导的Ca2+敏感作用。DTT在5-10 min内逆转NCA增加收缩力作用,见图4。在无DTT存在条件下,收缩力将保持其兴奋性长达20 min以上。由此可见,DTT可以阻止并逆转NCA对收缩力的作用效果。

Figure 4.DTT(5 mmol/L)not only prevented but also reversed the effect of NCA on force development.±s.n=6.*P< 0.05 vs NCA.图4 DTT影响NCA增加收缩力的作用
4 NCA增加心肌收缩力通过肌原纤维蛋白质巯基翻译后修饰来实现
非还原条件下 (无DTT)NCA/HNO使肌原纤维(如Tm)分子发生交联,而还原条件则交联条带消失,见图5。

Figure 5.Western blotting of cardiac non- reducing(A)and reducing(B)tropomyosin(39 kD).A cross- linking band(78 kD)in tropomyosin was seen under non- reducing condition.There was no change in reducing tropomysim.M:marker.10 μg,20 μg and 30 μg:the total protein loading quantity.图5 NCA在还原条件下对Tm的翻译后修饰作用
讨 论
本实验首次研究了NCA提供的HNO在分离、完整的心肌组织上产生一种直接剂量依赖性的正性变力作用。该作用不仅包括增加了心肌收缩力和[Ca2+]i瞬时电流峰值,而且由于最大[Ca2+]i升高活化了张力,使得这些变化在敏感性上的增长是不对称的。此反应与NO作用效果不同,可被还原剂DTT所阻断,同时具备较强的氧化还原反应敏感性。
NO与HNO仅相差1个电子。然而,HNO被认为能应用巯基化合物和高铁蛋白进行加成反应[12]而NO则不能。NO的靶点首先是非氧合细胞溶质内可溶解性二价铁鸟苷酸环化酶,而HNO生物活性的主要靶点则是巯基蛋白质或巯基肽[1]。尽管NO cGMP非依赖性收缩效应已经被证实,但大部分NO对心脏的作用仍与cGMP/PKG激活作用相关。一项重要的证据支持cGMP/PKG的激活是NO(及其被氧化的同源物质)对心脏进行调节的主要转导途径,借此减低了肌原纤维对Ca2+脱敏后的收缩性[7]。这样的脱敏作用被认为对加速心肌舒张具有重要意义。该作用可因PKG药物阻断或遗传缺失,或心肌钙蛋白I在Ser23/24位点磷酸化[13]而被抑制。活性氮类物质过亚硝酸盐也能降低肌原纤维对钙离子的反应性,导致心脏抑制效应,部分效应是由 PKG介导的[8]。
由NCA提供的HNO反应则完全不同,这可能由于其与鸟苷酸环化酶或作为收缩机制的主要靶点半胱氨酸残基相互作用。研究表明HNO对选取的硫醇盐(-S·)发生反应,对巯基化合物亚群(-SH)也有高反应性[1],这些反应都证实了HNO具有选择性和作用可逆性。目前和以往资料表明,收缩作用可迅速用DTT逆转。在分离的家兔心脏肌浆网囊泡[5]或大鼠心肌细胞上[8]研究发现HNO诱导的肌浆网钙离子的释放也可被DTT完全逆转。最近在酵母的一项研究中也显示了HNO选择性,不改变细胞内巯基化合物前提下,HNO在其活化位点硫醇盐残基内具有特异性的靶点磷酸甘油醛脱氢酶[14]。我们假设NCA/HNO可以在肌原纤维和/或调节蛋白质内的半胱氨酸“靶点”上诱发相似的具有选择性的化学修饰,Western blotting证实NCA在非还原条件下使肌原纤维的Tm分子发生交联,该作用可能促进横桥转换率发生变化,进而增加收缩张力的产生。进一步的研究旨在明确这些变化的分子性质和位点。
HNO增加最大Ca2+活化张力机制至今尚不清楚。然而,研究表明仅最大Ca2+活化张力的增加即可导致横桥的变化。张力发展依赖于相关横桥的数目及其动力学特征。横桥转换率能明显影响张力 -pCa之间的相互关系,从而增加与Ca2+活化张力相关性的比率。HNO诱导的横桥循环性的改变是引起改变收缩性的唯一途径,这与在调节蛋白质内进行变化来调节收缩性的机制密切相关。
我们的研究也证实了在完整心肌组织内[Ca2+]i增加是由NCA诱导的。尽管[Ca2+]i的增加与肌原纤维致敏作用的相关性已经被证实,但这种增加可能是在较高NCA剂量条件下成为增强心肌收缩力的基础。在分离的小鼠肌细胞实验研究中,HNO可以增加钙离子的吸收及其从肌浆网的释放,适当增加瞬时电流而不出现舒张期钙离子的逆转[6]。这可以对目前研究中所观察的[Ca2+]i的变化进行解释。这些机制与致敏效应一起表明HNO对心脏肌原纤维及肌浆网具有新奇的效应,可以在缺乏能量供应的条件下增加心肌潜在的收缩能力。
总言之,NCA提供的HNO能增强大鼠心肌组织收缩力和细胞内钙瞬变,且前者变化幅度大于后者,这种作用部分由于肌原纤维对钙离子敏感性的增加所致。该作用对于还原性环境较敏感。该作用的主要分子靶点可能是Tm半胱氨酸的巯基蛋白质。进一步研究需要证实NCA对心力衰竭动物模型心肌收缩力的作用效果,为实现NCA/HNO的临床应用奠定基础。
[1]Fukuto JM,Bartberger MD,Dutton AS,et al.The physiological chemistry and biologicalactivity ofnitroxyl(HNO):the neglected,misunderstood,and enigmatic nitrogen oxide[J].Chem Res Toxicol,2005,18(5):790–801.
[2]Paolocci N,Saavedra WF,Miranda KM,et al.Nitroxyl anion exerts redox-sensitive positive cardiac inotropy in vivo by calcitonin gene - related peptide signaling[J].Proc Natl Acad Sci USA,2001,98(18):10463–10468.
[3]Paolocci N,Katori T,Champion HC,et al.Positive inotropic and lusitropic effects of HNO/NO-in failing hearts:independence from β - adrenergic signaling[J].Proc Natl Acad Sci USA,2003,100(9):5537–5542.
[4]Preckel B,Kojda G,Schlack W,et al.Inotropic effects of glyceryl trinitrate and spontaneous NO donors in the dog heart[J].Circulation,1997,96(8):2675 –2682.
[5]Cheong E,Tumbev V,Abramson J,et al.Nitroxyl triggers Ca2+release from skeletal and cardiac sarcoplasmic reticulum by oxidizing ryanodine receptors[J].Cell Calcium,2005,37(1):87–96.
[6]Tocchetti CG,Wang W,Froehlich JP,et al.Nitroxyl improves cellular heart function by directly enhancing cardiac sarcoplasmic reticulum Ca2+cycling[J].Circ Res,2007,100(1):96-104.
[7]Layland J,Li JM,Shah AM.Role of cyclic GMP-dependent protein kinase in the contractile response to exogenous nitric oxide in rat cardiac myocytes[J].J Physiol,2002,540(2):457–467.
[8]Brunner F,Wolkart G.Peroxynitrite- induced cardiac depression:role of myofilament desensitization and cGMP pathway[J].Cardiovasc Res,2003,60(2):355 –364.
[9]Miranda KM,Dutton AS,Ridnour LA,et al.Mechanism of aerobic decomposition of Angeli’s salt(sodium trioxodinitrate)at physiological pH[J].J Am Chem Soc,2005,127(2):722–731.
[10]Gao WD,Dai T,Nyhan D.Increased cross-bridge cycling rate in stunned myocardium[J]Am J Physiol Heart Circ Physiol,2006,290(2):H886– H893.
[11]Gao WD,Perez NG,Marban E.Calcium cycling and contractile activation in intact mouse cardiac muscle[J].J Physiol,1998,507(1):175–184.
[12]Miranda KM,Paolocci N,Katori T,et al.A biochemical rationale for the discrete behavior of nitroxyl and nitric oxide in the cardiovascular system[J].Proc Natl Acad Sci USA,2003,100(16):9196–9201.
[13]Bilchick KC,Duncan JG,Ravi R,et al.Heart failureassociated alterations in troponinⅠphosphorylation impair ventricular relaxation-afterload and force-frequency responses and systolic function[J].Am J Physiol Heart Circ Physiol,2007,292(1):H318– H325.
[14]Lopez BE,Rodriguez CE,Pribadi M,et al.Inhibition of yeast glycolysis by nitroxyl(HNO):mechanism of HNO toxicity and implications to HNO biology[J].Arch Biochem Biophys,2005,442(1):140–148.
