STAT4基因与吉林人群强直性脊柱炎关联研究
2011-09-14张建佚宋玉国张吉林朱小泉张玉荣黄慈波霍正浩
杨 帆 张建佚 周 林 宋玉国 张吉林 朱小泉 张玉荣 黄慈波 霍正浩 杨 泽
强直性脊柱炎(ankylosing spondylitis,AS)属类风湿因子阴性慢性进行性炎性疾病,主要侵犯骶髂关节及中轴骨骼,也可累及髋关节、外周关节及韧带附着点等,可引起椎间盘纤维环及其附近韧带钙化和骨性强直。此病炎症高度活动和低度活动相交替,好发于青少年,发病者多为10~40岁的男性。黄种人中发病率为0.2% ~0.5%,男性患者多于女性患者,男女比例为10∶1[1]。强直性脊柱炎的病因及发病机制尚不清楚,目前普遍认为是遗传因素与环境因素相互作用的结果。
STAT4属转录活化因子(signal transducer and activator of transcription,STAT)家族,主要被 IL-12激活,在 Th1/Th2的分化调控及因其失调引发的各种炎症性疾病中有重要的作用。STAT4是Th1细胞发育必不可少的,若STAT4缺失可减轻T细胞介导的炎症反应。在实验性变态反应脑脊髓炎、关节炎、大肠炎、心肌炎及非肥胖型糖尿病小鼠模型实验中,与野生型小鼠相比,STAT4缺陷小鼠的炎症反应更轻,且发病率更低[2,3]。
我们希望通过观察STAT4基因上rs7574865、rs8179673、rs10181656和rs7582694在吉林强直性脊柱炎患者及正常对照人群之间的分布频率,以探讨 rs7574865、rs8179673、rs7582694和rs10181656与吉林人群强直性脊柱炎患病风险之间的关联。
1.材料和方法
1.1 实验材料
1.1.1 研究对象 强直性脊柱炎患者来自北华大学附属医院检验中心,其中男性40名,女性16名,共56名,男女性别比约2∶1,年龄范围(14~44)岁,平均年龄24岁;56名对照血液标本来自吉林地区的无血缘关系的健康正常人群,男性43名,女性13名,年龄范围(39~72)岁,平均年龄46岁。所有病例均符合1985年修订的纽约诊断标准[4]。所有研究对象均对该检测项目知情同意,并提供外周血用于实验。
1.1.2 主要试剂 全基因组DNA提取试剂盒购自Bio Chain公司;Taq DNA聚合酶和dNTP购自北京鼎国生物技术有限公司;LC-Green Plus饱和荧光染料购自美国Idaho公司;限制性内切酶购自MBI Fermentas公司。引物由上海生工生物技术开发有限公司合成;基因测序由华大基因测序部完成。
1.1.3 主要仪器 PCR扩增仪为美国MJ公司的PTC-225型PCR仪;高分辨熔解曲线(HRM)基因突变/基因分型检测系统为美国Idaho公司Lightscanner TMHR-I 96;DNA定量分析仪为德国Eppendorf公司的Biophotometer蛋白/核酸比色仪。凝胶成像系统为美国Bio-Rad公司的Gel DOC-2000成像系统。离心机为美国Beckman公司的Allegra TM 21R型离心机。
1.2 实验方法
1.2.1 基因组DNA提取及定量 取EDTA抗凝的受试者外周血0.5ml,用全基因组DNA提取试剂盒抽提DNA,通过蛋白/核酸比色仪对提取的基因组DNA进行浓度和纯度的分析。根据测定结果将样本DNA稀释至20μg/μl的工作液置于4℃冰箱。
1.2.2 基因分型方法 采用聚合酶链式反应-高分辨率熔解曲线(PCR-HRM)及聚合酶链式反应-限制性位点多态性(PCR-RFLP)技术,并结合测序验证分型结果。rs7574865、rs8179673和rs7582694位点用PCR-HRM技术进行分型,rs10181656位点用传统的 PCR-RFLP技术进行分型。
1.2.3 引物合成 从Genebank中查得这4个SNPs位点上下游序列,通过Oligo 6.0和Primer5.0软件设计引物。rs7574865引物序列为:F:5'-AATTACATGAGTGTGTATGCAGTAAA -3',R:5'-CCCTGAAATTCCACTGAAATAAGAT -3';rs8179673引物序列为:F:5'-CTGCCATAGAAGTCTTTGAAGC-3',R:5'-GATGATGATGTGTATGGTGGTT-3';rs10181656引物序列为:F:5'-ACTGTGATAGATAACTAGCTGGAAT-3',R:5'-AAAGCAGGGAACGAGGAAGAT-3';rs7582694引物序列为:F:5'-CCTTCCAATGGTTTCTCATTTCAA -3',R:5'- AAAGAACAAGCAAACATGCATAG -3';低温内参:F:5'-TTAAATTATAAAATATTTATAATATTAATTATATATATATAAATATAATA - 3',R:5'- TATTATATTTATATATATATAATTAATATTATAAATATTTTATAATTTAA-3';高温内参:F:5'-GCGCGGCCGGCACTGACCCGAGACTCTGAGCGGCTGCTGGAGGTGCGGAAGCGGAGGGGCGGG -3',R:5'-CCCGCCCCTCCGCTTCCGCACCTCCAGCAGCCGCTCAGAGTCTCGGGTCAGTGCCGGCCGCGC-3'。寡核苷酸内参末端用C3封闭,以阻止延伸反应。
1.2.4 PCR反应 PCR反应体系均为10μl。HRM用PCR 体系含:模板 DNA 1μl,10 × PCR Buffer 1μl,dNTP(10mmol/L)0.2μl,Taq DNA 聚合酶(5U/μl)0.2μl,上下游引物各(10pmol/μl)0.1μl,上下游高低温内参各 0.05μl,1 × LC-Green Plus饱和荧光染料 1μl及双蒸水 6.2μl。RFLP 用PCR 体系包含:模板 DNA 1μl,10 × PCR Buffer 1μl,dNTP(10mmol/L)0.2μl,Taq DNA 聚合酶(5U/μl)0.2μl,上下游引物各0.1μl及双蒸水7.4μl。PCR反应条件为:95℃预变性5min后进入主循环,95℃变性30s,退火,72℃延伸(rs7574865退火温度为61℃,退火时间为20s,延伸时间为7s;rs8179673退火温度为 52℃,退火时间为 25s,延伸时间为 12s;rs10181656退火温度为61℃,退火时间为30s,延伸时间为30s;rs7582694退火温度为53℃,退火时间为25s,延伸时间为12s),总共35个循环,完成后72℃延伸7min。之后用HRM技术分型的样本需进行变性和复性处理,程序为:95℃ 30s,25℃ 2min,94℃ 30s,24℃ 4min。rs7574865 PCR 扩增产物长56bp,rs8179673 PCR扩增产物长104bp,rs10181656 PCR扩增产物长101bp,rs7582694 PCR扩增产物长120bp。
1.2.5 HRM检测 将PCR产物移入HRM专用96孔板内,在Light Scanner TMHR-I 96上进行HRM分析:从45℃开始,以0.3℃/s的斜率采集熔解曲线,到98℃结束,用Light Scanner Call IT软件对采集后的曲线进行分析,判定基因型。
1.2.6 RFLP分型 PCR产物经8%PAGE电泳后,凝胶成像观察PCR扩增结果,符合要求后,用DdeⅠ酶进行酶切,时间控制在7~8小时。酶切完成后8%PAGE电泳,凝胶成像观察分型结果。酶切体系共 10μl,其中包括:Buffer 1μl,DdeⅠ酶0.3μl,双蒸水5.7μl和 PCR 产物3μl。
1.2.7 测序验证 根据HRM分析的不同曲线及酶切结果确定不同的基因型。从所得的不同基因型的个体中分别随机抽取5例样本进行测序验证。测序样本重新进行PCR扩增,测序用PCR引物与PCR反应所用引物相同。PCR反应体系 50μl,包含:DNA 模板 5μl,10 × PCR Buffer 5μl,10 mmol/L dNTP 1μl,Taq DNA 聚合酶(5U/μl)1μl,上下游引物(10pmol/μl)各0.5μl,去离子水补充总体积至50 μl。PCR反应条件与第一次PCR条件相同。PCR产物经8%聚丙烯酰胺凝胶电泳检测,经凝胶成像系统观察合格后送华大基因测序部进行测序验证。
1.3 统计学方法 运用Hardy-Weinberg平衡检验研究样本的群体代表性。用比数比(OR)值及其95%可信区间(95%CI)来评价相对风险。组间基因型频率及等位基因频率比较采用χ2检验,以P<0.05为差异显著性标准。
2.结果
2.1 STAT4基因分型结果 PCR产物经HRM分析后,可根据样本的熔解曲线差异,将所有样本分为3个组。3组之间的熔解曲线差异非常明显,见图1。测序结果进行网上BLAST比对,序列完全一致。rs10181656PCR产物经DedⅠ酶切后,GG型为两个条带,分别长66bp和35bp;GC型为三个条带,分别长 101bp、66bp和 35bp;CC型为一个条带,长101bp,见图2。HRM及RFLP分型结果与测序的结果完全吻合,准确率为100%,测序图见图2。
2.2 STAT4基因型和等位基因频率在病例组及正常对照中的分布 用SPSS 16.0软件对STAT4基因上4个SNP位点rs7574865、rs8179673、rs10181656及rs7582694在病例和对照中基因型和等位基因频率分布进行分析后,发现无显著性差异(P >0.05),见表1。
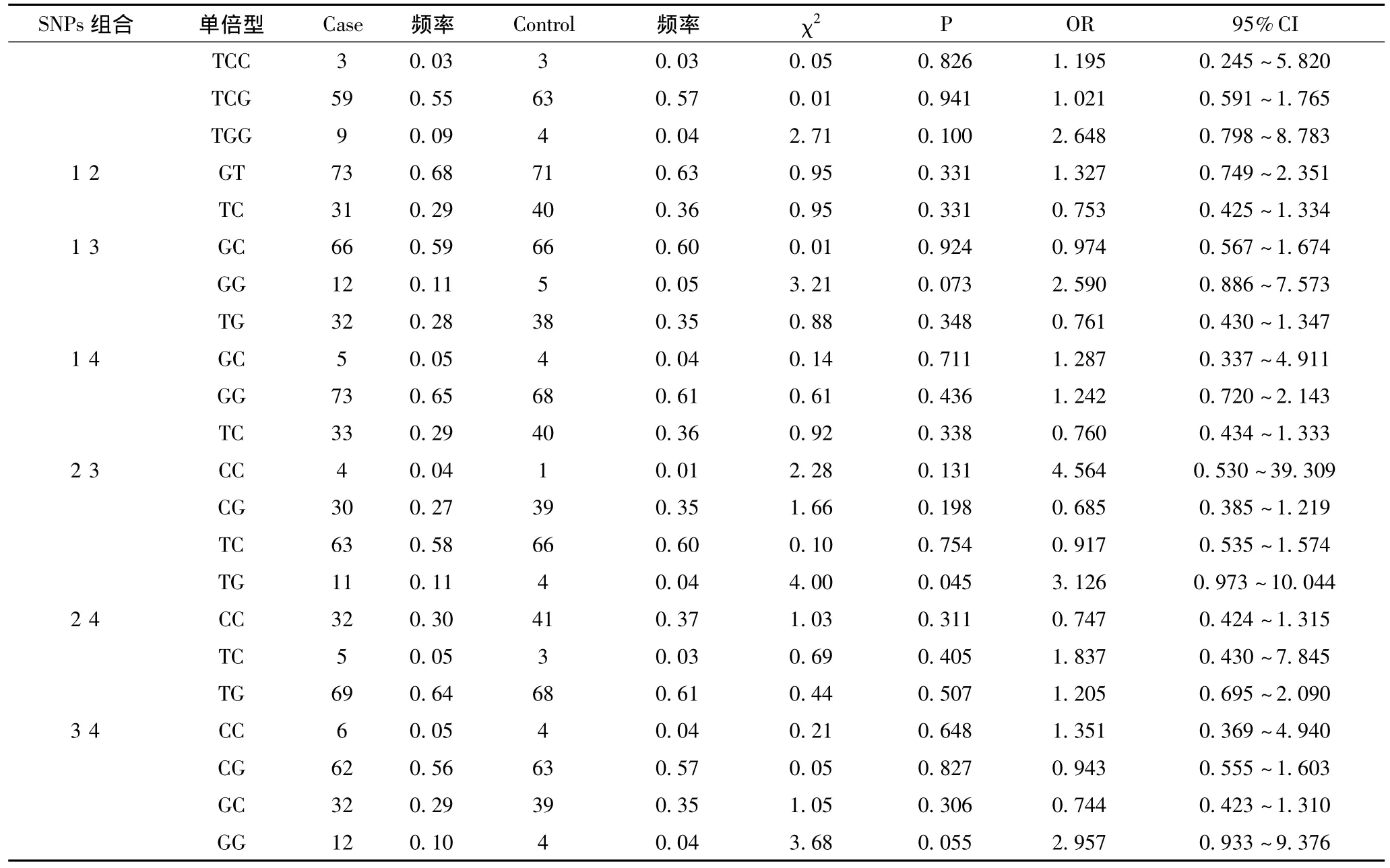
2.3 STAT4基因单倍型频率和风险分析 用SHEsis在线软件将这4个SNPs组成的单倍型进行频率和风险分析后,结果只有rs8179673和rs10181656组成的单倍型TG在病例和对照中分布具有显著性差异(P=0.045;OR=3.126,95%CI:0.973~10.044),见表2。

表1 吉林人群中STAT4基因型和等位基因频率分布比较

表2 STAT4基因单倍型频率和风险分析
续表2
3.讨论
STAT4基因定位于2q32.2-32.3,全长121kb,含24个外显子,编码序列(CDS)区由2247个连续核苷酸组成,编成748个氨基酸。STAT4具有STAT家族其他成员相似的蛋白结构,均由C端的转录激活区,近C端的Src同源结构域及所有STAT共有的701氨基酸上的酪氨酸位点,中部的DNA结合域及N端保守区等几部分构成。但STAT4的表达谱不及其他STAT蛋白广泛,主要分布在淋巴和髓系组织中。STAT4主要由 IL -12 激活,但也可被 IFN - α/β,IL -23 激活[5,6]。IL-12与受体(IL-12R)特异性结合,IL-12R发生二聚化,激活JAK,继而受体信号转导链特定区域酪氨酸位点磷酸化,招募STAT4单体,JAK对STAT4单体产生激活作用。活化后的STAT4形成同源二聚体,并穿越核膜识别DNA上的特定靶序列,启动特异的基因转录,从而增加IFN-γ的产生[7]。
Zervou等发现rs7574865突变等位基因T,一个之前曾报道与许多自身免疫性疾病有关的等位基因,在银屑病患者中要比在对照中更普遍,因此推论rs7574865多态性与希腊银屑病的发生有关[8]。Ji JD等进行的 meta分析说明rs7574865与类风湿性关节炎和系统性红斑狼疮显著关联[9]。另外许多研究已报道STAT4是与类风湿性关节炎、系统性红斑狼疮及Ⅰ型糖尿病关联的易感基因[10~13]。
为探讨STAT4这4个SNPs与吉林人群AS发生的关系,我们采用病例 -对照设计,应用 PCR-HRM技术检测rs7574865、rs8179673和 rs7582694,用 PCR -RFLP技术检测了rs10181656多态性在吉林AS病例组与正常对照组之间的分布情况。在本研究中,我们对病例组和正常对照组的基因型频率进行了Hardy-Weinberg平衡检验(P>0.05),表明我们所选择的群体具有很好的代表性。我们用基因片段测序技术对PCR-HRM和PCR-RFLP技术进行验证和质量控制,准确率100%,基因分型结果稳定可靠。
本研究结果显示,rs7574865、rs8179673、rs7582694和rs10181656位点的各种基因型频率及各等位基因频率在吉林AS病例组与正常对照组之间的分布均无显著性差异(P>0.05)。本研究结果表明 rs7574865、rs8179673、rs7582694和rs10181656可能与吉林人群AS的发生无关联。但经多位点单倍型频率分布分析后发现,rs8179673和rs10181656位点组成的单倍型TG在病例和对照中分布具有显著性差异(P=0.045;OR=3.126,95%CI:0.973 -10.044)。因此,我们可以推断在rs8179673和rs10181656之间的连锁区域内或其周围序列中可能存在与AS真正关联的变异。
限于本研究所涉及的样本数量有限,本次研究未发现STAT4基因与吉林人群AS发生之间的关联性,但本研究结果尚不能确定STAT4基因与吉林人群AS发生之间的确切关系。
对于STAT4基因与吉林人群AS发生相关性的最终结论,还需在其他群体及更大样本中进一步探索,以便为AS的病因学研究、诊断及治疗提供理论依据。
附图

图1 HRM分析rs7582694,灰色为GC型,红色为GG型,为CC型
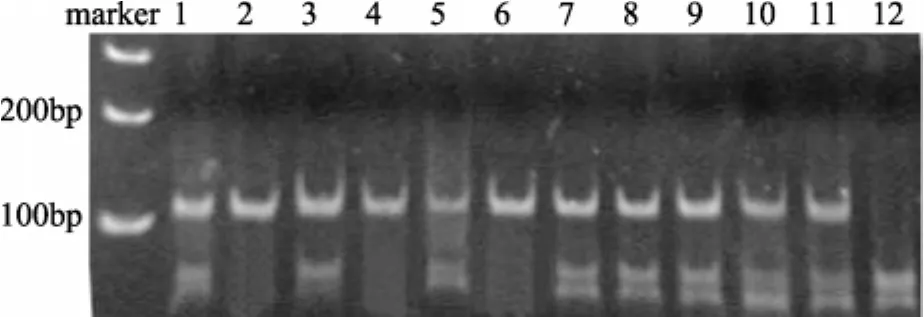
图2 rs10181656 位点 PCR 产物酶切电泳图,1、3、5、7、8、9、10、11为 GC 型(101bp、66bp和35bp),12为 GG 型(66bp和35bp),2、4、6为 CC 型(101bp)
1 Laval S H,Timms A,Edwards S,Bradbury L,Brophy S,Milicic A,Rubin L,Siminovitch K A,Week D E,Calin A,Wordsworth B P,Brown M A.Whole-genome screening in ankylosing spondylitis:evidence of non-MHC genetic-susceptibility loci[J].Am J Hum Genet,2001,68(4):918-926.
2 Finnegan A,Grusby MJ,Kaplan CD,et al.IL -4 and IL -12 regulate proteoglycan-induced arthritis through Stat-dependent mechanisms[J].J Immunol,2002,169(6):3345 -3352.
3 Yang Z,Chen M,Ellett JD,et al.Autoimmune diabetes is blocked in Stat4-deficient mice[J].J Autoimmun,2004,22(3):191 -200.
4 Goie The H S,Steven M M,van der Linden S M,Cats A,Evaluation of diagnostic criteria for ankylosing spondylitis:A comparison of the rome,new york and modified new york criteria in patients with a positive clinical history screening test for ankylosing spondylitis[J].Br J Rheumatol,1985,24(3):242 -249
5 Nguyen KB,Wafford WT,Salomon R,et al.Critical role for STAT4 activation by typeⅠinterferons in the interferon-gamma response to viral infection[J].Science,2002,297(5589):2063 -2066.
6 Watford WT,Hissong BD,Bream JH,et al.Signaling by IL -12 and IL- 23 and the immunoregulatory roles of STAT4[J].Immunol Rev,2004,202(2):139 -156.
7 Wafford WT,Morignehi M,Morinobu A,et al.The biology of IL -12:coordinating innate and adaptive immune responses[J].Cytokine &Growth Factor Rev,2003,14(5):316 -368.
8 Zervou MI,Goulielmos GN,Castro-Giner F et al.STAT4 gene polymorphism is associated with psoriasis in the genetically homogeneous population of Crete,Greece[J].Hum Immunol.70(9):738 -741.
9 Ji JD,Lee WJ,Kong KA et al.Association of STAT4 polymorphism with rheumatoid arthritis and systemic lupus erythematosus:a meta-analysis[J].Mol Biol Rep.2010,37(1):141 -7.
10 Liang YL,Wu H,Li PQ et al.Signal transducer and activator of transcription 4 gene polymorphisms associated with rheumatoid arthritis in Northwestern Chinese Han population[J].Life Sci,2011,1,89(5 -6):171-5.
11 SU Yin,ZHAO Yi,LIU Xu 等.Variation in STAT4 is associated with systemic lupus erythematosus in Chinese Northern Han population[J].中华医学杂志(英文版),2010,123(22):3173 -3177.
12 李萍,栾海霞,胡朝军等.IRF7/KIAA154和STAT4基因多态性与中国汉族人群系统性红斑狼疮的相关性[J].中华检验医学杂志,2010,33(7):611 -617.
13 Zervou MI,Mamoulakis D,Panierakis C et al.STAT4:a risk factor for type1 diabetes?[J]Human Immunology,2008,69(10):647 -650.
