COX-2抑制剂对PC-3细胞的放射增敏作用研究
2011-09-14宋轶鹏臧茹琨马金波
宋轶鹏 臧茹琨 马金波
胰腺癌是一种常见的消化道肿瘤,因其解剖位置的特殊性,目前放疗效果尚不尽人意。放射增敏剂作为提高放疗效果的一个重要途径,业已成为研究热点。新近发现诱导型环氧合酶-2(Cyclooxygenase-2,COX-2)抑制剂在体内外都有放射增敏作用[1,2],然其确切增敏机制尚未明确。本研究探讨COX-2抑制剂NS-398对胰腺癌细胞系PC-3的放射敏感性影响,并初步研究其可能增敏机制。
1.材料与方法
1.1 材料 RPMI1640培养基、胰蛋白酶购自美国GIBCO公司;小牛血清为杭州四季青产品;MTT、DMSO、NS-398均为Sigma产品;NS-398溶于DMSO中,现配现用。Trizol为Invitrogen公司产品;RevertAid first strand cDNA Synthesis试剂盒为MBI产品;PCR试剂盒购自大连宝生物公司;引物为上海伯亚公司合成;FITC标记的鼠抗人COX-2单克隆抗体以及用于免疫阴性对照的IgG-FITC均为美国Pharmingen产品;胰腺癌细胞株PC-3为齐鲁医院肿瘤防治中心保存。
1.2 细胞培养 PC-3为贴壁细胞,将细胞接种于含双抗的10%小牛血清RPMI1640培养基中,37℃,5%CO2,饱和湿度培养箱中培养。实验选取对数生长期细胞。
1.3 FCM检测COX-2蛋白表达 收集未处理细胞,用异硫氰酸荧光素(FITC)标记的鼠抗人COX-2单克隆抗体标记细胞后上机检测,以标记阳性细胞百分率表示表达水平。
1.4 MTT实验检测药物毒性及适宜浓度 将细胞以105/孔接种96孔板,24小时后开始药物实验,NS-398设0,10,50,100μmol/L 4 个浓度组,每个浓度组各取 12,24,48,72小时四个时间点检测,设不接种细胞的空白对照和只含1‰DMSO的对照,每浓度每时间点重复4孔。采用MTT法在酶联免疫检测仪上测定570nm处吸光度值(A),细胞存活率(%)=实验孔A值/对照孔A值×100%。
1.5 MTT实验分析放射增敏效应 制备单细胞悬液,根据不同照射剂量接种适量细胞于75mm2培养皿中,实验分两组:①单照组;②联合组:照射+NS-398处理。细胞接种24小时贴壁,联合组更换含10μmol/L的NS-398培养液,两组继续培养24小时,室温下分别接受0,2,4,6Gy的6MV X-ray照射,照射后联合组更换无药培养液与单照组一起继续培养48小时。采用MTT法在酶联免疫检测仪上测定570nm处吸光度值(A),求细胞存活率及IC50值(50%细胞杀伤所需放射剂量)。
1.6 FCM分析细胞周期 实验细胞分四组:未处理组、单照组(2Gy)、单药组(10μmol/L NS-398)及联合组(2Gy+10μmol/L NS-398)。各组离心收集20,000个细胞,PBS洗2次,加入预冷的70%的乙醇4℃固定过夜,离心弃乙醇,PBS洗1次,RNaseA(50μg/ml)37℃消化45分钟,碘化丙啶4℃避光染色30分钟,100目筛网过滤,上机检测。
1.7 RT-PCR检测P21 mRNA表达 实验细胞同上分四组,按Trizol(Invitrogen公司)试剂说明书提取细胞总RNA。逆转录反应体系为 20μl,总 RNA 1μg,随机六聚体引物 1μl,反转录酶1μl,具体步骤参照RevertAid first strand cDNA Synthesis Kit(MBI公司)说明书进行。PCR扩增时,将目的基因(bax/bcl-2)与管家基因(β-Actin)同管扩增。PCR反应体系为50μl,取2μl逆转录反应产物作为模板,反应条件为:94℃,2分钟预变性后,94℃ 45sec,55℃ 1分钟,72℃ 1分钟,30个循环后,72oC延伸10分钟,终止反应。取扩增产物琼脂糖凝胶电泳,扫描存盘,凝胶图像分析仪测定电泳条带的灰度,将目的基因与管家基因阳性条带的灰度比值作为目的基因表达水平的参数。引物序列:
P21F:5'ATGTCAGAACCGGCTGGGGA3';R:5'GCCGTTTTCGACCCTGAGAG3'
β-actin F:5'CGCTGCGCTGGTCGTCGACA3';R:5'GTCACGCACGATTTCCCGCT3'
2.结果
2.1 COX-2在PC-3细胞内的表达 FCM检测结果显示PC-3细胞COX-2表达的荧光强度为101.49,阳性细胞百分数为81.3%,提示PC-3细胞COX-2表达阳性,存在COX-2抑制剂作用的靶(图1)。

图1 流式细胞术检测PC-3细胞COX-2表达
2.2 NS-398对PC-3细胞增殖的影响 MTT实验结果显示:10uM的NS-398即可影响PC-3细胞的活性,药物的增殖抑制作用于加药后12小时即可显现,且随NS-398浓度的增加和作用时间的延长而增强,存在明显的时效和量效关系(图2)。
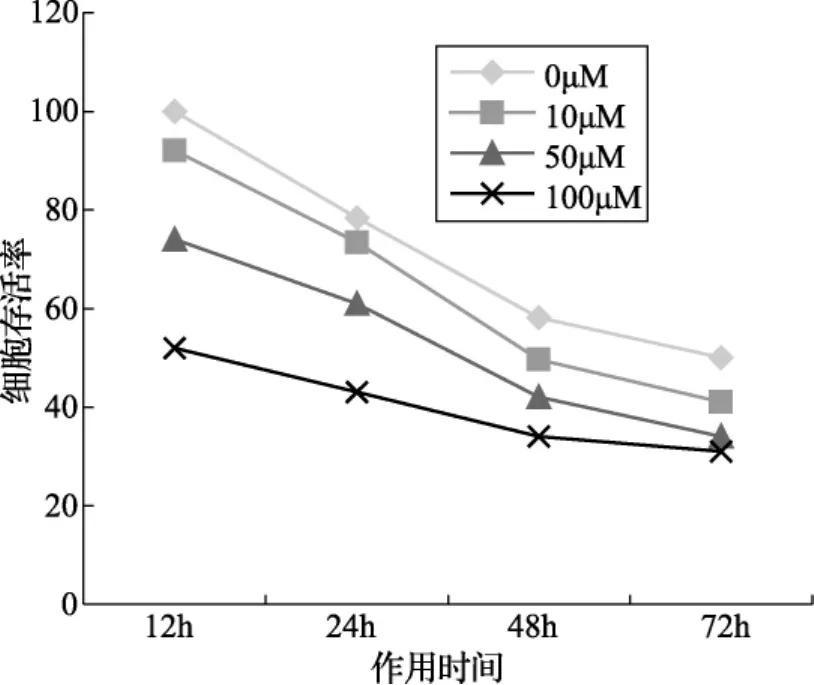
图2 NS-398对PC-3细胞增殖的影响
2.3 NS-398对PC-3细胞放射敏感性的影响 MTT实验结果显示:随着照射剂量的增加,PC-3细胞的存活率明显降低,联合组尤为显著。当照射剂量为2GY时,细胞存活率率由单照组的78.45%±3.46%下降到联合组的57.42%±2.58%(P<0.05);剂量生存曲线明显左移,IC50值从单照组的6.0GY下降到联合组的2.9GY,增敏值为2.07(图3)。

图3 NS-398联合放射对PC-3细胞增殖的影响
2.4 NS-398诱导细胞周期改变 FCM显示各组细胞周期分布如表1。单处理组(单药组和单照组)较未处理组G0-G1期比率明显上调(P<0.05)。联合组较单处理组比率进一步上调(P<0.05)。

表1 NS-398诱导PC-3细胞周期改变
2.5 细胞周期相关蛋白P21 mRNA表达 四组细胞P21 mRNA表达结果显示:对照组、单药组、单照组、联合组P21 mRNA/β -actin mRNA 灰度值分别为 0.19,0.48,0.37,0.71。其灰度值单处理组显著高于未处理组(P<0.05),联合组显著高于单处理组(P<0.05),即NS-398和放射均可引起P21mRNA表达上调,两者联合表达进一步上调。
3.讨论
环氧合酶-2(cyclooxygenase-2,COX-2)是近年来国内外研究的热点。已有研究显示COX-2在许多肿瘤中高表达,推测与肿瘤的发生、发展、转移密切相关。抑制COX-2的表达和(或)对抗COX-2的活性可以阻滞COX-2的促癌作用[3,4],提示COX-2可能成为肿瘤诊治的一个新靶点。
业已证实COX-2抑制剂具有抑制肿瘤生长的作用,分析其机制为抑制肿瘤血管生成、诱导癌细胞凋亡等[5]。研究还发现COX-2抑制剂能增强肿瘤的放射敏感性[6],其具体增敏机制目前尚无定论,可能与下调COX-2表达,从而降低细胞内 PGE2 水平[7];抑制细胞增殖和促进凋亡[2,8];诱导细胞周期的阻滞[9];抑制放射引起DNA 损伤的修复[10];抑制肿瘤血管生成[11,12]等相关。本研究发现COX-2选择性抑制剂NS-398能显著增强胰腺癌细胞株PC-3的放射敏感性。
本研究应用流式细胞术(FCM)单抗标记技术检测胰腺癌细胞株PC-3的COX-2表达水平,证实存在COX-2的异常高表达,与文献报道一致[13]。基于此,研究了COX-2抑制剂NS-398对PC-3细胞的增殖抑制作用及放射增敏作用,结果发现,(10~100)μmol/L浓度的NS-398对PC-3细胞均有增殖抑制作用,且呈时间与剂量依赖性;NS-398联合放射组的细胞生存率较单照组明显降低,即NS-398对PC-3细胞具有明显的放射增敏作用,这与徐刚等[13]的报道结果一致。
本研究发现,NS-398和放射均可诱导G0-G1期比率上调,两者联合起协同作用,表明NS-398和放射均可诱导PC-3细胞周期的改变,引起部分细胞阻滞于G0-G1期。由此推测,NS-398对PC-3细胞的放射增敏效应可能与改变细胞周期分布相关。Ma等[1]亦报道COX-2抑制剂塞来昔布对CD133(+)胶质瘤细胞的放射增敏效应可能与其改变细胞周期分布相关。Bijnsdorp等[14]报道,COX-2抑制剂美洛昔康亦可改变脑胶质瘤细胞株D384细胞周期分布,同时具有放射增敏作用,然而两者可能无必然相关性,认为放射增敏主要与美洛昔康直接导致细胞死亡相关。而Ohneseit等[15]则报道,COX-2抑制剂塞来昔布单独和联合放射均不改变前列腺癌细胞株PC-3的细胞周期分布,也不具放射增敏作用。Palayoor等[16]通过siRNA干扰技术沉默前列腺癌PC-3细胞COX-2基因,发现COX-2基因的沉默并不改变细胞周期的分布,推测PC-3细胞的放射敏感性可能并不依赖于COX-2的表达状态,即COX-2抑制剂可能无法通过COX-2依赖途径增加PC-3细胞的放射敏感性。可见COX-2抑制剂的放射增敏机制及与细胞周期分布的相关性十分复杂,可能与是否COX-2依赖相关,当然存在其他复杂因素,相关研究有待进一步进行。
P21是细胞周期蛋白依赖性激酶抑制因子(CDKIs),是细胞周期调控的物质基础之一。P21可与cyclin-CDK复合物结合,抑制其cyclinD1-CDK4和cyclinE-CDK2的活性,使Rb蛋白不能发生磷酸化,从而使细胞周期停滞在G1期。放射诱导DNA损伤后能转录性地激活P53基因的表达,进而激活其下游靶基因P21的表达。陈志刚等[17]已报道放疗可引起脑胶质瘤细胞U87MG P21蛋白表达的增加。陈其奎等[18]已报道NS-398诱导细胞周期相关蛋白P21转录和表达的升高,并诱导部分细胞阻滞在G0-G1期。本研究应用RTPCR检测P21mRNA表达水平,发现NS-398和放射均可诱导P21mRNA表达,两者具协同作用。
综上所述,本研究结果提示NS-398能增加胰腺癌细胞株PC-3对放射的敏感性,其增敏机制可能与上调P21mRNA表达,进而诱导细胞周期阻滞于G0-G1期相关,更深入的研究有待进一步进行。
1 Ma HI,Chiou SH,Hueng DY,et al.Celecoxib and radioresistant glioblastoma-derived CD133+ cells:improvement in radiotherapeutic effects.Laboratory investigation[J].Journal of neurosurgery,2011,114(3):651-662.
2 Klenke FM,et al.Enhanced Radiation Response by Celecoxib in Secondary Bone Tumors[J].Strahlentherapie and Onkologie,2011,187(1):45-51.
3 Howe LR,Dannenberg AJ.A role for cyclooxygenase-2 inhibitors in the prevention and treatment of cancer[J].Semin Oncol,2002,29(3 Suppl 11):111-119.
4 Schrage,YM,Machado I,Meijer D.COX-2 expression in chondrosarcoma:a role for celecoxib treatment[J].European journal of cancer,2010,46(3):616-624.
5 Leung WK,To KF,Go MY,et al.Cyclooxygenase-2 upregulates vascular endothelial growth factor expression and angiogenesis in human gastric carcinoma[J].Int J Oncol,2003,23(5):1317-1322.
6 Grimes KR,Warren GW,Fang F,et al.Cyclooxygenase-2 inhibitor,nimesulide,improves radiation treatment against non-small cell lung cancer both in vitro and in vivo[J].Oncol Rep,2006,16(4):771-776.
7 Amirghahari N,Harrison L,Smith M,et al.NS-398 radiosensitizes an HNSCC cell line by possibly inhibiting radiation-induced expression of COX-2[J].Int J Radiat Oncol Biol Phys,2003,57(5):1405-1412.
8 Park JS,Jun HJ,Cho MJ,et al.Radiosensitivity enhancement by combined treatment of celecoxib and gefitinib on human lung cancer cells[J].Clin Cancer Res,2006,12(16):4989-4999.
9 Shin YK,Park JS,Kim HS,et al.Radiosensitivity enhancement by celecoxib,a cyclooxygenase(COX)-2 selective inhibitor,via COX-2-dependent cell cycle regulation on human cancer cells expressing differential COX-2 levels [J].Cancer Res,2005,65(20):9501-9509.
10 Raju U,Ariga H,Dittmann K,et al.Inhibition of DNA repair as a mechanism of enhanced radioresponse of head and neck carcinoma cells by a selective cyclooxygenase-2 inhibitor,celecoxib[J].Int J Radiat Oncol Biol Phys,2005,63(2):520-528.
11 Kang KB,Wang TT,Woon CT,et al.Enhancement of glioblastoma radioresponse by a selective COX-2 inhibitor celecoxib:inhibition of tumor angiogenesis with extensive tumor necrosis[J].Int J Radiat Oncol Biol Phys,2007,67(3):888-896.
12 Kim BM,Won Juyoon,Maeng KA,et al.Nimesulide,a selective COX-2 inhibitor,acts synergistically with ionizing radiation against A549 human lung cancer cells through the activation of caspase-8 and caspase-3[J].International journal of oncology,2009,34(5):1467-1473.
13 徐刚,王兴鹏,赵国旗,等.塞来昔布对胰腺癌的放疗增敏作用及其机制研究[J].中华消化杂志,2006,26(11):753-757.
14 Bijnsdorp IV,Berg Jd,Kuipers GK,et al.Radiosensitizing potential of the selective cyclooygenase-2(COX-2)inhibitor meloxicam on human glioma cells[J].J Neurooncol,2007,85:25 – 31.
15 Ohneseit PA,Krebiehl G,Dittmann K,et al.Inhibition of cyclooxygenase-2 activity by celecoxib does not lead to radiosensitization of human prostate cancer cells in vitro[J].Radiotherapy and Oncology,2007,82:229-238.
16 Palayoor ST,Arayankalayil MJ,Shoaibi A,et al.Radiation Sensitivity of Human Carcinoma Cells Transfected with Small Interfering RNATargeted against Cyclooxygenase-2[J].Clin Cancer Res,2005,11(19):6980-6986.
17 陈志刚,卢亦成,Broaddus WC,等.放疗后脑恶性胶质瘤细胞内p53和 p21 蛋白的表达[J].Chin Int J Med,2003,3(2):110-113.
18 陈其奎,韩际奥,陈锦武,等.NS398对胰腺癌细胞周期及其蛋白依赖性激酶抑制物p21Wafl/cipl、p27Kipl/pic2的影响[J].中国临床药理学与治疗学,2007,12(1):38-42.
