甲胎蛋白表达缺失的人肝癌HepG2细胞株的构建*
2011-08-31杨大国吴其恺刘成海陶艳艳
冉 云 邓 欣 杨大国 吴其恺 刘成海 陶艳艳 聂 广
1.湖北中医药大学2010级博士班 (湖北 武汉,430065) 2.深圳市第三人民医院 3.上海中医药大学肝病研究所
人肝癌HepG2细胞株能够稳定高表达甲胎蛋白(AFP)[1],AFP作为肿瘤标志物,在肝癌的发生发展中发挥重要作用。为进一步探讨AFP的作用机制,我们采用RNAi技术构建不表达或少表达AFP的HepG2模型细胞株。现报道如下。
1 材料与方法
1.1 材料 SiRNA由英俊公司合成,pll 3.7载体由上海比昂生物医药科技有限公司提供,Agarose Gel DNA Purification Kit Ver2.0(TaKaRa)购自大连宝生物公司,293T细胞株购自中科院上海细胞所,DMEM、胎牛血清、胰蛋白酶、限制性内切酶均购自Invitrogen公司,T4 DNA连接酶购自NEB公司,质粒DNA提取试剂盒购自Axygen公司,凝胶回收试剂盒购自Qiagen公司,ladder购自Fermentas,PCR引物由大连宝生物公司设计合成,AFP一抗购自CST公司。
1.2 方法
1.2.1 RNA干扰靶点的选择 靶点序列通过https://rnaidesigner.invitrogen.com/rnaiexpress/网站软件设计,由英俊公司合成。模板中的loop结构选用了TTCAAGAGA以避免形成终止信号。正义链模板的5'端添加T,与BbsI酶切后形成的粘端互补;反义链模板的5'端添加AGCT,与XhoI酶切后形成的粘端互补。正义链:5'-T-(GN18)-(TTCAAGAGA)-(N18C)-TTTTTTC-3',反义链:3'-A(CN18)-(AAGTTCTCT)-(N18G)-AAAAAAGAGCT-5'。按此规则选择干扰靶 点 为:AFP-639:5'TGGTCTATCTCCAAATCTAAACTTCAAGAGTTTAGATTTGGAGATAACCTT TTTTC3';3'ACCAGATAGAAATTTGAAGTTCTCTCAAATCTAAACCTCTATCTGG AAAAAAGAGCT5'。
1.2.2 质粒的构建 取oligo溶液5ul,在PCR仪上处理后得到浓度为10 μM的 shRNA模板,将所得模板溶液稀释为200nM,用于连接反应。取 pPll3.7载体 10ug,10×Buffer R10ul,XhoI酶 5ul,Hpa I酶 2ul,加双蒸水至 100ul体系,37℃酶切1小时,琼脂糖电泳,使用Agarose Gel DNA Purification Kit Ver 2.0(TaKaRa) 回收。按 10×T4 Ligation Buffer 2ul,pll 3.7(XhoI+Hpa I),shDNA template(100nM),T4 DNA ligase各1ul,加水至20ul,22℃反应1小时后转染JM 109 competent cells进行连接反应,每个连接反应挑取5个菌落,接种到含50 ug/ml Ampicillin的LB培养集中,使用碱裂解法抽提质粒,所得质粒分别用Xba I和Nhe I进行双酶切鉴定,并进行测序鉴定。
1.2.3 病毒载体的包装与纯化 制备慢病毒包装系统中4种质粒DNA溶液,当293 T细胞密度达60%~70%时将DNA和磷酸钙混合液转移至含单层细胞的培养液中混匀,培养12小时后弃去培养液,加PBS 15 ml轻摇后弃去,重复该步骤3次,加入含100 ml/L小牛血清的细胞培养液15ml,继续培养72小时,收集细胞上清液,将上清液4℃、4000g离心10分钟,收集上清液并以0.45 μm滤器过滤后,4℃、25000 r/min离心20分钟,弃上清液,用500ul PBS重悬病毒沉淀于4℃保存过夜。
1.2.4 HepG2细胞病毒转染 六孔板接种细胞,感染实验分为空白对照组、阳性质控组、模型细胞组 (AFP-639),细胞换液,吸弃培养基,分别添加1.0ml含2%FBS、不含抗生素的DMEM培养液;同时加入病毒粗提液500ul,24小时后弃上清液,换含10%FBS的DMEM培养液,倒置显微镜及荧光显微镜下观察细胞,拍片。继续培养96小时后,收集细胞,抽提RNA和蛋白。RT-PCR及Western blot检测转染后HepG2细胞 (模型细胞)内AFP基因及蛋白的表达情况。
1.3 统计学方法 采用SPSS 12.0软件进行统计分析,计量资料以(±s)表示,组间比较采用t检验。
2 结果
2.1 质粒用Xba I和Nhe I进行双酶切鉴定结果 见图1。

图1 质粒用XbaI和NheI双酶切鉴定结果
2.2 测序鉴定结果 见图2。

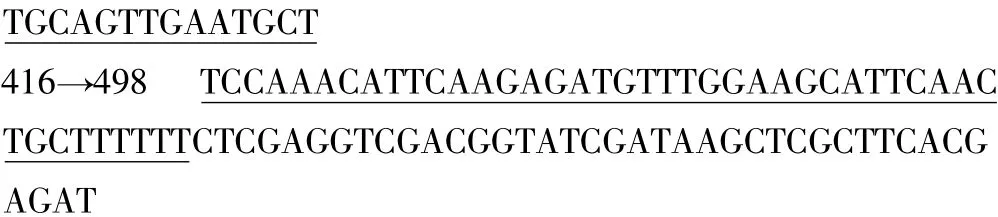
图2 测序鉴定结果
2.3 转染后大量HepG2细胞呈现绿色荧光 见图3。

图3 转染后镜下所见HepG2细胞
2.4 RT-PCR检测转染后HepG2细胞内AFP基因表达情况
见图4。如图,与正常组NI组 (野生型HepG2细胞)比较,干扰后模型细胞AFP基因的表达显著减少,显著抑制了AFP基因表达。
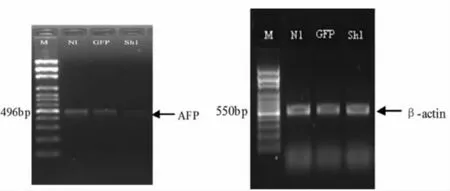
图4 RT-RCP检测转染后HepG2细胞内AFP基因表达
2.5 实时荧光定量PCR检测模型细胞及其传代后细胞内AFP基因表达 结果见表1。
表1 模型细胞AFP基因表达结果比较(±s)

表1 模型细胞AFP基因表达结果比较(±s)
与野生HepG2组比较,*P<0.01,与M1组比较,#P>0.05
组别 AFP/β-actin野生HepG2组1±0 M1(细胞传1代) 0.157±0.025*M5(细胞传5 代) 0.167 ±0.015*#
2.6 Western blot检测模型细胞及其传代后细胞内AFP蛋白表达结果 见表2、图5。
表2 模型细胞内AFP蛋白表达结果比较(±s)

表2 模型细胞内AFP蛋白表达结果比较(±s)
与野生HepG2组比较,*P<0.01,与M1组比较,#P>0.05
组别AFP/GAPDH野生HepG2组1.38 ±0.025 M1(细胞传1 代) 0.24 ±0.119*M5(细胞传5 代) 0.22 ±0.023*#

图5 传代后细胞内AFP表达结果
3 讨论
RNAi是由作用于同源序列mRNA的双链RNA所介导的序列特异性、转录后基因沉默机制[2];具有费用低廉、抑制效率高、容易筛选靶序列等特点,克服了以往反义核酸技术代价高昂、靶序列筛选困难等缺点[3]。siRNA表达载体有质粒表达载体和病毒表达载体两种,目前普遍认为腺病毒载体是一种高效的体内转染载体[4]。当前在国内有一些关于靶向AFP基因干扰的相关报道,或是构建干扰质粒[5],或是观察RNA干扰对肝癌细胞的影响[6],但到目前为止还没有关于靶向AFP基因干扰构建不表达或少表达AFP的人肝癌HepG2细胞株的报道。在本研究中,我们通过软件设计了4个靶序列,腺病毒少量包装转染后检测AFP基因及蛋白的表达,靶点“639”干扰效率最高,故选此干扰靶点构建细胞模型。此细胞模型传代后仍能稳定地沉默AFP表达,为进一步对AFP进行机制研究和药理研究奠定了基础。
[1]BOIS-JOYEUX B,THOMASSIN H,RICHARD F,et al.Several transcription factors participate in the functioning of the alpha-fetoprotein gene promoter[J].Bull Cancer,1995,82(7):541-550.
[2]AGRAWAL N,DASARADHI P V,MOHMMED A,et al.RNA interference:biology,mechanism,and applications[J].Microbiol Mol Biol Rev,2003,67(4):657-85.
[3]HARBORTH J,ELBASHIR SM,VANDENBURGH K,et al.Sequence,chemical,and structural variati-on of small interfering RNAs and short hairpin RNAs and the effect on mammalian gene silencing[J].Antisense Nucleic Acid Drug Dev,2003,13(2):83-105.
[4]VORBURGER SA,HUNT KK.Adenoviral gene therapy[J].Oncologist,2002,7(1):46-59.
[5]亓同钢,汪运山,王芳,等.AFP基因SiRNA表达质粒的构建及鉴定[J].山东大学学报(医学版),2004,42(3):353-354,358.
[6]张国英,杨慧,刘明社,等.RNA干扰抑制HepG2细胞AFP基因表达实验方法建立[J].长治医学院学报,2006,20(4):241-243.
