高糖对小鼠足细胞黏附功能的影响及黄芪多糖的干预作用*
2011-08-27李佑生王文健何燕铭陈伟华
李佑生 黎 帅 王文健 刘 毅 何燕铭 陈伟华 应 健
1暨南大学第二临床医学院深圳市人民医院(广东深圳 518020)
2复旦大学华山医院复旦大学中西医结合研究所(上海 200040)
3上海中医药大学附属岳阳中西医结合医院(上海 200437)
高糖对小鼠足细胞黏附功能的影响及黄芪多糖的干预作用*
李佑生1黎 帅1王文健2刘 毅2何燕铭3陈伟华2应 健2
1暨南大学第二临床医学院深圳市人民医院(广东深圳 518020)
2复旦大学华山医院复旦大学中西医结合研究所(上海 200040)
3上海中医药大学附属岳阳中西医结合医院(上海 200437)
目的 观察高糖对体外培养足细胞的黏附功能及黏附分子的影响,以及中药组分黄芪多糖改善这种损伤的效果。方法采用永生化小鼠足细胞株,通过温度选择的培养方法诱导足细胞分化,分为正常糖对照组(NG)(5mmol/L)、甘露醇高渗对照组(MA)、高糖组(HG) (30μmol/L)、高糖+黄芪多糖组(APS)(0.2g/L),干预3、6、12、24h后收集细胞,分别用荧光定量法和物理离心法检测足细胞黏附功能;干预6、12h后,应用实时定量PCR法及Western印迹法分别检测足细胞α3、β1整合素mRNA和蛋白表达水平。结果作用6、12h后,HG组α3、β1整合素mRNA及蛋白表达水平较NG组下降,差异有统计学意义,而给予黄芪多糖后,其下降不明显。结论高糖可明显抑制足细胞的黏附功能,黄芪多糖对高糖诱导的足细胞损伤有改善作用。
足细胞 黏附功能 α3、β1整合素 黄芪多糖
糖尿病肾病足细胞的损害主要表现为肾小球足细胞数量减少,足细胞从基底膜上脱落,残留足细胞为覆盖面积增大的基底膜而代偿性肥大、足突增宽,进而使肾小球滤过屏障通透性增加,导致蛋白尿发生,并最终形成肾小球硬化、肾功能进行性丧失[1]。足细胞从肾小球基底脱失的一个重要因素,是足细胞的黏附功能异常,足细胞不能在基膜上“锚定”。α3、β1整合素对这种“锚定”起着重要作用。本研究观察黄芪多糖改善高糖(HG)刺激下足细胞与GBM之间的黏附功能及其对α3、β1整合素表达的影响,以探讨其改善糖尿病肾病蛋白尿的机制。
1 材料与方法
1.1 试药 永生的小鼠足细胞(系来源于成年H-2Kb-tsA58转基因小鼠,该细胞含有一个温度敏感的SV40-T抗原基因,可由γ-干扰素诱导的H-2Kb启动子调控,在33℃并有γ-干扰素诱导条件下,足细胞将处于未分化状态,以保持其永生性)由英国Luigi Gnudi教授惠赠。RPMI-1640培养液、FBS均购自美国Gibco公司;Mouse γ-INF,Ⅰ型胶原,多聚赖氨酸购自美国Sigma公司;Trizol试剂购自美国Invitrogen公司;α3整合素抗体购自美国Upstate公司;β1整合素抗体购自美国Chemicon公司;β-actin抗体及HRP标记的二抗均购自美国Santa Cruz公司;细胞黏附荧光定量试剂盒购自美国Calbiochem公司。黄芪多糖(98%):复旦大学中西医结合研究所。丹酚酸B(75%):上海基中药业。
1.2 仪器 细胞CO2培养箱(德国HERAEUS公司),OLYMPUS荧光倒置相差显微镜,酶联免疫仪(酶标仪),0.22μm微滤器。
1.3 足细胞的培养[2]足细胞生长于含10%胎牛血清(Gibco)、100U/mL青链霉素的 RPMI1640培养液中(Gibco),在 5%CO2、37℃培养箱孵育。培养瓶预先经0.1mg/mL collagen I 37℃处理1h。细胞培养在33℃CO2培养箱中处于增殖状态,培养液中加入50U/mL γ-INF预先瓶ING以促进其增殖,每传两代γ-INF减为20U/mL,最后以10U/mL维持。待细胞生长至20%~30%融合时,转入37℃ 培养箱,无需加入γ-INF,细胞处于37℃状态1周为正在分化的足细胞,10~20d为已分化足细胞。
1.4 分组[2]取分化成熟的足细胞,接种于96孔板中,每孔接种细胞1×104个细胞,以10%胎牛血清的RPMI1640培养液培养,体积200μL,按分组分别加入不同浓度D-葡萄糖、甘露醇、丹酚酸或黄芪多糖。(1)正常糖(NG)对照组:D-葡萄糖 5mmol/L;(2)甘露醇高渗 (MA)对照组:甘露醇25 mmol/L+D-葡萄糖5mmol/L;(3)HG 组:D-葡萄糖 30mmol/L;(4) 高糖+黄芪多糖(APS)组:D-葡萄糖30mmol/L和黄芪多糖(终质量浓度分别为0.2g/L);分别作用 3、6、12、24h。 其中 6h 与 12h 两个时间点收细胞测α3、β1整合素mRNA表达与蛋白表达水平。每组细胞设4个复孔,每个实验组重复3次,计算统计量。
1.5 足细胞黏附功能测定 (1)采用细胞黏附荧光定量试剂盒检测足细胞与BMC之间的黏附功能[3]。铺有BMC及小牛血清(BSA)和多聚赖氨酸分别作为阴性对照和阳性对照的96孔板,将足细胞予无FBS的RPMI-1640培养液悬浮,密度为1×105~5×105个/mL,种植于96孔板中,每孔加入100μL上述细胞悬液,置于37℃、5%CO2细胞培养箱中并按上述实验分组进行干预后,弃去培养液,每孔加入200μL PBS,冲洗2次,然后每孔加入 100μL;荧光 Calcein-AM 工作液,在 37℃、5%CO2细胞培养箱中孵育1h,将96孔板放至激发波长485nm、发射波长520nm的荧光读板仪上检测相对荧光强度(RFU)。(2)采用离心方法测定足细胞与BMC之间的黏附能力[4]。将铺有BMC的96孔板上已分化的足细胞,置于37℃、5%CO2细胞培养箱中并按上述实验分组进行干预后,用PBS洗并移去漂浮细胞,然后在显微镜下计算每孔细胞的数目,每个实验组设立3个复孔,取平均值作为离心前的细胞数,后将96孔板置于离心机中,1500g(GH 6.8rotor)离心10 min,使足细胞从BMC上脱落,在相同条件下计算每孔细胞的数目,以离心后的细胞数与离心前的细胞数比例反映足细胞黏附能力。
1.6 α3、β1整合素mRNA的表达水平测定 (1)提取总RNA:根据Trizol试剂说明书提取细胞总RNA。(2)逆转录cDNA:每个样本取4μg总RNA,采用随机引物MMLV反转录酶在50μL体系内进行反转录,用Applied Biosystems PCR仪按70℃,3min;37℃,60min;95℃,5min 反应条件循环 1 次得到 cDNA。(3)实时定量:β1整合素引物序列为上游5′-GTTCCATGCGTAGCGACAA3′,下游 5′-TTCTCCCTGCTTTCCACTTTAG3′,扩增片段大小为 245bp;α3整合素引物序列上游 5′-CCCTCGCTTTGTAGGTTA 3′, 下游 5′-GTCCCTGTCAGCCTCCACT 3′, 扩增片段大小为 126bp;β-actin引物序列上游 5′-CCTCTATGCCAACACAGTGC-3′, 下 游 5′-GTACTCCTGCTTGCTGATCC3′,扩增片段大小为211bp。取1μL cDNA加入总体积为25μLPCR 反应体系中(2.5nmol/μL dNTPs2.5μL,10×Sybergreen I PCR 缓冲液 2.5μL,25mmol/LMgCl2溶液 1.5μL,10μmol/L 的上、下游引物各1μL,Taq聚合酶1U)。采用澳大利亚Corbett Research公司生产的Rotor-Gene3000 PCR仪进行实时定量PCR反应,反应条件为:94℃预变性 5min,然后 95℃变性 10s,59℃退火15s,72℃延伸20s,扩增40个循环,最后72℃延伸5min。实验结果采用荧光定量分析软件读取,计算样本mRNA/β-actin mRAN的比值,每个实验组重复3次,计算统计量。
1.7 α3、β1整合素蛋白的表达水平检测 各组处理结束后分别收集细胞,每孔加入裂解液 (50mmol/L Tris-HCl Buffer,pH8.0、0.15mmol/L氯化钠、2mmol/L二胺四乙酸、1%乙基苯基聚乙二醇-40、0.1%十二烷基硫酸钠SDS、100μmol/L苯甲基磺酰氟化物、1μg/mL 抑肽酶、1μL/mL-巯基乙醇)1mL,采用橡皮刮子刮下细胞,振摇冰浴30min,于4℃内以15000r/min离心20 min,取上清液即为细胞总蛋白,用考马斯亮兰蛋白测定试剂盒检测蛋白浓度;加上样缓冲液,以12%SDS-聚丙烯酰胺凝胶电泳分离,100V电转移至硝酸纤维素膜。采用5%脱脂牛奶室温内封闭60min,加一抗于4℃过夜,然后加辣根过氧化物酶标记的二抗室温孵育60min,洗膜,用ECL化学发光剂(美国Santa Cruz公司产品)在X光片上曝光,显影、定影、冲洗凉干后扫描蛋白条带的光密度,以β-actin为内参,采用Bio-Rad2000凝胶成像系统,应用QUANTITY ONE软件进行吸光度分析。每个实验组重复3次,计算统计量。
1.8 统计学处理 采用SPSS 13.0统计软件。计量资料以(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果

图1 HG对足细胞与BMC之间黏附能力的影响

图2 对足细胞与BMC之间黏附能力的影响
2.1 HG对足细胞与BMC之间黏附能力的影响及黄芪多糖的干预效果 图1、图2。由图1可见,运用荧光定量法检测HG组黏附至BMC上的足细胞数(以RFU反映)较NG组下降,且具有一定时间依赖性,在3h时开始下降,24h时作用最明显,差异有统计学意义(P<0.05)。而给予黄芪多糖后,其足细胞数较高糖组明显升高,差异有统计学意义(P<0.05)。由图2可见,运用物理离心法检测HG组离心后的足细胞数/离心前足细胞数的比值较NG组减少,在作用3h时,HG组离心后的足细胞数和离心前足细胞数的比值较NG组下降40%,作用24h时较NG组下降60%,差异均有统计学意义(P<0.05)。而给予黄芪多糖后,其比值较高糖组明显升高,差异有统计学意义(P<0.05)。
2.2 HG对足细胞α3、β1整合素基因表达水平的影响及黄芪多糖的干预效果 见图3。在作用6h与12h后,HG组整合素mRNA表达量均较NG组明显下降,差异均有统计学意义 (P<0.05)。而给予黄芪多糖后,其下降不明显(P>0.05)。

图3 对足细胞β1、α3整合素基因表达水平的影响
2.3 HG对足细胞α3、β1整合素蛋白表达水平的影响及黄芪多糖的干预效果 见图4、图5。由上图可见,HG组 6h、12h后β1整合素、α3整合素蛋白表达水平均较NG组下降,差异有统计学意义 (P<0.05),而给予黄芪多糖后,其下降不明显 (P>0.05)。
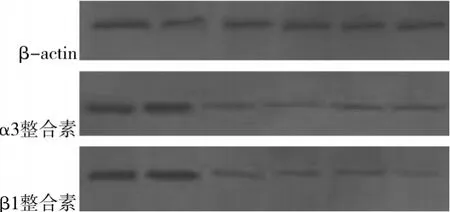
图4 足细胞α3、β1整合素蛋白表达水平

图5 对足细胞β1、α3整合素蛋白表达水平的影响
3 讨 论
现有研究表明,足细胞损害在糖尿病肾病的发生发展过程中起着重要作用。进入临床肾病的糖尿病患者存在足细胞丢失、残存足细胞体积增大、足突增宽、足细胞覆盖的肾小球基底膜(GBM)面积增大、GBM增厚、肾小球硬化及系膜膨胀等改变[2-3]。足细胞的肥大、变性,又可促使其进一步从GBM上脱落、丢失,致使硬化肾小球的GBM广泛裸露[4-5],从而促进DN的发展。
足细胞从GBM上脱落丢失有多种因素,如高灌注、机械张力牵拉、高糖高脂等,导致足细胞与GBM之间黏附功能的改变,引起足细胞损伤而脱落[5],也是糖尿病肾病早期进展的重要机制之一[6]。我们通过采用荧光标记的细胞黏附试剂盒及物理离心两种方法测定了足细胞与BMC之间的黏附能力,结果发现,在HG刺激下黏附在BMC上的足细胞数均较NG组显著下降,且随HG刺激时间的延长,其抑制作用逐渐加强,尤以作用24h时最为明显。而对照的甘露醇对足细胞黏附功能并无明显改变,表明高糖能显著抑制体外培养的足细胞黏附功能。
黄芪是治疗糖尿病肾病蛋白尿的常用中药,循证医学分析也表明,黄芪对糖尿病肾病蛋白尿有较好的改善作用。黄芪多糖作为黄芪的主要成分之一,有改善高糖诱导的足细胞凋亡的作用[7]。本研究提示,黄芪多糖还可通过改善高糖所致足细胞黏附能力的下降,达到减少足细胞脱失的作用。
现有研究表明,足细胞从肾小球基底脱失的一个重要因素,是足细胞的黏附功能异常,足细胞不能在基膜上“锚定”。α3、β1整合素对这种“锚定”起着重要作用。α3、β1作为足细胞黏附于基底膜的主要受体分子之一[7],是足细胞上唯一的β1类整合素,对足细胞与GBM的结合起着关键性作用。有研究表明[8],特异β1整合素抗体或β1整合素阻断剂均可诱导足突融合、足突与GBM分离及蛋白尿的发生;α3整合素基因敲除小鼠出生时即出现GBM发育不成熟、足突消失及大量蛋白尿。我们的研究也提示,高糖培养的足细胞,其α3、β1整合素表达水平明显降低,提示这可能是导致足细胞黏附能力下降的主要机制。而黄芪多糖共培养的足细胞,其α3、β1整合素表达水平较之有较明显的改善。说明黄多糖可通过提高α3、β1整合素表达水平,改善高糖损伤足细胞的黏附能力,从而达到防治糖尿病肾病蛋白尿的作用。
[1]Gabriella G,Paolo C P,Giovanni C.Insight on the pathogenesis of diabetic nephropathy from the study of podocyte and mesangial cell biology[J].Current Diabetic Reviews,2005,30(1):27-40.
[2]White K E,Bilous R W.Structural alterations to the podocytes are related to proteinuria in type 2 diabetic patients[J].Nephol Dial Transplant,2004,19(6) :1437-1440.
[3]Dalla Vestra M,Masiero A,Roiter A M,et al.Is podocyte injury relevant in diabetic nephropathy?Studies in patients with type 2 diabetes[J].Diabetes,2003,52(4):1031-1035.
[4]Murata I,Takemura G,Asano K,et al.Apoptotic cell loss following cell proliferation in renal glomeruli of Otsuka Long-Evans Tokushima Fatty rats,a model of human type 2 diabetes [J].Am J Nephrol,2002,22(6):587-595.
[5]Kumar D,Robertson S,Burns K D.Evidence of apoptosis in human diabetic kidney[J].Mol Cell Biochem,2004,259(7):67-70.
[6]梁燕,程丽静,黄海长.足细胞损伤与肾小球疾病[J].中国病理生理杂志,2005,21(9):1864-1866.
[7]李佑生,王文健,马宇滢,等.复方丹参滴丸防治大鼠早期糖尿病肾脏损害的研究[J].中成药,2007,29(1):40-44.
[8]李佑生,马宇滢,王文健.丹酚酸的心血管系统药理作用研究进展[J].中西医结合心脑血管病杂志,2006,4(9):791-793.
Effect of High Glucose on Adhesion Function of Mouse Podocyte and Protective Effect of Astragalus Polysaccharide
LI You-sheng1,LI Shuai1,WANG Wen-jian2,et al
1Shenzhen People's Hospital,Guangdong Province,Second Clinical Medical College of Jinan University(Shenzhen518020,Guangdong)
2Huashan Hospital of Fudan University,Combination of Chinese Traditional and Western Medicine of Fudan U-niversity(Shanghai200040)
Objective:To observed the effect of high glucose (HG) on adhesion function of mouse podocyte and the result of astragalus polysaccharide improving the damage.Methods:Immortalized mouse podocytes were induced differentiation by temperature selection culture.Cells were divided into the normal glucose,the mannitol control group,the HG group and the HG plus astragalus polysaccharide (APS) group.At 3h,6h,12h,24h,cells were detected by the adhesive function by fluorescence quantitative and physical centrifugal.At 6h and 12h of treatment,these expressions including α3,β1 integrin mRNA and protein were detected by real-time PCR and western blot.Results:After 6h and 12h of treatment,these expressions including α3,β1 integrin mRNA and protein of HG group were lower significantly than those of normal glucose group.After being used astragalus polysaccharide,the reduction was not obvious.Conclusion:HG can remarkably inhibit mouse podocyte adhesion.There is a improvement effect in the astragalus polysaccharide in the podocyte damage induced by the astragalus polysaccharide.
Podocyte;Adhesion;α3,β1 integrin;Astragalus polysaccharides
R285.5
A
1004-745X(2011)09-1430-03
广东省自然基金资助项目(8151802001000010);广东省中医药局资助项目(2007244)
2011-04-24)
