严重腹内感染致肠屏障功能障碍与免疫失衡的相关性
2011-08-22崔乃强巩传勇曾宪民
傅 强,崔乃强,杜 超,王 娜,巩传勇,翁 欣,曾宪民
腹腔内感染是外科重症监护病房(SICU)常见病,常引起严重脓毒症,进一步可发展为多脏器功能障碍综合征(multiple organ dysfuction syndrome,MODS),后者病情凶险,病死率高。在严重腹腔感染时肠道作为最早受累器官,肠黏膜屏障功能受损,通透性增加,造成细菌及内毒素移位,引起各种炎症介质与细胞因子大量释放,过度的全身炎症反应综合 征(systemic inflammation respeonse syndrome,SIRS)导致休克、组织液漏出和凝血障碍,而随后出现的全身代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS)却能导致特异性免疫抑制。促炎反应和抗炎反应最终互相激化,导致具有自身破坏性的免疫失调状态[1-2]。我们于2007年1月—2010年3月对我院SICU收治的57例患者进行了连续观察,现报告如下。
1 对象和方法
1.1 病例选择及分组 严重腹腔感染致肠屏障功能障碍成年患者57例,男28例,女29例;平均年龄(59.95±10.88)岁。其中消化道穿孔15例,急性化脓性阑尾炎7例,重症急性胰腺炎14例,急性梗阻化脓性胆管炎14例,急性不全性肠梗阻(除外恶性肿瘤导致的肠梗阻)7例。APACHE-II评分(15.21±5.68)。根据28 d预后,回顾性分为死亡组15例与存活组42例,两组患者性别无明显差异(P>0.05),年龄和APACHE-II评分有显著差异(P<0.05)。两组患者一般情况见表1。
表1 两组患者一般情况比较(±s)

表1 两组患者一般情况比较(±s)
注:与死亡组比较,aP<0.05;aaP<0.01
n分组死亡组存活组15 42年龄(岁)65.53±8.59 57.95±11.01aa性别(男/女)9/6 19/23 APACHEII评分20.20±5.17 13.43±4.75a
1.2 治疗方法 对于原发病及其引发的脓毒症的抗生素使用、液体治疗、器官功能支持及外科手术等参照欧洲危重病医学会(ESICM)、美国危重病医学会(SCCM)和国际感染论坛(ISF)等2004年公布的《重症脓毒症和脓毒症休克治疗指南》[3]治疗,同时根据中医虚实证型变化采用相应中药治疗[4]。
1.3 观察项目 观察患者第1、3、7 d生命体征及外周血血常规、动脉血气分析、电解质、心肝肾功能及人类白细胞抗原DR位点(human leukocyte antigen DR,HLA-DR)、T辅助淋巴细胞1/2(helper T lymphocyte 1/2,Th1/Th2)、调节性T淋巴细胞(regulatory T lymphocyte,Treg)等,同时观察尿 L/M,计算APACHE-II评分。观察止点为完成观察天数,好转或死亡。最后记录所有患者SICU住院天数、总住院天数、住院费用及28 d预后等终极指标。
1.4 统计学方法 应用SPSS 16.0统计软件,计量资料采用均数±标准差(±s)表示,正态分布的计量资料两两比较采用配对t检验,独立样本采用独立样本的t检验;偏态分布资料采用Mann-Whitney U检验和Wilcoxon检验,计数数据采用率或构成比表示,组间比较使用卡方(χ2)检验,组内比较采用Wil⁃coxon检验,以P<0.05为显著性差异标准。
2 结果
2.1 肠屏障功能障碍变化 L/M测定结果表明,存活组在3个时间点内均呈逐渐下降趋势(P<0.05),死亡组则随时间进展明显增高(P<0.05)。死亡组各时间点尿L/M水平均显著高于存活组(P<0.05),见表2。
表2 两组患者尿L/M比值的测定结果(±s)

表2 两组患者尿L/M比值的测定结果(±s)
注:组间同一时间点比较,与死亡组比较,aP<0.01;组内不同时间点比较,与第1 d比较,*P<0.01;与第3 d比较,#P<0.01
n分组死亡组存活组15 42第1 d 7.87±3.68 4.64±2.10a第3 d 9.21±3.86*3.69±1.40a*第7 d 9.35±3.96*2.82±1.21a*#
2.2 HLA-DR变化 在第1、3、7 d,存活组HLA-DR水平均明显升高,死亡组逐渐降低,经组内不同时间点两两比较,差异均有显著性(P<0.01);死亡组在各时间点均显著低于存活组(P<0.05),见表3。
表3 两组患者各时间点血HLA-DR水平流式细胞仪测定结果比较(±s)
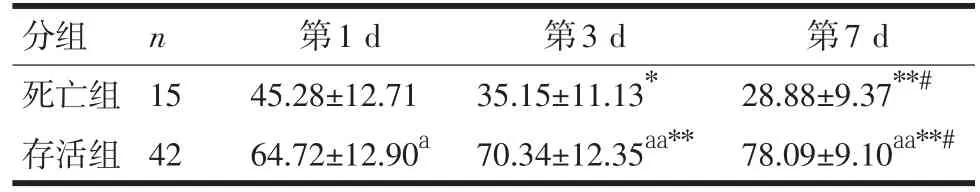
表3 两组患者各时间点血HLA-DR水平流式细胞仪测定结果比较(±s)
注:组间同一时间点比较,与死亡组比较,aP<0.05,aaP<0.01;组内不同时间点比较,与第1 d比较,*P<0.05,**P<0.01;与第3 d比较,#P<0.01
n分组死亡组存活组15 42第1 d 45.28±12.71 64.72±12.90a第3 d 35.15±11.13*70.34±12.35aa**第7 d 28.88±9.37**#78.09±9.10aa**#
2.3 Treg变化 存活组Treg水平随时间进展明显降低(P<0.01),死亡组则明显升高,两两比较具有显著性差异(P<0.01)。死亡组各时间点Treg均显著高于存活组(P<0.01),见表4。
2.4 Th1/Th2变化 随时间进展,存活组Th1/Th2逐渐增高,死亡组逐渐下降(P<0.05)。组间比较,死亡组各时间点Th1/Th2均显著高于存活组(P<0.05),见表5。
表4 两组患者各时间点血Treg水平流式细胞仪测定结果比较(±s)
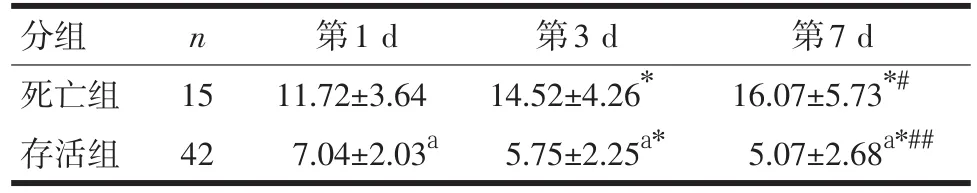
表4 两组患者各时间点血Treg水平流式细胞仪测定结果比较(±s)
注:组间同一时间点比较,与死亡组比较,aP<0.01;组内不同时间点比较,与第1 d比较,*P<0.01;与第3 d比较,#P<0.05,##P<0.01
第1 d 11.72±3.64 7.04±2.03a n分组死亡组存活组15 42第3 d 14.52±4.26*5.75±2.25a*第7 d 16.07±5.73*#5.07±2.68a*##
表5 两组患者各时间点血Th1/Th2水平流式细胞仪测定结果比较(±s)

表5 两组患者各时间点血Th1/Th2水平流式细胞仪测定结果比较(±s)
注:组间同一时间点比较,与死亡组比较,aP<0.05,aaP<0.01;组内不同时间点比较,与第1 d比较,*P<0.05,**P<0.01;与第3 d比较,#P<0.01
n分组死亡组存活组15 42第1 d 1.57±0.40 2.18±0.56a第3 d 1.32±0.37*2.72±0.63aa**第7 d 0.87±0.23**#3.27±0.90aa**#
2.5 与免疫失衡的相关性 第1、3、7 d,两组尿L/M与Treg存在正相关,相关系数分别为0.262、0.526和0.582;与HLA-DR存在负相关关系,相关系数分别为-0.397、-0.637和-0.692;与Th1/Th2呈负相关,相关系数为-0.262、-0.453和-0.525。
2.6 临床预后 57例28 d病死率26.32%,死亡组总住院天数、住院费用等较存活组明显减少(P<0.05)。存活患者尿L/M与SICU住院天数、总住院天数、住院费用等也显著正相关,相关系数分别为0.674、0.364和0.587(P<0.05),见表6。由于死亡组数据差异较大,相关性较差故不作分析。
表6 两组患者临床预后比较(±s)
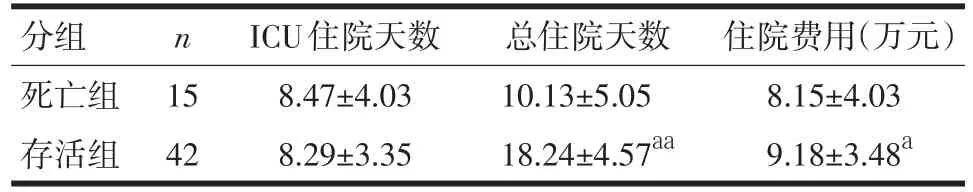
表6 两组患者临床预后比较(±s)
注:与死亡组比较,aP<0.05,aaP<0.01
n分组死亡组存活组15 42 ICU住院天数8.47±4.03 8.29±3.35总住院天数10.13±5.05 18.24±4.57aa住院费用(万元)8.15±4.03 9.18±3.48a
3 讨论
严重腹腔感染是SICU患者发生脓毒症的重要原因,而脓毒症是所有腹腔感染最为严重的一种危及生命的并发症。严重腹腔感染时,肠腔内压力增高,肠壁静脉回流受阻,毛细血管及淋巴管淤积,小动脉血流受阻,组织缺氧,细胞能量代谢障碍,导致肠组织的损伤,使肠腔中的细菌与内毒素移位而进入血循环[5]。此外,严重腹腔感染时,患者肠道处于应激状态,最易发生低灌注损伤[6]。黏膜屏障损伤促进了肠源性内毒素血症的发生,而肠源性内毒素血症伴随的全身和局部炎症介质的爆炸性增加则进一步加重了黏膜损伤,彼此促进相互增加,如此恶性循环,推动了肠屏障功能障碍的发生发展[7]。本研究发现,死亡组尿L/M高于存活组并呈进行性升高,与病情严重程度及预后存在明显相关性,提示肠屏障功能障碍在严重腹腔感染患者病理生理过程中起重要作用。
HLA-DR是表达水平最高的主要组织相容性复合体-II(MHC-II),在淋巴细胞抗原递呈和免疫应答启动过程中有至关重要的作用。正常情况下,外源性抗原与MHC-II类分子结合成MHC多肽复合物,然后转送到抗原递呈细胞(APC)表面并提呈到MHC-II限制性CD4+T细胞表面的抗原受体,引起CD4+T细胞活化,一方面发挥诱导和增强免疫应答作用,另一方面与具有免疫抑制作用的CD8+T细胞相互拮抗,调节免疫应答过程[8]。如果HLA-DR抗原表达减少,则抗原递呈作用受阻碍,机体就不能产生有效的免疫应答,其直接后果就是机体不能有效清除病原体和机体内炎性介质释放得不到有效控制[9]。Th1/Th2在体内存在着动态平衡,致病因素作用于机体后,引起局部免疫及非免疫细胞分泌少量细胞因子,导致Th前体细胞分化改变,从而导致Th1/Th2失衡,进一步影响两类细胞分泌的细胞因子水平失衡。机体内细胞因子网络逐渐紊乱,最终形成恶性循环,引起Th1、Th2细胞漂移[10-11]。Treg是不同于Th1和Th2的具有调节功能的T细胞群体。由于Treg最终介导了Th1/Th2漂移,从而影响着炎症反应的结局,因此其在脓毒症及脓毒性休克中的作用日益受到关注[12]。细胞因子、细菌及其产物(如内毒素)的刺激在体内外均可上调Treg表面活性物质,从而促进Treg增殖及存活,并增强Treg的抑制功能[13]。有资料证实,LPS刺激后CD4+CD25+T细胞升高且抑制功能增强,导致倾向于Th2型的免疫反应,而移除CD4+CD25+T细胞将增强效应性CD4+T细胞向Th1的极化,从而强化这些效应细胞引起的免疫应答[14-15]。
本研究发现,存活组患者HLA-DR与Th1/Th2随时间逐渐升高,Treg随时间进展显著降低。相反,死亡组HLA-DR与Th1/Th2逐渐降低,而Treg显著增高。同时,死亡组患者各时间点HLA-DR与Th1/Th2均显著低于存活组,而Treg均显著高于存活组。HLA-DR、Th1/Th2与Treg的规律性变化,经分析与患者肠屏障功能指标(尿L/M)显著相关表明,严重腹腔感染患者肠屏障功能对免疫功能存在显著影响,肠屏障功能障碍显著降低HLA-DR表达水平,抑制机体对病原体的有效抗原提成,使机体不能产生有效的免疫反应。同时还可以显著上调Treg水平,促进Th1/Th2反应漂移,进一步加剧了免疫抑制的发生。
肠道是腹腔感染炎症细胞激活、炎症介质释放的重要策源地,也与继发免疫失衡密切相关,如何更有效地进行肠屏障功能的保护从而改善严重腹腔感染预后仍是一个重要研究课题。
[1]Barie PS,Hydo LJ,Eachempati SR.Longitudinal Outcomes of In⁃tra-abdominal Infection Complicated by Critical Illness[J].Surgi⁃cal Infections,2004,5(4):365.
[2]Marshall JC.Intra-abdominal infections[J].Microbes Infect,2004,6(11):1015.
[3]任建安.重症脓毒症和脓毒症休克治疗指南[J].中国实用外科杂志,2005,25(1):371.
[4]傅强,崔乃强,王娜,等.严重腹腔感染所致多脏器功能障碍综合征中医辨证规律研究[J].中国中西医结合外科杂志,2009,15(1):3.
[5]Yasuda T,Takeyama Y,Ueda T,et al.Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis[J].J Surg Res,2006,135(2):18.
[6]Choudhry MA,Rana SN,Kavanaugh MJ.Impaired intestinal immuni⁃ty and barrier function:a cause for enhanced bacterial translocation in alcohol intoxication and burn injury[J].Alcohol,2004,33(3):199.
[7]崔乃强,傅强,邱奇,等.通里攻下法对SIRS/MODS的治疗价值-多中心临床分析[J].中国中西医结合外科杂志,2007,13(1):3.
[8]侯小华,程爱斌,王亦合.MODS患者CD14+单核细胞表面HLA-DR的表达及意义[J].山东医药,2008,48(15):86.
[9]Fu Q,Cui N,Yu W,et al.Percentages of CD4+T regulatory cells and HLA-DR expressing monocytes in severe intra-abdominal in⁃fections[J].Scand J Infect Dis,2010,42(6-7):475.
[10]Buttenschoen K,Fathimani K,Buttenschoen DC.Effect of major ab⁃dominal surgery on the host immune response to infection.Curr Opin Infect Dis.2010,23(3):259-67.
[11]Baecher-Allan C,Hafler DA.Suppressor T cells in human diseases[J].J Exp Med,2004,200(3):273.
[12]Zhang C,Shan J,Feng L,et al.The effect of immunosuppressive drugs on CD4(+)CD25(+)regulatory T cells:a systematic review of clinical and basic research[J].J Evid Based Med.2010,3(2):117.
[13]Purcell E M,Dolan S M,Kriynovich S,et al.Burn injury induces an early activation response by lymph node CD4+T cells[J].Shock,2006,25(2):135.
[14]Ursaciuc C,Surcel M,Ciotaru D,et al.Regulatory T cells and TH1/TH2 cytokines as immunodiagnosis keys in systemic autoim⁃mune diseases[J].Roum Arch Microbiol Immunol.2010,69(2):79.
[15]Heuer JG,Sharma GR,Gerlitz B,et al.Adoptive Transfer of In Vitro-Stimulated CD4+CD25+Regulatory T Cells Increases Bacteri⁃al Clearance and Improves Survival in Polymicrobial Sepsis[J].J Immunol,2005,174(11):7141.
