家畜戊型肝炎病毒诊断方法的建立及应用*
2011-08-21苏乾莲秦毅斌梁家幸肖爱欢段群棚黄伟坚
苏乾莲,李 斌,赵 武,秦毅斌,梁家幸,肖爱欢,段群棚,何 颖,黄伟坚
2.广西大学动物科学技术学院,南宁 530005;
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)引起的一种经消化道传播的急性病毒性肝炎,呈全球分布,以暴发流行或散发感染的形式存在。其临床和流行病学特点类似甲型肝炎,但主要侵犯青壮年,孕妇感染后病死率可高达20%[1]。1997年,Meng等在美国猪体首次分离到HEV毒株,发现其与美国人源HEV高度相似,并发现其可感染黑猩猩和恒河猴,从而首次证实了HEV种间传播的可能性[2]。随后,陆续在狗、猫、羊、牛、马等与人类密切相关的动物中发现HEV抗体或 RNA,但仍需要进一步深入研究[3-8]。
2007年第12届国际病毒性肝炎和肝病研讨会上,将HEV分为5个基因型,I型和II型仅感染人,III型和IV型为人兽共患,禽HEV被归为戊型肝炎病毒属,暂定为基因V型[9]。在前人研究基础上,本研究建立检测家畜基因I型-IV型HEV通用性RT-nPCR,并对采自广西各地的猪、牛、羊肝粪样本进行HEV检测。
1 材料与方法
1.1 主要试剂 TRIZOL Regent为Invitrogen产;d NTP为上海生工生物工程有限公司产;Ribonuclease Inhibitor为 Ta KaRa产;M-MLV Reverse Transcriptase为 Promega产;Dream TaqTMDNA Polymerase为Fermentas产;Mark1为广州东盛生物科技有限公司产。
1.2 样本和对照品 采集广西地区猪、牛、羊新鲜粪便样本以及各地市场销售或屠宰场新鲜家畜肝脏,尽快检测或-20℃保存备检。戊型肝炎病毒阳性样本由广西大学赠送;猪瘟病毒(CSFV)、伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、乙脑病毒(JEV)由本实验室保存;阴性对照为DEPC水。
1.3 引物设计及合成 参考GenBank上4种基因型HEV核苷酸序列,应用生物软件Oligo6.0在ORF2保守区设计两对简并引物,外套引物为:HEV-A/B,内套引物为:HEV-C/D,扩增片段长为436 bp,引物由上海生工生物工程有限公司合成,引物序列如下:HEV-A:5’-TAYCGHAAYCAAGGHTGGCG-3’; HEV-B:5’-TGYTGGTTRTCRTARTCCTG-3’;HEV-C:5’-ATWCATGGVTCRCCTGTGAA-3’;HEV-D:5’-TRTCCTGCTGMGCRTTCTC-3’。
1.4 样本的处理 挑取0.4g新鲜粪便样本于5 m L离心管内,加入4m L灭菌 PBS(0.01 mol/L,p H7.2)进行稀释,旋涡震荡混匀,制备成10%的粪便悬液,4℃,10 000 r/min离心10 min,抽取上清进行RNA抽提或-20℃保存。取肝脏2.0 g于无菌研钵,研磨并用PBS稀释成1∶5乳剂,反复冻融3次后10 000 r/min离心1 0min,取上清进行RNA抽提或于-20℃保存备用。
1.5 病毒RNA的提取 取样本上清液250μL于1.5 m L的EP管(DEPC水处理,高压灭菌),加入800μL Trizol,反复颠倒数次充分混匀后,室温放置10 min;加入210μL氯仿,反复颠倒数次充分混匀(成乳白色为止),室温下放置3 min;4℃,12 000 r/min离心10 min后,小心取350μL上层液体,转移到一个新的EP管,再加入等量预冷异丙醇(350 μL),温和混匀,室温下放置10 min;4℃,12 000 r/min离心10 min后,弃去上清,加入500μL 75%预冷酒精,温和混匀,8 000 r/min离心5 min;将抽提RNA置50℃温箱内晾干(管壁上水滴消失即可)后,加入35μL无RNase的水,用移液器反复温和吹匀,并于50℃水浴5 min至RNA充分溶解;即用或-70℃保存备用。
1.6 反转录和PCR反应 本实验的反转录反应体系为25μL,其中 RNA 模板16μL,d NTP(10 mmol/L)混合物2μL,5×Buffer缓冲液5μL,MMLV Reverse Transcriptase(反转录酶)(200 U/μL)0.5μL,Rnasin Inhibitor(抑制剂)(40 U/μL)0.5μL,外套下游引物(25 mmol/L)1μL,各试剂混匀后42℃反转录1 h。PCR反应体系25μL,灭菌水17.75μL,10×PCR 缓 冲 液 2.5μL,d NTP(10mmol/L)混合物0.5μL,上下游引物(25 mmol/L)各0.5μL,Taq酶(5 U/μL)0.25μL,模板3μL。PCR反应条件:95℃预变性5 min;94℃变性1 min,53℃退火1 min,72℃延伸1 min,35个循环;最后72℃延伸10 min;第二次PCR进行30个循环,其它反应条件与首轮PCR反应条件相同。
1.7 特异性试验 提取阳性对照、对照样本和阴性对照的核酸,用建立的RT-nPCR方法进行检测,电泳观察结果。
1.8 敏感性试验与重复性检验 经紫外分光光度计测量阳性样本的核酸浓度,并做10倍梯度稀释至10-8,提取每个稀释度的RNA作模板分别进行RT-nPCR。对6份不同的阳性样本分别进行3次重复性试验,检验该方法的重复性和稳定性。
1.9 HEV RT-nPCR的临床应用 用建立的RT-nPCR方法对采自广西各地猪、牛、羊的905份粪便样本,272份肝脏样本进行HEV检测。
2 结 果
2.1 HEV RT-nPCR的特异性 只有HEV阳性样本在436 bp出现特异性条带,表明以HEV特异性引物不能检测出CSFV、PRV、PRRSV、PPV和JEV的核酸,显示RT-n PCR检测HEV具有良好特异性。
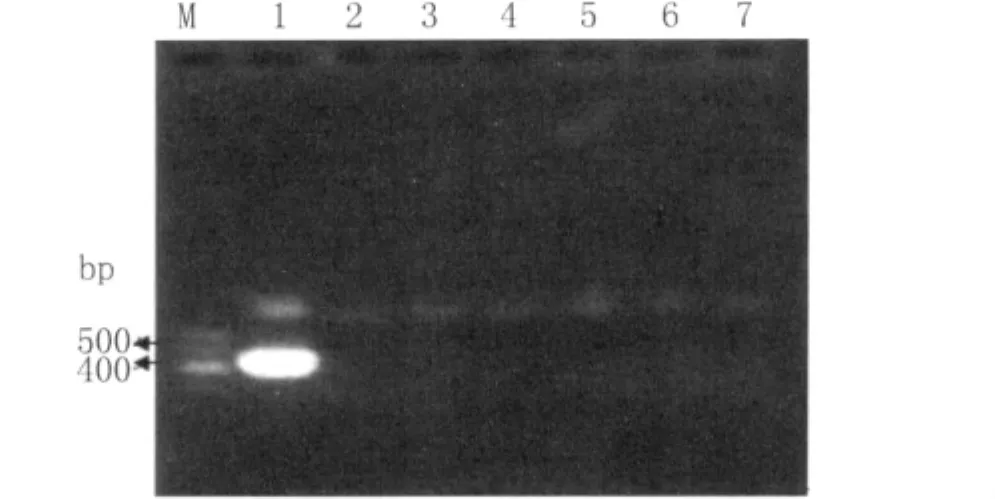
图1 HEV RT-nPCR的特异性检测M:Mark1;1:HEV阳性样本;2:阴性对照;3:猪瘟病毒;4:伪狂犬病毒;5:猪繁殖与呼吸综合征病毒;6:猪细小病毒;7:乙脑病毒Fig.1 Specificity evaluation of the RT-nPCR assay Land M:Mark1;1:HEV positive sample;2:negative control;3:CSFV;4:PRV;5:PRRSV;6:PPV;7:JEV
2.2 HEV RT-nPCR的敏感性与重复性 阳性样本的核酸浓度为30.30μg/m L,样本可检测到3.030 pg/μL。6份不同的阳性样本3次重复性检测均呈阳性,说明该方法具有良好的重复性和稳定性。
2.3 临床肝粪样本HEV的RT-nPCR检测 临床检测广西地区猪、牛、羊粪便样本阳性率31.49%(285/905),猪、牛、羊肝脏样本阳性率17.31%(49/272)。
3 讨 论
目前,HE的检测诊断最常用的是ELISA方法。血清学ELISA检测抗-HEV IgG显示广西部分地区存在多种动物 HEV的感染[10-11]。然而,目前家畜的HEV血清学ELISA抗体检测方法尚无标准化,而且血清成分较复杂,容易造成假阳性,同时已有报道在HEV血清学阴性的临床样本中检测到HEV RNA[12]。HEV通过粪便排毒所持续的时间要比病毒血症持续的时间长[13],而且作为HEV主要病毒载体的粪便以及肝脏作为检测对象更容易检测到HEV核酸,因此家畜的HEV病原监测比血清学抗体监测更为确切。套式RT-PCR已经用于HEV的临床检测,目前较常用的引物有 Meng、ConORF1、ConORF2和E引物,本研究建立的RT-nPCR检测方法的引物主要针对基因I-IV型人畜HEV ORF2(其对于基因V型禽类HEV无法检测出,针对V型禽类HEV RT-nPCR检测方法的建立及应用另文刊发),该RT-nPCR具有良好的特异性、敏感性和重复性,前期应用表明具有良好的可行
性[14]。
广西是人HE的高发区,农村人群HEV抗体阳性率高达43%,而且亦已证实人感染HEV途径主要是通过接触猪及其排泄物而并非人与人之间接触传播[15]。广西农村人群HEV抗体阳性率较高可能与广大农村地区大都有将猪、牛、羊圈养在自己的屋子旁边的习惯,而且管理条件及卫生状况较差,易通过粪-口途径感染HEV具有密切关系。本研究通过对HEV主要载体粪肝的检测证实广西猪、牛、羊群存在HEV感染,进一步证实感染家畜及市售带毒家畜肝脏是HEV重要的储存库和传染源,应该重视其公共卫生学意义,预防粪-口途径或者食源性HEV感染。
[1]Skidmore S.Overview of hepatitis E virus[J].Curr Infect Dis Rep,2002,4(2):118-123.
[2]Meng XJ.Novel strains of hepatitis E virus identified from humans and other animal species:is hepatitis E a zoonosis[J].J Hepatol,2000,33(5):842-845.
[3]Li TC,Chijiwa K,Sera N,et al.Hepatitis E Virus Transmission from Wild Boar Meat[J].Emerg Infect Dis,2005,11(12):1958-1960.
[4]Okamoto H,Takahashi M,Nishizawa T,et al.Presence of Antibodies to Hepatitis E Virus in Japanese Pet Cats[J].Infection,2004,32(1):57-58.
[5]Saad MD,Hussein HA,Bashandy MM,et al.Hepatitis E virus Infection in Work Horses in Egypt[J].Infect Genet Evol,2007,7(3):368-373.
[6]Huang FF,Haqshenas G,Shivaprasad HL,et al.Heterogeneity and seroprevalence of a newly identified avian hepatitis E virus from chickens in the United States[J].J Clin Microbiol,2002,40(11):4197-4202.
[7]Tsarev SA,Tsareva TS.Experimental hepatitis E in pregnant rhesus monkeys:failure to transmit hepatitis E virus(HEV)to offspring and evidence of naturally acquired antibodies to HEV[J].J Infect Dis,1995,172(1):31-37.
[8]Guthmann JP,Klovstad H,Boccia D,et al.A Large Outbreak of Hepatitis E among a Displaced Population in Darfur,Sudan,2004:The Role of Water Treatment Methods[J].Clin Infect Dis,2006,42(12):1685-1691.
[9]Mushahwar IK.Hepatitis E Virus:molecular virology,clinical features,diagnosis,transmission,epidemiology,and prevention[J].J Med Virol,2008,80(4):646-658.
[10]韦献飞,梁靖瑞,唐荣兰,等.广西地区猪、鼠、狗戊型肝炎病毒感染血清学分析[J].中国公共卫生,2007,23(2):228-229.
[11]朱永红,陈焰锋,唐荣兰,等.猪、羊、鸡抗-H EV抗体流行率调查[J].中华实验和临床病毒学杂志,2004,18(2):127-128.
[12]李奎,庄辉,王佑春,等.从抗-HEV阴性的戊型肝炎病人血清中检测到l株 HEV变异株[J].中华微生物学和免疫学杂志,2000,20(2):164-166.
[13]Clayson ET,Myin L KS,Snitbhan R,et al.Viremia,fecal shedding,and Ig M and Ig G responses in patients with hepatitis E [J].J Infect Dis,1995,172(4):927-933.
[14]赵武,秦毅斌,肖爱欢,等.广西14市猪戊型肝炎的分子流行病学分析[J].基因组学与应用生物学,2010,29(3):464-470.
[15]Li RC,Ge SX,Li YP,et al.Seroprevalence of hepatitis E virus infection,rural southern people’s republic of China[J].Emerging Infectious Diseases,2006,12(11):1682-1688.
