编码日本血吸虫Akt蛋白的cDNA克隆及原核表达
2011-08-21周春景石耀军杨德浩程国锋
周春景,罗 荣,石耀军,丁 硕,2,杨德浩,3 ,程国锋
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2.上海大学,上海 200444;3.河北北方学院,石家庄 075000)
Akt又称蛋白激酶B(protein kinase B, PKB),在哺乳动物中,不同的Akt亚型都含有氨基末端PH结构域,富含甘氨酸的铰链区,中心激酶结构域和富含色氨酸/苏氨酸的羧基末端区组成[1,2]。
Akt通过磷酸化其下游蛋白分子,可调控细胞生长、发育、凋亡和增殖等多种生物行为[3]。早在十多年前,研究表明Akt通路过度活化是肿瘤发生的一个重要因素[2-5]。另有研究表明,Akt蛋白可以促进血管的形成,加速局部血液循环组织的重建,提高器官移植的存活率[6]。还有研究表明,Akt通过磷酸化GSK-3调节糖原的代谢[7,8],另外,磷酸化的GSK-3可参与多种信号通路的调控[9],比如WNT等。本研究对日本血吸虫编码Akt蛋白的cDNA进行了初步研究,并制备了针对其的特异性抗体,为深入研究其功能奠定了初步基础。
1 材料与方法
1.1 材料
1.1.1 生物材料 新西兰大耳兔购自上海罗泾飞达实验动物养殖场;日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供。新西兰大耳兔以腹部贴片法感染约4000条日本血吸虫尾蚴,在感染尾蚴21 d后剖杀兔子,通过肝门静脉灌注法收集血吸虫虫体,PBS充分洗涤虫体以去除粘附物,液氮冻存待用。原核表达质粒pET28a(+) 和大肠杆菌BL21由本实验室保存。
1.1.2 生化试剂 ExTaqDNA聚合酶、T4 DNA连接酶等购自TaKaRa生物工程 (大连) 有限公司;限制性内切酶EcoR I和Hind III及预染蛋白质Maker SM6071购自Fermentas公司; AxyPrepTM DNA Gel Extraction Kit 购自爱思进生物技术(杭州)有限 公 司;His-Bind®Purification Kit购 自 Novagen公司;DNA Marker DL2000、DNA Marker Ⅳ、预染蛋白质MarkerⅡ购自天根生化科技(北京)有限公司;硝酸纤维素膜(Whatman)购自北京经科宏达生物技术有限公司;羊抗兔IgG-AP及AP底物显色液购自北京康为世纪生物科技有限公司;TRIzol® reagent购自上海英骏生物技术公司。
1.1.3 引物合成和DNA测序 引物合成在上海杰瑞生物工程公司合成;重组质粒DNA测序由华大基因公司完成。
1.2 方法
1.2.1 生物信息学分析 根据Akt蛋白的3个保守结构域,利用在线工具Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析日本血吸虫Akt的cDNA序列, 利 用 iprscan(http://www.ebi.ac.uk/Tools/pfa/iprscan/)分析蛋白结构域,运用ClustalW进行多序列比对,并通过MEGA 4软件构建系统进化树。1.2.2 日本血吸虫cDNA制备 TRIzol®法抽提日本血吸虫总RNA,DNase处理总RNA消除基因组,通过EB染色琼脂糖凝胶电泳鉴定RNA质量并用分光光度计对其进行浓度测定,采用Fermentas RevertAid TM First Strand cDNA Synthesis Kit 进行逆转录,制备日本血吸虫cDNA。
1.2.3 重组质粒pET28a(+)-SjAkt构建 以制备的日本血吸虫cDNA为模板,利用PCR扩增(上游引物序列:5'-CGGAATTCGGTGCTGAAATTACAC TGGC-3';下游引物序列: 5'-CCCAAGCTTGTCC TTCCCAGCCTCTAT-3')编码日本血吸虫Akt蛋白的催化功能域部分CDS;将扩增产物按常规方法克隆到pET28a(+)载体中,构建重组表达质粒并进行测序。
1.2.4 重组蛋白表达与纯化 将测序结果正确的重组质粒转化至BL21中,挑取单克隆并将其置于5ml LB(Kan+)培养基中过夜培养(37℃, 220 r/min),取1 mL过夜培养的菌液接种于100 mL 2×YT (Kan+)培养基中恒温培养(37℃, 220 r/min),当菌液OD600值为0.5时,加入IPTG至终浓度为1 mmol/L,继续诱导培养6 h,收集菌体,SDS-PAGE电泳检测重组蛋白表达情况;采用超声方法裂解菌体,分别收集包涵体和上清,SDS-PAGE电泳检测表达的蛋白为包涵体,用5 mL含8 mol/L尿素的PBS重悬,冰浴1 h,镍柱亲和层析纯化重组蛋白,SDSPAGE电泳检测纯化效果,用6、4、2、1 mol/L尿素分别透析2 h进行蛋白复性,并采用Bradford 蛋白浓度测定试剂盒检测蛋白浓度。
1.2.5 抗SjAkt重组蛋白多克隆抗体的制备 以纯化的Akt重组蛋白免疫新西兰大耳兔。首免取500 μg重组蛋白与206佐剂等体积混合,在漩涡振荡器上乳化1 h,于兔背部皮下多点注射,每两周加强免疫1次,免疫剂量为首次免疫的一半。第三次免疫后d 9耳缘静脉采血10 mL, 37℃放置1 h,4℃静置过夜,800g离心分离免疫血清,制备抗血清,-20℃保存。
1.2.6 Western blot分析 纯化重组蛋白进行SDSPAGE电泳,通过电转法将蛋白转移至硝酸纤维薄膜上,然后用含3%BSA的TBST溶液中室温震荡孵育40 min,封闭结束后,将膜置入3%BSA TBST (含1:1000倍稀释的SjAkt多抗),4℃摇床孵育过夜。结束后,将膜用TBST洗3次,每次5min。然后将膜置入含碱性磷酸酶标记的抗兔IgG二抗(1:3000稀释)的TBST溶液中,孵育1h,然后TBST溶液洗膜3次,每次5 min,将碱性磷酸酶底物反应液滴于硝酸纤维薄膜上,反应5 min,显色结束后膜浸于超纯水中终止反应。
2 结果
2.1 生物信息学分析 生物信息学分析表明日本血吸虫NCBI数据库中有3个EST含有Akt保守结构域,基因组预测的蛋白数据库中有2个预测的Akt蛋白序列(表1),对此进行多序列比对分析,蛋白序列AAW25998.2包括蛋白序列AAP06192.1和CPRT0000011075,蛋白序列CPRT0000010548包括蛋白序列AAW24576.1(图1)。蛋白保守功能结构域分析表明AAW25998.2含有不完整的Akt蛋白保守的催化结构域、羧基末端结构域及活性位点;基因组预测的蛋白CPRT0000010548含有PH结构域及不完整的催化结构域,且存在保守的ATP结合位点(图1)。系统进化树分析表明AAW25998.2、CPRT0000010548与曼氏血吸虫Akt蛋白具有较为相近的亲缘关系(图2)。

表1 日本血吸虫Akt蛋白的序列分析结果Table 1 The results of data mining for searching Akt proteins in Schistosoma japonicum

图1 Akt蛋白结构域分析Fig.1 Conserved domains analysis of three EST and two predicted proteins
2.2 PCR扩增编码SjAkt cDNA序列 聚合酶链式反应扩增Akt蛋白催化功能域的编码cDNA,1.0%琼脂糖凝胶电泳结果显示获得单一目的条带(图3),条带大约800 bp。
2.3 原核重组表达质粒pET28a(+)-SjAkt构建 利用限制性内切酶EcoR I和Hind III对PCR产物和pET28a(+)载体进行双酶切,胶回收后在T4 DNA连接酶的作用下连接克隆,转化涂板,菌液PCR筛选阳性克隆。双酶切结果表明成功克隆目的片段(图4),同时测序结果显示序列完全正确,大小为819bp。

表2 Akt蛋白系统发生树Fig.2 Phylogenetic tree of Akt proteins

图3 PCR扩增SjAkt编码cDNAFig.3 Amplif i cation of a cDNA fragment encoding SjAkt by PCR

图4 pET28a(+)-SjAkt双酶切鉴定结果Fig.4 Restriction enzyme digestion analysis of pET28a(+)-SjAkt plasmid by EcoR I and Hind III
2.4 重组蛋白表达纯化 测序正确的重组质粒pET28a(+)-SjAkt转化BL21感受态细胞,挑取单克隆扩大培养至OD600为0.5时加入IPTG至终浓度为1 mmol/L,继续培养诱导表达重组蛋白,采用超声方法裂解菌体,分别收集包涵体和上清,SDSPAGE电泳检测表达的蛋白为包涵体;用5 mL含8 mol/L尿素的PBS溶解包涵体后,通过镍柱亲和层析得到高纯度的重组融合蛋白,重组蛋白大小在35 kDa左右 (图 5)。
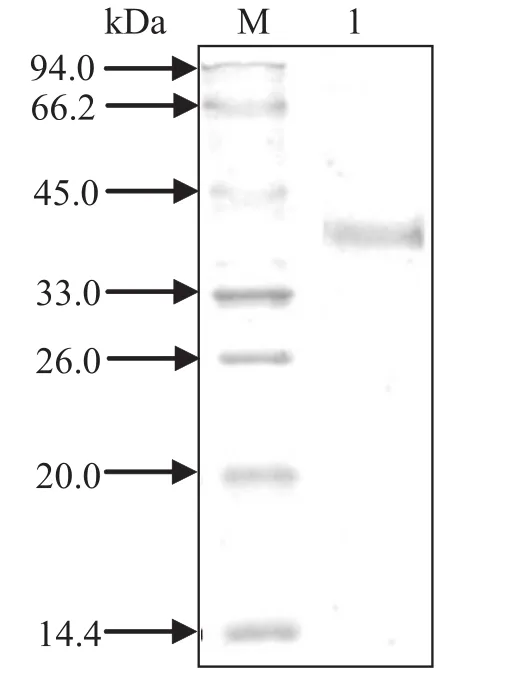
图5 10% SDS-PAGE分析纯化重组蛋白Fig.5 10% SDS-PAGE analysis of purif i ed recombinant protein
2.5 Western blot分析 利用本研究中制备的多克隆抗体,Western blot分析日本血吸虫重组蛋白Akt,结果显示在35 kDa位置出现单一条带(图6),且与日本血吸虫重组蛋白分子量一致,表明该免疫血清能识别日本血吸虫重组蛋白SjAkt。

图6 重组蛋白SjAkt的Western blot分析Fig.6 Western blot analysis for recombinant protein of polyclonal antibodies
3 讨论
Akt蛋白是一种丝/苏氨酸蛋白激酶,是细胞内外许多信号转导通路的重要节点,大量研究表明,Akt可调控细胞生长、发育、凋亡和增殖等多种生物行为,在生物体的生长发育过程中扮演重要角色。随着对Akt蛋白的深入研究,Akt的一些下游因子也逐渐引起人们关注,比如其下游分子GSK3[9],活化的GSK3不仅参与胰岛素信号通路,而且参与调节细胞周期及Wnt等信号通路,调节生物体的生长发育。
日本血吸虫的生活史比较复杂,其生长发育过程离不开精确的信号传导,目前研究者对多个信号蛋白分子进行了初步探究,如WD101、Smad4[10-11],但未见对血吸虫Akt蛋白生物学功能及其下游分子的相关报道。
本研究发现在日本血吸虫中存在2个Akt蛋白,蛋白保守功能结构域分析表明这两个Akt蛋白序列均含有保守的催化功能结构域,序列同源比较和系统进化分析表明该蛋白与曼氏血吸虫Akt蛋白具有较高的同源性。本研究还成功制备了Akt多克隆抗体,免疫印迹法分析表明该多克隆抗体可特异性识别日本血吸虫重组蛋白Akt,抗体特异性较好,可用于免疫组织化学和免疫印记检测,为进一步研究Akt蛋白在血吸虫中的生物学功能及发现其下游分子在奠定基础。
[1]Staal S P , Hartley J W, Rowe W P.Isolation of transforming murine leukemia viruses from mice with a high incidence of spontaneous lymphoma[J].Proc Natl Acad Sci USA , 1977, 74(7) : 3065 - 3067.
[2]Cheng G Z, Park S, Shu S.Advances of Akt pathway in human oncogenesis and as a target for anti-cancer drug discovery[J].Curr Cancer Drug Targets, 2008, 8(1): 2-6.
[3]Liang J, Slingerland J M.Multiple roles of the PI3K/PKB(Akt) pathway in cell cycle progression[J].Cell Cycle,2003, 2(4): 339-345.
[4]Shtilbans V, Wu M, Burstein D E.Current overview of the role of Akt in cancer studies via applied immunohistochemistry[J].Ann Diagn Pathol, 2008, 12(2): 153-160.
[5] 黄娜, 朱静,李为民.Akt与肿瘤关系的研究进展[J].华西医学, 2010, 25(12): 2291-2292.
[6] Boker A, Rothenberg L, Hernandez C,et al.Human islet transplantation: update[J].World J Surg, 2001, 25(4): 481-486.
[7]Alessi D R, Andjelkovic M, Caudwell B,et al.Mechanism of activation of protein kinase B by insulin and IGF-1[J].EMBO J, 1996, 5(23): 6541-6551.
[8] Cross D A, Alessl D R, Cohen P,et al.Inhibition of glycogen synthase kinase-3 by insulin mediated by protein kinase B[J].Nature, 1995, 378, 785-789.
[9] Sheelagh FRAME,Philip COHEN.GSK3 takes centre stage more than 20 years after its discovery[J].Biochem, 2001,359, 1-16.
[10]刘玲, 陈守义, 余新炳, 等.日本血吸虫信号通路相关基因SjWD101 的生物信息学分析及其克隆与表达[J].中国人兽共患病学报 2009, 25(1): 4-5.
[11] Osman A, Niles E G, LoVerde P T.Expression of functional Schistosoma mansoni Smad4: role in Erkmediated transforming growth factor beta (TGF-beta)down-regulation[J].J Biol Chem, 2004, 279(8): 6474-6486.
