TTMV间接ELISA检测方法的建立
2011-08-21武燕斌刘志伟李培锋杨志彪梁爱斌华修国
阿 荣, 武燕斌,刘志伟,李培锋,杨志彪,崔 立,梁爱斌, 华修国
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.上海交通大学农业与生物学院上海市兽医生物技术重点实验室,上海 200240;3.上海同济医院血液科,上海 200065)
Torque teno mini virus (TTMV)首次由日本学者Shunji Mishiro 等在2000年初发现[1],该病毒是一种新型单链环状DNA病毒,病毒颗粒直径小于30 nm[2],其基因结构类似于细环病毒(Torque teno virus, TTV)和鸡贫血症病毒(Chicken anemia virus, CAV),有2~3个开放读码框架(opening reading frame,ORF) ,ORF1和 ORF2 均在主链上,且较长的ORF1位于较短的ORF2之后, 二者有部分重叠[3]。TTMV由2765~2952 核苷酸组成,以感染人类为主,法国、挪威、巴西等国家均有在健康人血清中检测到TTMV的报道[4-6]。除了感染人类,该病毒也可感染灵长类,而且在猩猩体内感染率高达100%,在黑猩猩和长臂猿的体内的感染率分别为80%和63%[7]。由于该病毒在种系上介于TTV与CAV之间,故被命名为TTV样微小病毒(TTV-like mini virus,TLMV)[8]。2001年由国际委员会(ICTV)将其改名为Torque teno mini virus(TTMV)。2005年,病毒分类-国际病毒分类委员会(ICTV)将其单列为未定科的指环病毒属成员(Anellovirida)[9]。
套式PCR及实时定量PCR是检测TTMV的主要方法,而应用较为广泛的血清学诊断方法——酶联免疫吸附试验(ELISA)检测TTMV尚未见报道[10]。因此,本研究以实验室纯化好的TTMV重组蛋白作为包被抗原,经条件优化,初步建立了一种简便、经济、特异的检测TTMV的间接ELISA 检测方法,并应用于临床血清样品,为TTMV诊断试剂盒的研制奠定了基础。
1 材料与方法
1.1 材料 辣根过氧化酶标记(HRP)的兔抗人IgG购自上海中科英沐生物科技有限公司;小牛血清白蛋白BSA、脱脂奶粉、可拆的ELISA板(COSTAR)购自上海东盛生物公司;可溶型TMB购自天根生物;明胶、人博卡病毒、人星状病毒阳性血清、TTV阳性血清、HIV阳性血清等均由本实验室保存;280份待检血清样品来自临床病人(上海同济医院门诊病人血清124份,辽宁锦州医学院门诊病人血清156份)。
1.2 间接ELISA方法的建立
1.2.1 TTMV标准血清样本及抗原的制备 设计并合成环状病毒通用引物,采用巢式PCR对血清样品进行检测,对阳性样本利用特异性引物再进行巢式PCR检测,以确定标准阳性血清样品。在原核表达系统中表达TTMV中ORF1基因编码蛋白(阿荣等,2001),经蛋白纯化树脂Ni-NTA柱的纯化及Western blot对蛋白活性进行分析后,测定蛋白浓度,-80℃保存。
1.2.2 抗原最佳包被浓度和血清最佳稀释度确定 采用方阵滴定试验确定抗原最佳包被浓度和血清最佳稀释度。将纯化的重组蛋白依次稀释成3.26、1.63、0.80、0.40 μg/mL浓度包被酶标板。阳性血清和阴性血清分别做1:80、1:160、1:320、1:640、1:1280稀释,按常规ELISA方法操作,结果判定:以阳性血清OD450值在1.0且P/N值最大的抗原的稀释倍数作为抗原最佳的工作浓度,对该点对应的血清稀释度为最佳的血清稀释度。
1.2.3 抗原包被条件的确定 以最佳抗原浓度包被ELISA板,每孔100 μL,分成3组。第1组:37℃包被2 h;第2组:37 ℃孵育1 h后4 ℃包被过夜;第3组:4 ℃包被过夜。三种不同包被条件下包被后,用TTMV标准阴性、阳性血清进行常规ELISA操作,测定OD450值和P/N值,以确定抗原的最佳包被条件。
1.2.4 最佳封闭液的选择及封闭时间的确定 分别以5%脱脂奶粉、1% BSA、1%明胶作为封闭液加于ELISA板(均用PBS配制),100 μL/孔,37℃封闭2 h,用TTMV阴、阳性血清进行常规ELISA检测。判定结果后,再将选定的封闭液分别在37℃封闭0.5、1、2 h,比较各组阴、阳性血清的OD450值和P/N值, 以确定最佳封闭时间。
1.2.5 血清最适作用时间的确定 用PBS将已知的阴、阳性血清做最佳稀释倍数后,于37 ℃分别作用30、60、90 min,每个反应重复2次。在其它条件及操作方法相同的情况下,进行ELISA检测,根据OD450值及P/N值确定最佳血清作用时间。
1.2.6 酶标二抗工作时间的确定 将酶标二抗做1:3000稀释(按使用说明书),100 μL/孔,分别于37 ℃作用30、60、120 min,比较阴、阳性血清的OD450值和P/N值,以确定酶标二抗的最佳工作时间。
1.2.7 底物显色时间的确定 按照既定的ELISA程序依次包被、封闭,加入阴、阳性血清,再和酶标二抗反应,之后加底物反应液显色,室温下分别设5、10、15 min后用终止液终止反应,每个反应重复3孔,读取OD450值。根据OD450值及P/N值确定最佳底物显色时间。
1.2.8 临界值的确定 按上述建立的ELISA方法,对本实验室保存的20份TTMV阴性血清进行检测,经统计学分析,得到OD450平均值(x) 和标准差(SD)。根据统计学原则,检测样本OD450≥x+3SD,判定为阳性。
1.3 特异性实验 在间接ELISA反应条件下,用抗原包被酶标板分别对TTV阳性血清、人星状病毒阳性血清、人博卡病毒阳性血清、HIV阳性血清做间接ELISA实验,同时设TTMV阳性、阴性对照,以此来判断是否存在交叉反应。
1.4 重复实验 用同批次纯化重组抗原包被同一块ELISA板,对3份阳性血清和1份阴性血清样本进行检测,重复3个孔,测定OD450值, 计算变异系数(CV),评价批内重复试验效果。用4块不同时间包被的ELISA板,对已知的3份阳性血清和1份阴性血清样品进行检测,重复3个孔,测定OD450值,并计算变异系数(CV),评价批间重复试验效果。测方法,对上海市同济医院124份门诊病人血清样品和辽宁省锦州医学院156份门诊病人血清样品进行检测。
2 结果
1.5 临床血清样品的检测 运用所建立的ELISA检
2.1 间接ELISA方法的建立
2.1.1 抗原最佳包被浓度与血清最佳稀释度的确定经表达纯化后的抗原终浓度为163 μg/mL,经倍比稀释后通过方阵滴定法确定抗原与血清的最佳浓度与稀释度,当抗原的稀释度为1:100(1.63 μg/mL)、血清稀释倍数为1:320时,阳性血清OD450值接近1.0,P/N值最大。确定重组蛋白最佳包被浓度为1.63 μg/mL,血清最佳稀释度为1:320 (表1)。

表1 重组蛋白抗原最适包被浓度与血清稀释倍数的确定Table 1 Determination of the coating concentration of recombinant protein and serum dilution
2.1.2 抗原包被条件的确定 用检测抗原1.63 μg/mL包被酶标板,以第二组的包被条件P/N值最高,达到7.89,结果表明,37 ℃ 1 h后4 ℃过夜是抗原的最佳包被条件(表2)。

表2 蛋白抗原包被条件的确定Table 2 Determination of the condition for coating of recombinant protein
2.1.3 最佳封闭液的选择及封闭时间确定 由表3、4可知,以5%脱脂奶粉封闭液结果最理想,故选择5%脱脂奶粉作为封闭液。封闭时间1 h和2 h效果无显著差异,为了节省时间,故选择封闭液1 h作为最佳封闭时间。2.1.4 血清最适作用时间 在室温条件下,血清作用60 min与作用90 min检测结果差异不显著,而与作用30 min相比,检测效果更好,从缩短检测时间,提高检测效率的角度来考虑,确定血清最佳作用时间为 37 ℃ 60 min (表 5) 。
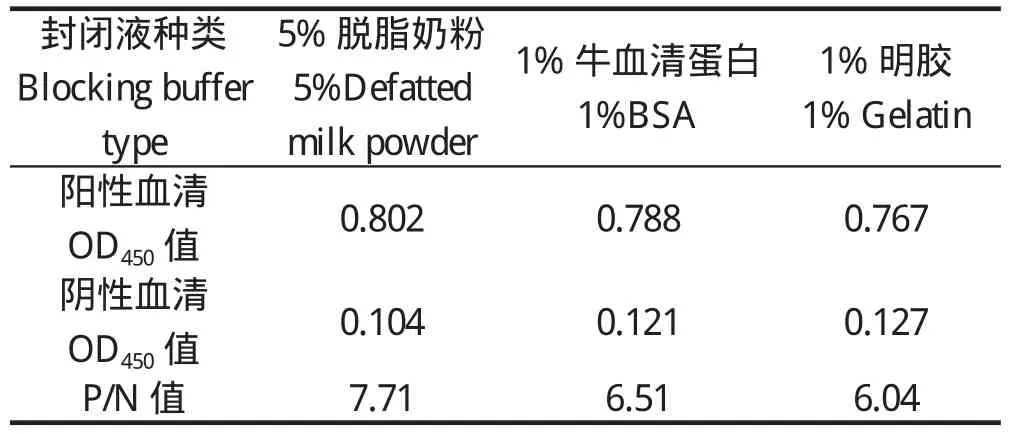
表3 封闭液的确定Table 3 Determination for closing materials

表4 封闭时间的确定Table 4 Determination for closing time
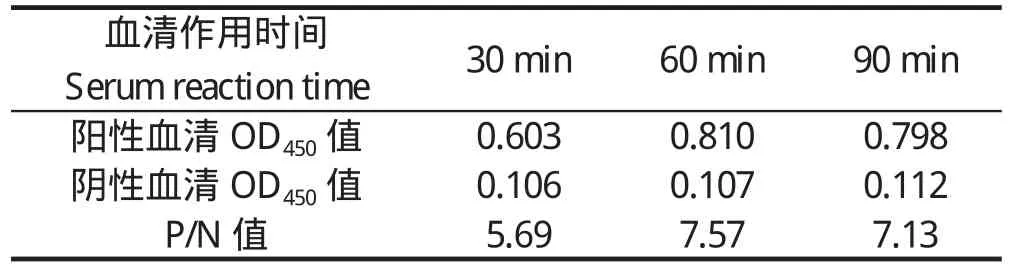
表5 血清最佳作用时间的确定Table 5 Determination for optimum sera reaction time
2.1.5 酶标二抗工作时间的确定 酶标二抗作用时间为60 min时,阳性血清OD450值较大,且P/N值最大。因此选择酶标二抗的最适作用时间为60 min(表6)。2.1.6 底物显色时间的确定 底物作用10 min时,阳性血清OD值已达到0.8以上,且P/N值最大,作用时间超过15 min后,阴性血清OD值明显上升。因此选择底物显色时间为10 min(表7)。
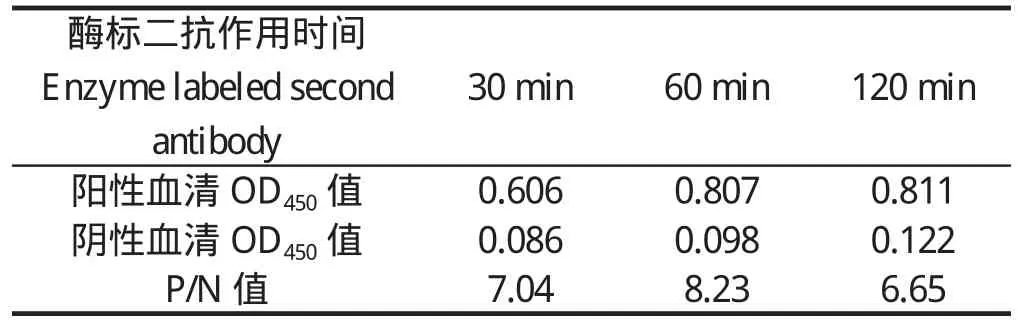
表6 酶标二抗最佳作用时间的确定Table 6 Determination for optimum Rabbit anti-human IgG/HRP reaction time

表7 底物最佳显色时间的确定Table 7 Determination for optimum substrate reaction time
2.1.7 临界值的确定 计算20份TTMV阴性血清OD450的平均值(x)为0.1116,标准差(SD)为0.0331,按照公式:x+3SD确定重组蛋白ELISA的阴阳性临界值为0.211,即确定当用重组蛋白ELISA方法检测时,OD450值>0.211可判断为阳性,OD450值<0.211则为阴性(表8)。

表8 间接ELISA阴阳性临界值的确定Table 8 Determination of the threshold for ELISA
2.2 特异性实验 按建立的ELISA检测方法对人TTV阳性血清、人HIV阳性血清和人星状病毒(Astrovirus, AstV)阳性血清、人博卡病毒(Human Bocavirus, HBoV)阳性血清进行检测,同时设TTMV阳性和TTMV阴性对照,可知其他4种病毒的阳性血清均为阴性反应,即没有交叉反应(表9)。

表9 交叉试验结果Table 9 Cross test result of indirect ELISA
2.3 重复实验 用同批次纯化重组抗原包被同一块ELISA板,对3份阳性血清和1份阴性血清样本进行检测,重复3个孔,其变异系数在2.55%~5.88%之间,表明该方法具有较好的批内重复性。用4块不同时间包被的ELISA板,对包括已知阴、阳性血清在内的4份样品进行检测,重复3个孔,其变异系数介于3.08%~7.47%之间,表明所建立的间接ELISA方法具有较好的重复性。
2.4 ELISA的初步应用 应用初步建立的ELISA检测方法对上海同济医院124份门诊病人血清样品和辽宁锦州医学院156份门诊病人血清样品进行检测,检测结果显示,上海市124份血清样本中检测出阳性43例(34.68%),辽宁省156份血清样本中阳性62例(39.74%)。
3 讨论
ORF是基因序列的一部分,包含一段可以编码蛋白的碱基序列,不能被终止子打断。TTMV 的ORF1由大约675个氨基酸组成,主要编码TTMV核衣壳蛋白,并包含一些保守序列,TTMV核衣壳蛋白具有若干N 糖基化功能区,与TTV 和CAV 相似[11-12]。从2000年日本研究者首次报道了TTMV至今,不少研究学者都相继报道了TTMV的流行病学调查结果。本试验利用实验室构建并纯化的重组蛋白TTMV-ORF1蛋白作为包被抗原,建立了检测TTMV的间接ELISA检测方法。
为了降低ELISA法的非特异性,首先以方阵滴定实验调整好抗原最佳包被浓度为1.63 μg/mL,同时确定了血清的最佳稀释倍数为1:320。为了避免因反应时间过短而引起的结果误差以及因反应过长影响检测的敏感性和特异性, 本研究对反应中的各项条件进行了优化,结果显示,用含5%脱脂奶粉37℃ 1 h进行封闭,待检血清37 ℃作用1 h, 酶标二抗37 ℃作用1 h, 底物TMB显色液37 ℃作用10 min,ELISA结果最好且重复性较好。
此外,本研究根据统计学方法通过对20份阴性血清样品进行ELISA检测,确定临界值为0.211后,对上海市124份血清样本中检测出阳性43例(34.68%),辽宁省156份血清样本中阳性62例(39.74%)。本研究建立的间接ELISA检测方法具有灵敏度高、特异性强、操作简单快速等特点,为TTMV的实验室检测及ELISA诊断试剂盒的制备提供了试验依据,具有较好的应用前景。
[1] Takahashi K, Iwasa Y, Hijikata M,et al.Identification of a new human DNA virus (TTV-like mini virus , TLMV)intermediately related to TT virus and chicken anemia virus[J].Arch Virol, 2000, 145(5) :979-993.
[2] Jones M S, Kapoor A, Lukashov V V,et al.New DNA viruses identified in patients with acute viral infection syndrome[J].J Virol, 2005, 79(13): 8230-8236.
[3] Harvery A.Relationship to Hepatitis Update on Viral Hepatitis postgraduate Course[J].Am Association Study Liver Dis, 2000: 68.
[4] Gallian P, Biagini P, Attoui H,et al.High genetic diversity revealed by the study of TLMV infection in french hemodialysis patients[J].J Med Virol, 2002, 67(4): 630-635.
[5] Moen E M, Huang L, Grinde B.Molecular epidemiology of TTV-like mini virus in Norway[J].Arch Virol, 2002,147(1): 181-185.
[6] Niel C, Lampe E.High detection rates of TTV-like mini virus sequences in sera from brazilian blood donors[J].J Med Virol, 2001, 65(1): 199-205.
[7] Thom K, Morrison C, Lewis J,et al.Distribution of TT virus (TTV), TTV-like minivirus, and related viruses, in humans and nonhuman primates[J].Virol, 2003, 306(2):324-333.
[8] Biagini P, Attoui H, Touinssi M,et al.Genetic analysis of Full-lengt h genomes and subgenomic sequences of TT virus-like mini virus human isolates[J].J Gen Virol, 2001,82(2): 379-383.
[9]陆承平.最新动物病毒分类简介[J].中国病毒学, 2005,20(6): 682-688.
[10] Wellemans G.Laboratory diagnosis methods for bovine respiratory syncytial virus[J].Vet Sci Commun, 1977, 1:179-189.
[11] Biagini P, Attoui H, Touinssi M,et al.Genetic analysis of Full-length genomes and subgenomic sequences of TT virus-like mini virus human isolates[J].J Gen Virol, 2001,82 (2): 379-383.
[12]何忠平.TTV 相关病毒的研究进展[J].临床输血与检验,2003, 5(2): 153-156.
[13] Fornai C, Maggi F, Vatteroni M L,et al.High prevalence of TT virus (TTV) and TTV-like mini virus in cervical swabs[J].J Clin Microbiol, 2001, 39: 2022-2024.
[14] Christian N, Elisabeth L.High detection rates of ttvlike mini virus sequences in sera from brazilian blood donors[J].J Med Virol, 2001, 65(1): 199-205.
[15] Matsubara H, Michitaka K, Horiike N,et al.Existence of TT virus DNA and TTV-like mini virus DNA in infant cord blood: mother-to-neonatal transmission[J].Hepatol Res, 2001, 21(3): 280-287.
[16] Moen E M, Sleboda J, Grinde B.Real-time PCR methods for independent quantitation of TTV and TTMV[J].J Virol Meth, 2002, 104(1): 59-67.
[17] Ninomiya M, Takahash M, Hoshino Y,et al.Analysis of the entire genomes of torque teno midi virus variants in chimpanzees: infrequent cross-species infection between humans and chimpanzees[J].J Med Virol, 2009, 90(Pt2):347-358.
[18] Vasconcelos H C, Cataldo M, Niel C.Mixed infections of adults and children with multiple TTV-like mini virus isolates[J].J Med Virol, 2002, 68(2): 291-298.
[19] Philippe B.Human circoviruses[J].Vet Microbiol, 2004,98: 95-101.
[20] Moen E M, Sleboda J, Grinde B.Serum concentrations of TT virus and TT virus-like mini virus in patients developing AIDS[J].Aids, 2002, 16(12): 1679-1682.
[21] Philippe B, Pierre G, Jean F C,et al.Distribution and genetic analysis of TTV and TTMV major phylogenetic groups in french blood donors[J].J Med Virol, 2006, 78(2):298-304.
