鸡艾美耳球虫18S rDNA序列与系统进化分析
2011-08-21韩红玉赵其平姜连连
蔡 兰 ,韩红玉 ,黄 兵 ,董 辉 ,赵其平 ,姜连连
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2.绍兴出入境检验检疫局,绍兴 312000)
生物分类的目的是探索生物的系统发育及其进化历史,揭示生物的多样性及其亲缘关系,并建立多层次的以系统发育为依据的自然分类系统。从单一依赖于形态学特征(光学和电子显微镜为主要观测手段)、生活史特征及宿主范围来推测单细胞寄生生物间关系,发展到结合更广的分子生物学特征来确定的原因在于,当单细胞生物具有较大程度的形态学和生活史特征变化时,分子生物学特征能更真实准确地反应出这种变化关系[1]。分子分类方法以蛋白质、染色体、核酸为材料,运用同工酶电泳技术、免疫技术、分子细胞学技术、DNA杂交、种群基因结构分析和测序等技术进行分析鉴定。rDNA基因是结构保守、进化速度缓慢的一种具有记录生物进化历史的特征分子,以其为分类依据建立的系统发育分类系统只与生物的遗传结构有关,因此rDNA基因分析在生物分类中得以普遍应用[2]。
鸡球虫病是由一种或几种艾美耳球虫寄生于鸡肠道引起的危害极为严重的全球性寄生虫病,严重危害家禽的生长发育。全球每年因鸡球虫病造成的经济损失高达24亿美元[3]。由于每种鸡球虫的寄生部位、潜在期、卵囊大小、致病性等有所不同,因此,鉴定球虫的传统方法主要依赖于卵囊形态特征、潜在期、寄生部位和致病性等,但完成这些指标的测定耗时较长、比较繁琐。近来,基于核糖体DNA(rDNA)的分子生物学方法已逐渐用于不同种鸡球虫的分类和鉴定[4,5]。
为了解鸡球虫不同种株间的亲缘关系及其分类地位,本研究对实验室保存的4种15株鸡艾美耳球虫18S rDNA进行克隆、测序,并用DNAstar 5.0分别对孢子虫纲各属代表种、8种艾美耳球虫、柔嫩艾美耳球虫与巨型艾美耳球虫各株孢子化卵囊的18S rDNA序列进行同源性、系统发育树分析,以进一步明确所保藏的鸡球虫各种/株的分类地位,同时也为艾美耳球虫分子遗传学鉴定提供理论基础。
1 材料和方法
1.1 实验所用虫株 4种15株鸡艾美耳球虫(表1)均由中国农业科学院上海兽医研究所保存提供。
1.2 主要试剂 大肠杆菌DH5α为中国农业科学院上海兽医研究所保存提供;pGEM-T easy vector质粒购自Promega公司;总DNA提取试剂DNAzsol购自申能博彩生物科技有限公司;UNIQ-10柱式DNA胶回收试剂盒、Tag Plus DNA聚合酶、IPTG、x-gal均购自上海生工生物工程有限公司;根据参考文献[6]设计球虫18S rDNA引物,上游引物P1:5'-ACCTG GTTGA TCCTG CCAG-3',下游引物 P2:5'-CTTCC GCAGG TTCAC CTACG G -3',由上海赛百盛生物公司合成。
1.3 孢子化卵囊收集 将实验室保存的7株柔嫩艾美耳球虫、2株堆形艾美耳球虫、5株巨型艾美耳球虫和1株毒害艾美耳球虫纯种孢子化卵囊分别接种10羽14日龄罗曼小公鸡,其中柔嫩艾美耳球虫、毒害艾美耳球虫感染剂量为2×104个/羽,于感染后d 8收集盲肠中未孢子化卵囊;堆形艾美耳球虫、巨型艾美耳球虫感染剂量为5×104个/羽,收集感染后d 5~8粪便中的未孢子化卵囊。收集的未孢子化卵囊按常规进行孢子化,参考蒋建林等[7]和Shirley等[8]的方法纯化孢子化卵囊。
1.4 总DNA的提取与PCR扩增及产物回收 分别取0.5 g纯化的4种15株鸡球虫孢子化卵囊提取总DNA,具体操作按DNAzsol说明书进行。取50~100 ng提取的总DNA为模板,加入5μL 10×PCR Buffer、1μL 10 mmol/L dNTP混合物、上下游引物各1μL(50 pmol/L)、2U Tag Plus DNA聚合酶,加ddH2O至总体积为50μL,混匀后轻微离心,于基因扩增仪上进行PCR扩增。反应条件为:94℃ 5 min;94℃ 30 s,61℃ 1 min,72℃ 2.5 min,30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶进行电泳,分析后紫外灯下切取相应片段,使用UNIQ-10柱式DNA胶回收试剂盒回收PCR产物,具体操作按试剂盒说明书进行。
1.5 PCR产物连接及转化 根据pGEM-T easy vector使用说明书,将PCR回收产物与pGEM-T easy vector连接,转化DH5α感受态细胞后涂布在含氨苄青霉素、IPTG和X-gal的LB固体培养基中,37℃培养过夜。
1.6 阳性克隆的鉴定 经蓝白斑筛选后,随机挑取白斑菌落5个分别接种于3 mL LB(含氨苄青霉素)液体培养基中,37℃摇床培养过夜。取2μL培养过夜的菌液为模板,加入2.5μL 10×PCR Buffer、0.5μL 10 mmol/L dNTP混合物、上下游引物各0.5μL(50 pmol/L)、1U Tag Plus DNA 聚合酶,加ddH2O至总体积为25μL,混匀后轻微离心,于基因扩增仪上进行PCR扩增。反应条件为:94℃ 5 min;94℃ 30 s,61℃ 1 min,72℃ 2.5 min,30个循环;72℃延伸10 min。PCR结束后,取10μL PCR产物于1%的琼脂糖凝胶进行电泳分析,根据PCR产物大小确定是否为目的条带。
1.7 测序与序列分析 将含有单一目的片段的PCR扩增产物和经鉴定正确的阳性克隆菌液,送至上海Invitrogen公司测序,所得序列经BLASTn比对确认和软件DNAstar 5.0整理后登录GenBank。测序后获得的序列与从GenBank下载的孢子虫纲16个虫种的18S rDNA序列,用软件DNAstar 5.0 MegAlign分组进行多序列比对、同源性分析及系统发育树构建.
2 结果
2.1 PCR扩增与鉴定 PCR扩增获得了4种15株鸡球虫的18S rDNA基因,大小约1800 bp左右(图1),结果与预期大小一致。PCR产物连接pGEM-T easy克隆载体后转化DH5α感受态细胞,经蓝白斑挑选后,随机挑选5个白斑,摇菌后进行PCR鉴定,结果均为阳性。

图1 PCR扩增电泳图Fig.1 Results of PCR amplif i cation for 18s rDNA
2.2 序列登录和序列下载 将鉴定正确的阳性克隆菌测序结果与PCR产物测序结果比对,获得的正确序列通过软件DNAstar 5.0-SeqMan去除载体序列后,在NCBI网站上Blast同源性比对确认后登录GenBank(登录号见表1),从GenBank下载的孢子虫纲16个虫种18S rDNA序列信息见表2。
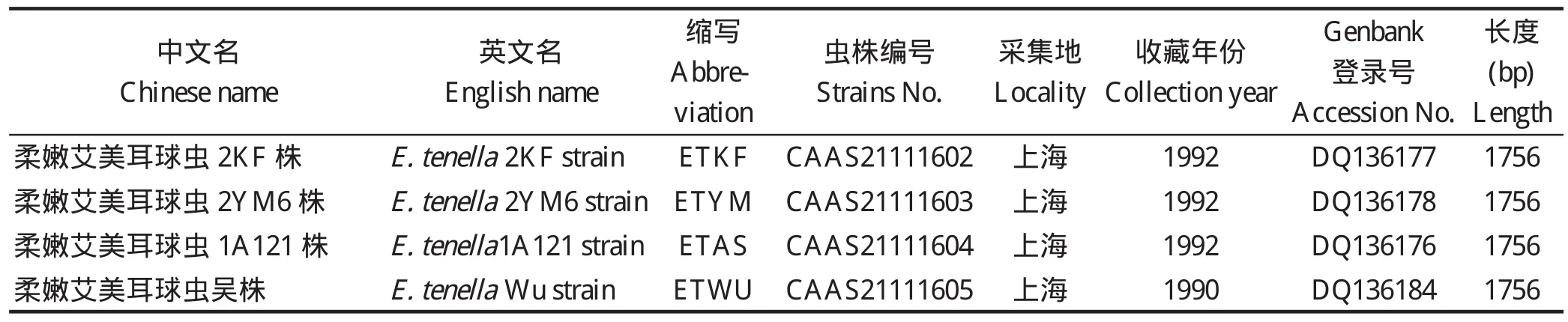
表 1 15株鸡艾美耳球虫信息及获得的18S rDNA序列GenBank登录号Table 1 Information of 15 strains and accession numbers the obtained 18S rDNA in GenBank
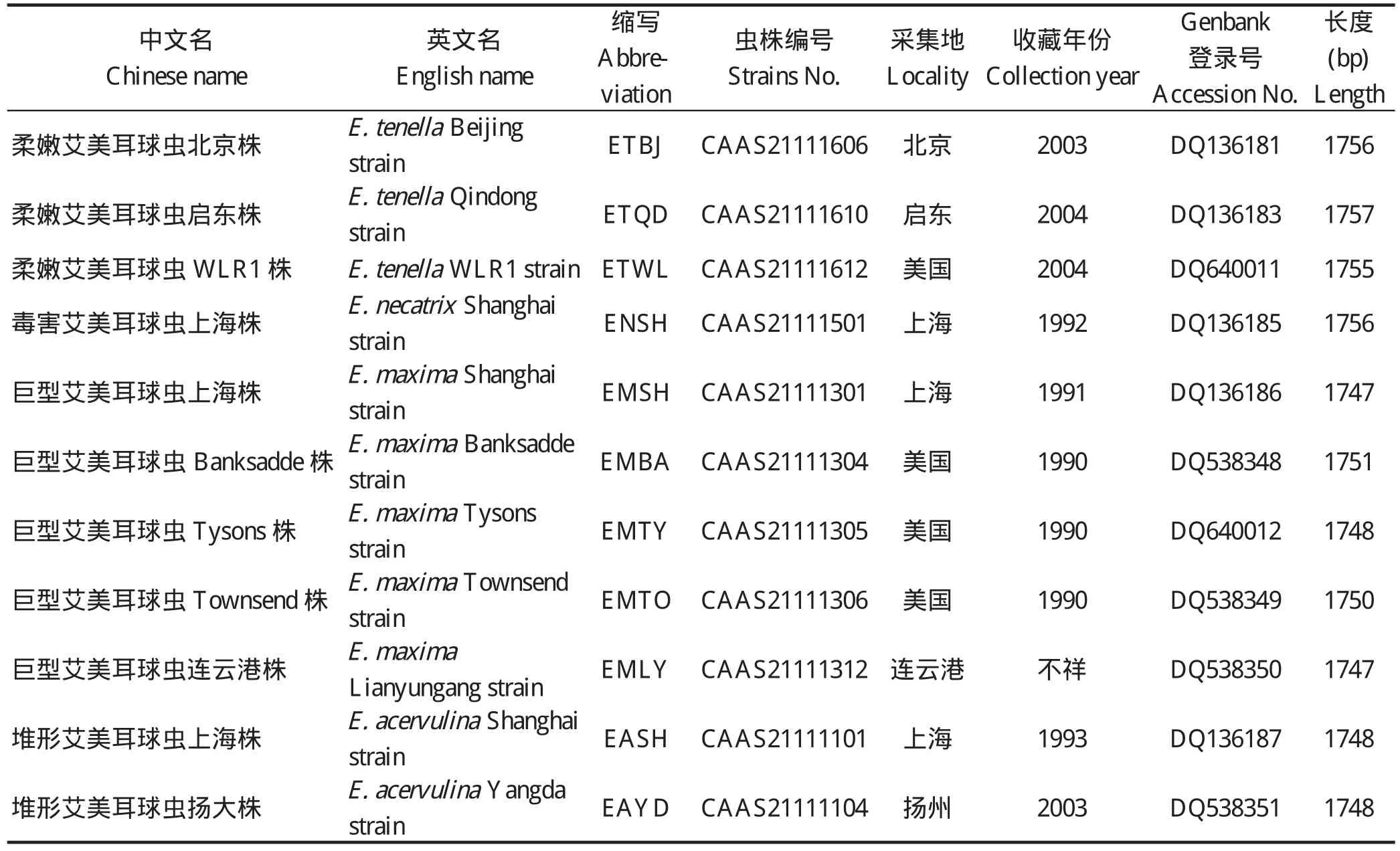
续上表

表2 GenBank下载16个虫种的18S rDNA序列信息Table2 Information of 18s rDNA genes of 16 species download from GenBank
2.3 序列比对和同源性分析 序列比对分析结果显示,8种鸡球虫的18s rDNA序列同源性在92.9%~99.4%之间,其中实验室保存的4种鸡球虫同源性在94.6%~99.4%之间,柔嫩艾美耳球虫与毒害艾美耳球虫之间的同源性最高(99.4%),毒害艾美耳球虫与和缓艾美耳球虫之间的同源性最低(92.9%)(表3)。5株巨型艾美耳球虫的同源性在96.9%~99.8%之间(表4)。7株柔嫩艾美耳球虫的同源性在99.0%~99.9%之间(表5)。

表3 8种鸡球虫18S rDNA序列同源性和差异性Table 3 Percent identity and divergence among 18S rDNA sequences of 8 species of Eimeria

表4 5株巨型艾美耳球虫18S rDNA序列序列同源性和差异性Table 4 Percent identity and divergence among 18S rDNA sequences of 5 strains of E.maxima

表5 7株柔嫩艾美耳球虫18S rDNA序列同源性和差异性Table 5 Percent identity and divergence among 18S rDNA sequences of 7 strains of E.tenella
2.4 系统发育树构建 顶复器门(Apicomplexa)孢子虫纲(Sporozoasida)9个属虫种的18S rDNA序列系统发育树形成5个分支(图2),分别为1)B.bennetti、T.gondii和S.lacertae,2)ETAS和I.robini,3)B.divergens和T.ovis,4)C.parvum,5)P.berghei。
8种鸡艾美耳球虫的18S rDNA序列系统发育树形成2个分支(图3),分别为1)E.mitis、E.mivati、E.brunetti、EMSH、E.praecox、EASH 组成1个大支,其中E.mitis与E.mivati、EMSH与E.praecox为两组姊妹支,E.mitis、E.mivati和E.brunetti亲缘关系较近;2)ENSH与ETAS形成1个独立的分支。

图2 孢子虫纲9个虫种18S rDNA序列系统发育树Fig.2 Phylogenetic tree for 18S rDNA sequences of 9 species of Sporozoasida

图3 8种鸡球虫18S rDNA序列系统发育树Fig.3 Phylogenetic tree for 18S rDNA sequences of 8 species of Eimeria
5株巨型艾美耳球虫的系统发育树形成2个分支(图4),分别为1)EMBA、EMTY和EMTO,2)EMSH、EMLY。7株柔嫩艾美耳球虫(ETAS、ETKF、ETYM、ETWU、ETBJ、ETQD 和 ETWL)的系统发育树也形成2个分支(图5),ETWL与另6个株的距离较远。

图4 5株巨型艾美耳球虫的系统发育树Fig.4 Phylogenetic tree for 18S rDNA sequences of 5 strains of E.maxima

图5 7株柔嫩艾美耳球虫的系统发育树Fig.5 Phylogenetic tree for 18S rDNA sequences of 7 strains of E.tenella
3 讨论
生物的表型性状是其遗传信息在特定外界环境条件下的表达,因此以表型性状为主要分类依据的传统分类系统难以完全排除环境因素的影响以反映生物体之间的亲缘关系。rDNA基因序列的分析和基因结构进化模式的阐述,为生物提供了丰富而有价值的分类信息。根据信息的来源可以找到从界到种各级分类阶元的分子特征,建立生物分子分类标准,纠正以表型性状为主要依据的传统分类系统,完善系统发育分类体系,探求生命起源和生物的进化[9]。rDNA基因功能上具有高度保守性,在所有细胞生物中都存在,进化具有良好的时钟性质,其序列中不同位置上变化的速度不同。由于18S rDNA基因在生物进化过程中具有高度保守性,常用来分析物种系统进化关系或利用特异性引物PCR进行病原检测等,目前也广泛应用于寄生虫分子分类研究中,如牛泰勒虫[10]、锥虫[11]等分类与进化研究。
本研究通过对实验室保存的4种15株鸡艾美耳球虫18s rDNA序列进行克隆和分析,发现4种鸡艾美耳球虫不同种间同源性在94.6%~99.4%之间,巨型艾美耳球虫株间的同源性在96.9%~99.8%之间,柔嫩艾美耳球虫株间的同源性在99.3%~99.9%之间。这说明:第一,种间同源性不一定比株间同源性低,柔嫩艾美耳球虫与毒害艾美耳球虫之间高度同源(同源性达99.4%),而巨型艾美耳球虫2个虫株(EMBA和EMSH)间的同源性仅有96.9%;第二,柔嫩艾美耳球虫株间同源性很高,说明进化速度缓慢,株间变异较小;第三,巨型艾美耳球虫株间同源性差异较大,说明其进化速度很快,株间变异较大,这与巨型艾美耳球虫不同地理株之间的抗原变异最大是一致的。
根据18S rDNA序列构建的系统发育树显示,孢子虫纲9个属虫种的亲缘关系与传统分类一致。如柔嫩艾美耳球虫(ETAS)与诺氏等孢球虫属于同一分支,这2个虫种在传统分类上同属于艾美耳科;贝氏贝诺孢子虫、刚地弓形虫、蝎虎肉孢子虫同属一支,其在传统分类上都属于肉孢子虫科;而疟原虫、隐孢子虫在传统分类上各属于不同的科,其亲缘关系较远而成为独立一支。8种鸡艾美耳球虫的系统发育树显示,柔嫩艾美耳球虫与毒害艾美耳球虫的相似性最高,亲缘关系最近,形成一个独立的分枝,这与其生物学特性一致,二者都在盲肠发育成卵囊,是致病力最强的两个种。和缓艾美耳球虫与变位艾美耳球虫形成一个独立分支,再与其他4种球虫聚为一大支,这与6种球虫都寄生于鸡小肠的生物学特性一致。和缓艾美耳球虫与堆形艾美耳球虫(EASH)的亲缘关系较远,这也进一步证明这两个种是独立种。鸡球虫不同株间的系统发育树显示,地理距离的远近与其亲缘关系有关。如7株柔嫩艾美耳球虫中,来自国内的6株组成一大分支,而来自美国的1株单独为一分支;5株巨型艾美耳球虫中,来自国内的2株与来自美国的3株分别构成二大分支。本文研究结果与Barta等[6]利用8种鸡球虫18S rDNA进行全序列系统分析结果一致,也与利用鸡球虫其他相对保守基因—线粒体细胞色素C氧化酶Ⅰ亚基(mt COⅠ)进行系统进化分析的结果一致[12],表明18S rDNA序列不仅可用于球虫的鉴定,还可用于检测球虫分离株的亲缘关系,为球虫的分子遗传学鉴定提供了理论基础。
[1] 李淑梅.利用分子生物学方法推测寄生原虫间的进化关系[J].国外医学寄生虫病分册, 2003, 30(5): 218-220.
[2] 陈文新.细菌系统发育[J].微生物学报, 1998, 38(3):240.
[3] Shirley M W, Smith A L, Tomley F M.The biology of avian Eimeria with an emphasis on their control by vaccination[J].Adv Parasitol, 2005, 60: 285-330.
[4] Cantacessi C, Riddell S, Morris G M, et al.Genetic characterization of three unique operational taxonomic units of Eimeria from chickens in Australia based on nuclear spacer ribosomal DNA[J].Vet Parasitol, 2008,152: 226-34.
[5] Morgan J A T, Morris G M, Wlodek B M, et al.Real-time polymerase chain reaction (PCR) assays for the specific detection and quantification of seven Eimeria species that cause coccidiosis in chickens[J].Molecular and Cellular Probes, 2009, 23: 83-89.
[6] Barta J R,Martin D S,Liberator P A,et al.Phylogenetic relationship among eight Eimeria species infecting domestic fowl inferred using complete small subunit ribosomal DNA sequence[J].J Parasitol, 1997, 83(2): 262-271.
[7] 蒋建林,蒋金书.柔嫩艾美耳球虫虫体各阶段纯化方式的改进[J].中国农业大学学报, 1996, 1(5): 99-102.
[8] Shirley M W.Eimeria species and strains of chickens[M]//Eckert J, Braun R, Shirley M W, Coudert P, editors.Biotechnology—guidelines on techniques in coccidiosis research.Luxembourg: The European Commission DGXII,1995, 1-24.
[9] 王素英,杨晓丽.rRNA基因与生物分类[J].天津商学院学报, 1999, 19(6): 34-37.
[10] 刘爱红,关贵全,刘军龙,等.牛泰勒虫18S rRNA基因序列比较研究[J].畜牧兽医学报, 2009, 40(7): 1063-1068.
[11] 刘光远,田占成,龚真莉,等.基于18S rRNA基因测序基础上的锥虫分子分类学[J].中国兽医学报, 2009,29(9): 1140-1143.
[12] 王鑫,韩红玉,姜连连,等.鸡球虫mtCOⅠ基因片段序列的克隆与系统学分析[J].水生生物学报, 2008,32(增刊): 74-79.
